Wir haben jetzt drei verschiedene Arten von intramolekularen chemischen Bindungen kennengelernt: die Ionenbindung, die kovalente Bindung und die metallische Bindung. Bei der kovalenten Bindung unterscheidet man zusätzlich noch zwischen unpolarer und polarer Bindung. Somit könnte man sogar von vier Bindungstypen sprechen.
Von welchen Faktoren hängt es nun ab, welche Art von Bindung zwei Atome X und Y miteinander eingehen?
Der entscheidende Faktor ist die Elektronegativität der Elemente. Was ist überhaupt Elektronegativität? Betrachten Sie dazu folgendes Bild:
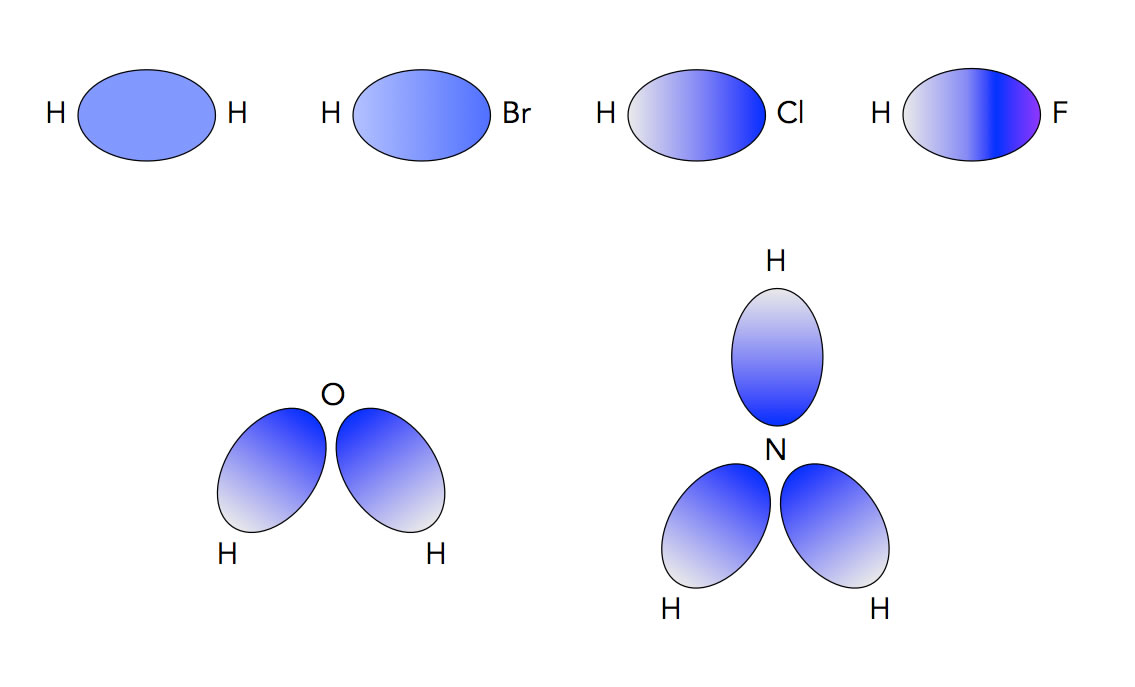
Verschiedene Moleküle, Elektronendichte in der gemeinsamen Kugelwolke durch Farbverlauf dargestellt
Autor: Ulrich Helmich, Lizenz: Public domain.
In diesem Bild sehen wir sechs Moleküle: H2, HBr, HCl, HF, H2O und NH3. Die Bindungselektronen sind nicht zu erkennen, weil sie sich mit irre hoher Geschwindigkeit in der gemeinsamen Kugelwolke bewegen. Die Blaufärbung deutet aber an, mit welcher Wahrscheinlichkeit sich die beiden Bindungselektronen in der Kugelwolke aufhalten. In beiden Fällen ist die Elektronendichte in der Nähe des Brom, Chlor-, Fluor-, Sauerstoff- bzw. Stickstoff-Atoms größer als in der Nähe des Wasserstoff-Atoms. Die Atome der 6. und 7. Hauptgrupe ziehen die Bindungselektronen offensichtlich stärker an als das Wasserstoff-Atom. Man sagt auch: Diese Atome sind elektronegativer als das Wasserstoff-Atom. Elektronegativität ist nämlich ein Maß dafür, wie stark ein Atom die gemeinsamen Bindungselektronen anzieht.
Elektronegativität
Unter der Elektronegativität oder EN eines Elementes versteht man ein Maß dafür, wie stark die Atome dieses Elementes gemeinsame Bindungselektronen anziehen.
Schaut man sich die Abbildung näher an, so erkennt man, dass die Elemente der 6. und 7. Hauptgruppe nicht die gleiche Elektronegativität besitzen. Das Fluor hat die größte Elektronegativität, daher ist hier der Farbverlauf auch sehr stark ausgeprägt, um das deutlich zu machen. Brom dagegen hat eine sehr niedrige Elektronegativität, daher ist hier der Farbverlauf kaum zu erkennen.
Die folgende Tabelle zeigt die Elektronegativitäten der Elemente des Periodensystems:
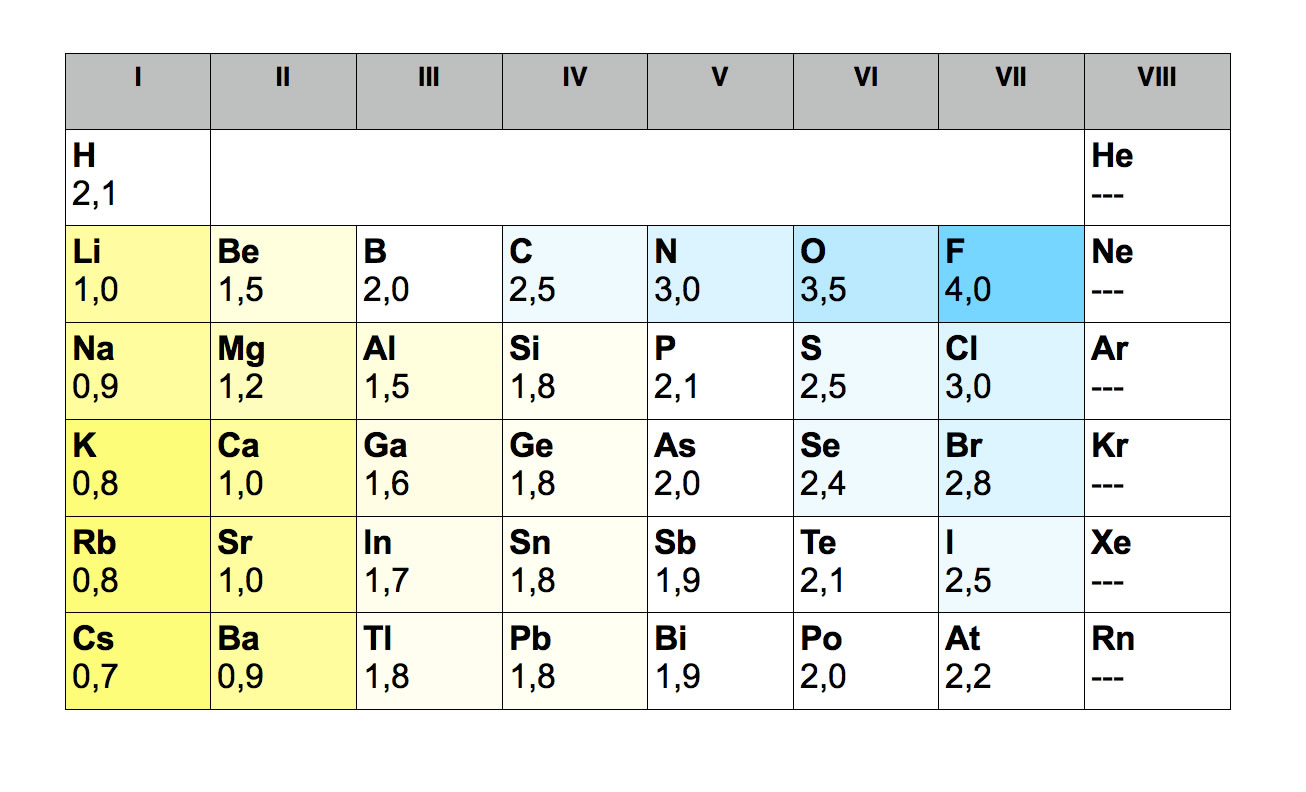
Elektronegativitätswerte wichtiger Hauptgruppenelemente
Fluor ist offensichtlich das Element mit der stärksten Elektronegativität, es hat den größten "Drang", Bindungselektronen an sich zu ziehen. Überhaupt fällt auf, dass die Elemente rechts im Periodensystem (die Edelgase natürlich ausgenommen) sehr hohe EN-Werte haben (Blaufärbung). Die Elemente links im Periodensystem haben dagegen recht niedrige EN-Werte (Gelbfärbung).
Allgemein gilt, dass die EN-Werte im Periodensystem von oben nach unten abnehmen und von links nach rechts ansteigen.
Für das Ansteigen innerhalb einer Periode könnte die zunehmende Kernladung verantwortlich sein - ähnlich, wie wir das bei der Ionisierungsenergie kennengelernt haben. Für das Absinken innerhalb einer Gruppe könnte der zunehmende Abschirmungseffekt durch die inneren Elektronen sein oder einfach die immer geringer werdende Ladungsdichte der Atome (das Volumen des Atoms steigt stärker als die Kernladung, daher wird die Ladungsdichte immer geringer). Aber darum geht es jetzt auch gar nicht, sondern wir wollten ja ein System finden, mit dem sich vorhersagen lässt, was für ein Bindungstyp sich einstellt, wenn zwei Atome X und Y aufeinander treffen.
Bindungstypen
Wenn beide Atome dem gleichen Element angehören, wie es beispielsweise im Chlor-Molekül der Fall ist, so ist die EN-Differenz gleich Null. In diesem Fall liegt eine völlig unpolare kovelante Bindung vor.
Wenn die EN-Differenz recht gering ist wie zum Beispiel im Methan (EN-Differenz der H-C-Bindung = 0,35), liegt eine unpolare oder eine nur schwach polare kovalente Bindung vor. Solche sehr schwach polaren Bindungen wie die C-H-Bindung werden in der organischen Chemie und der Biochemie zu den unpolaren Bindungen gezählt.
Aber Vorsicht: Auch innerhalb eines Verbandes aus gleichen Metallatomen wie zum Beispiel in einem Stück Natrium ist die EN-Differenz gleich Null. Und in Legierungen aus zwei Metallen besteht eine geringe EN-Differenz zwischen den Atomen. Also kann man nicht einfach sagen: Geringe EN-Differenz gleich schwach polare kovalente Bindung. Sondern wir müssen das differenzierter darstellen: Bei geringer EN-Differenz und hoher EN der beiden Elemente haben wir eine schwach polare kovalente Bindung, und bei geringer EN-Differenz und niedriger EN der beiden Elemente liegt eine metallische Bindung vor.
Wie sieht es nun bei polaren bzw. stark polaren kovalenten Bindungen aus? Ein Musterbeispiel ist der Fluorwasserstoff HF. Die EN-Differenz beträgt hier 1,78 und ist damit recht groß, größer jedenfalls als beim MgS (1,27), das ja eine Ionenverbindung ist. Beim H2O, einer anderen wichtigen stark polaren Verbindung, beträgt die EN-Differenz 1,22 und ist somit ebenfalls recht groß. Allgemein könnte man jetzt die Faustregel aufstellen: Bei großer EN-Differenz und recht hoher EN beider Elemente liegt eine polare oder stark polare kovalente Bindung vor. Hat jedoch bei hoher EN-Differenz eines der Elemente eine geringe EN (ist also ein Metall), so liegt eine Ionenbindung vor.
Erstellen wir doch mal einfach eine Graphik, in der auf der X-Achse die EN des jeweils elektronegativeren Elements aufgetragen wird und auf der Y-Achse die EN weniger elektronegativen Elements.
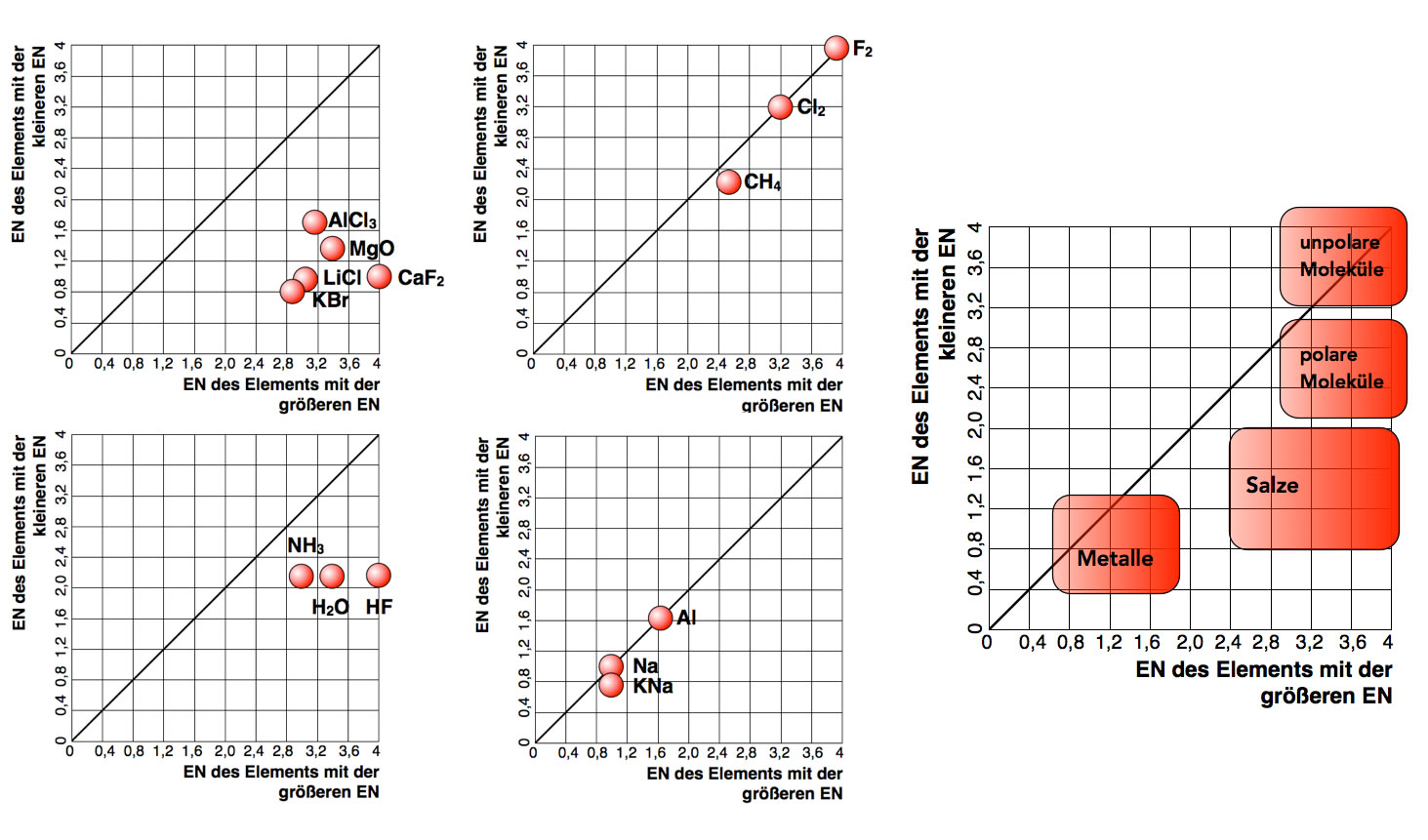
Die EN-Differenz bestimmt die Art der chemischen Bindung
Hier sehen wir die "Position" von fünf Salzen in unserem Koordinatensystem (oben links), von drei unpolaren kovalenten Verbindungen (oben rechts), von drei stark polaren Verbindungen (unten links) sowie von drei Metallen bzw. Legierungen (unten rechts). Vereinigen wir diese vier Graphiken in einer einzigen, so erhalten wir den ganz rechts dargestellten Graphen.
Was man hier gut sehen kann, ist der eher fließende Übergang zwischen der Ionenbindung bei den Salzen und der polaren kovalenten Bindung bei den Molekülverbindungen.
In der Tat gibt es Verbindungen, die von ihren Eigenschaften zwischen diesen beiden Extremen stehen, die also teils salzige Eigenschaften haben, teils aber auch Eigenschaften von polaren kovalent gebundenen Stoffen. Aluminiumchlorid gehört schon zu diesen halb-ionischen, halb-kovalenten Verbindungen. Eine Aluminiumchlorid-Schmelze besteht zum Beispiel nicht aus einzelnen Ionen, sondern aus AlCl3-Molekülen. Auch bei einigen organischen Reaktionen macht man sich die Tatsache zu Nutze, dass Aluminiumchlorid in molekularer Form vorliegt.
Dass der Übergang zwischen stark polar und schwach polar fließend ist, sollte von Anfang an klar gewesen sein. Na ja, und der Übergang zwischen metallischer Bindung und kovalenter Bindung ist sicherlich auch irgendwo zu finden - viele "Halbmetalle" fallen darunter, Silicium zum Beispiel. Schwefel ist ein typisches Nichtmetall, kann aber teilweise in sehr harter Form mit metallisch glänzender Oberfläche vorkommen.
Was ich mit dieser Seite aber eigentlich sagen möchte:
Intramolekulare Bindungen
Die "klassischen" Bindungsarten Ionenbindung, Elektronenpaarbindung und metallische Bindung sind nur Extremfälle auf einer kontinuierlichen Skala von intramolekularen chemischen Bindungen.
Seitenanfang -
Weiter mit den schwachen chemischen Bindungen ...