4.1 Rekapitulation: Schulwissen
Aus dem Schul-Unterricht wissen Sie wahrscheinlich nicht allzu viel über Konformations-Isomerie bei Alkanen, weil das Thema nicht zum Lehrplan der gymnasialen Oberstufe gehört, jedenfalls nicht in NRW.
Auch taucht der Begriff Konformation im Register mancher Schulbücher gar nicht auf, was sehr verwundert, wo der Begriff doch in der molekularen Biologie ständig Verwendung findet. Ein allosterisches Enzym beispielsweise ändert seine Konformation, wenn sich ein Aktivator oder Inhibitor in das allosterische Zentrum setzt. Die Konformation des aktiven Zentrums kann sich bei Bedarf ändern, und Proteine ändern ihre Konformation, wenn sich Temperatur oder pH-Wert ändern.
Allgemein versteht man unter der Konformation die räumliche Gestalt eines Moleküls, die sich ergibt, wenn man Atomgruppen um vorhandene kovalente Einfachbindungen dreht. Aber im Grunde sind wir jetzt schon mitten in der Studienvorbereitung zur Organischen Chemie.
4.2 Vorbereitung auf das Chemie-Studium
4.2.1 Konformationen des Ethan-Moleküls
Schauen Sie sich das folgende Molekül-Modell einmal näher an:
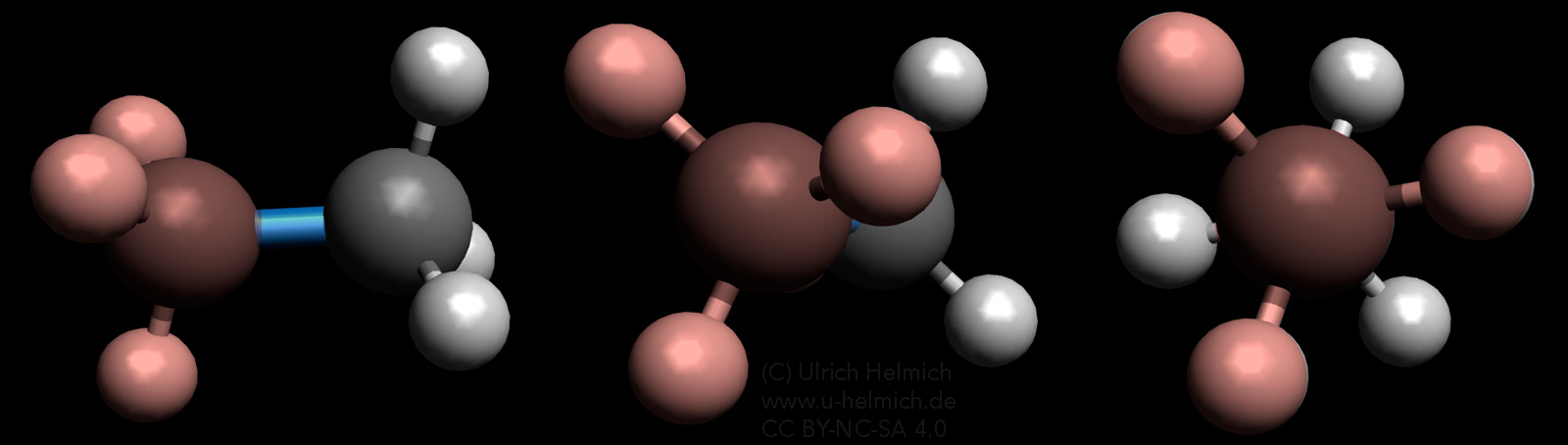
Ein Ethan-Molekül aus drei verschiedenen Winkeln betrachtet
Autor: Ulrich Helmich 2022, Lizenz: Lizenz: Public doman
Auf diesem Bild sieht man das computergenerierte Modell eines Ethan-Moleküls, von drei Seiten betrachtet. Links ist das Molekül von der Seite zu sehen, in der Mitte sieht man es schräg von vorne, und rechts blickt man frontal auf eines der beiden C-Atome. Der bessern Übersichtlichkeit wegen ist das "vordere" C-Atom mit seinen drei H-Atomen rötlich eingefärbt. Die C-C-Einfachbindung ist blau dargestellt.
Nun will nicht jeder seinen Computer anwerfen, um mal ein solches Molekül zu zeichnen, sondern möchte es schnell mit Bleistift und Papier skizzieren. Für diesen Zweck gibt es die sogenannte Newman-Projektion, die Moleküle wie Ethan stark schematisiert darstellt. Das nächste Bild zeigt ein Ethan-Molekül in der Newman-Projektion:
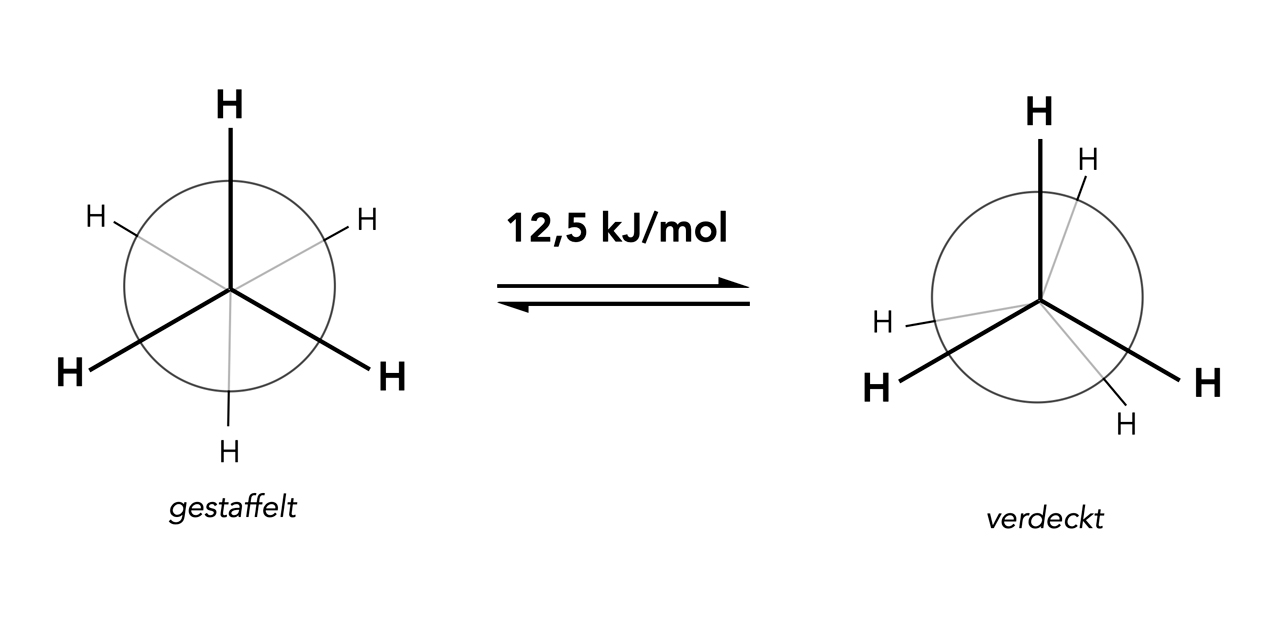
Die zwei Konformations-Isomere des Ethans
Autor: Ulrich Helmich 2022, Lizenz: Lizenz: Public domain.
Bei der Newman-Projektion blickt man frontal auf das "vorderste" C-Atom des Moleküls, ähnlich wie bei dem rechten Bild in Abbildung 1. Der große Kreis symbolisiert dann das "hintere" C-Atom.
Ich selbst "verschönere" diese Projektion immer etwas, indem ich die "vorderen" H-Atome größer darstelle als die "hinteren".
Aufgabe:
Fassen Sie die in Abbildung 2 dargestellten Erkenntnisse kurz zusammen.
Lösung:
Die Abbildung zeigt die Auswirkungen der freien Drehbarkeit der beiden Methylgruppen um die C-C-Einfachbindung. In dem linken Bild ist die sogenannte gestaffelte Konformation des Ethan-Moleküls zu sehen, in dem rechten Bild die verdeckte Konformation. Bei der verdeckten Konformation stehen die H-Atome der beiden Methylgruppen genau hintereinander, die vorderen H-Atome verdecken also die hinteren H-Atome. Bei der gestaffelten Konformation befinden sich die hinteren H-Atome in den Lücken, die von den vorderen H-Atomen gebildet werden.
Das war schon eine sehr ausführlich Antwort, bei der auch die Abbildungs-Unterschrift ausgewertet wurde. In dieser Antwort wurde aber noch nicht auf den Energiebetrag eingegangen, der auf den beiden Pfeilen zu sehen ist.
Frage:
Wie ist der Energiebetrag auf den beiden Pfeilen zu verstehen?
Antwort:
Bei den Pfeilen handelt es sich um Gleichgewichts-Pfeile. Das heißt wohl, dass die beiden Konformationen ineinander übergehen können. Aus der gestaffelten Konformation kann die verdeckte werden und umgekehrt. Allerdings ist für diese Konformations-Änderung ein kleiner Energiebetrag aufzuwenden, es gibt also eine Art Rotationsbarriere, die überwunden werden muss.
Eine sehr kompetente Antwort, sehr gut, Sie können sich wieder setzen!
Bei chemischen Reaktionen haben wir ja in der Schule gelernt, dass zunächst Aktivierungsenergie aufgebracht werden muss, um die Reaktion in Gang zu setzen. Man sprach bestimmt auch von einem Energieberg, der überwunden werden muss. Ähnlich haben wir es auch bei der Konformations-Änderung mit einem Energieberg zu tun, der zunächst überwunden werden muss. Allerdings ist dieser Energieberg mit ca. 12 kJ/mol sehr winzig. Im Clayden wird dieser Energieberg als Rotationsbarriere bezeichnet. In diesem Buch finden sich auch interessante Informationen zu den Auswirkungen dieser Rotationsbarriere auf die Häufigkeit der Konformations-Änderungen.
Wenn die Höhe der Rotationsbarriere bei 73 kJ/mol liegt, dann findet eine Drehung um die C-C-Einfachbindung exakt 1 mal pro Sekunde statt. Die Rotationsfrequenz hat dann also den Wert 1/s.
Eine Verminderung der Barriere um 6 kJ/mol erhöht die Rotationsfrequenz um den Faktor 10, jedenfalls bei Zimmertemperatur.
Aus diesen Angaben [3, S. 402] kann man nun eine schöne Tabelle erstellen:
| Rotationsbarriere in kJ/mol | Rotationsfrequenz in Drehungen / s |
| 73 | 1 |
| 67 | 10 |
| 61 | 102 |
| 55 | 103 |
| 49 | 104 |
| 43 | 105 |
| 37 | 106 |
| 31 | 107 |
| 25 | 108 |
| 19 | 109 |
| 13 | 1010 |
Nach den Daten dieser Tabelle müsste also die Rotationsfrequenz bei einem Ethan-Molekül zwischen 108 und 109 pro Sekunde liegen.
Nach einer anderen Berechnung liegt die Halbwertszeit für die Rotation bei 2 * 10-11 Sekunden. In dieser kurzen Zeitspanne haben sich also 50% der Ethan-Moleküle von der einen gestaffelten Konformation um 120 Grad in die andere gestaffelte Konformation gedreht [5].
Frage:
Was meinen Sie, welche der beiden Konformationen ist die energetisch günstigere?
Antwort:
In der verdeckten Konformation ist der Abstand zwischen den Elektronenwolken der C-H-Bindungen geringer als in der gestaffelten Konformation. Daher wird der Energiegehalt der verdeckten Konformation etwas höher sein als der Energiegehalt gestaffelten Konformation.
Das Energiediagramm in der nächsten Abbildung bestätigt diese Antwort:
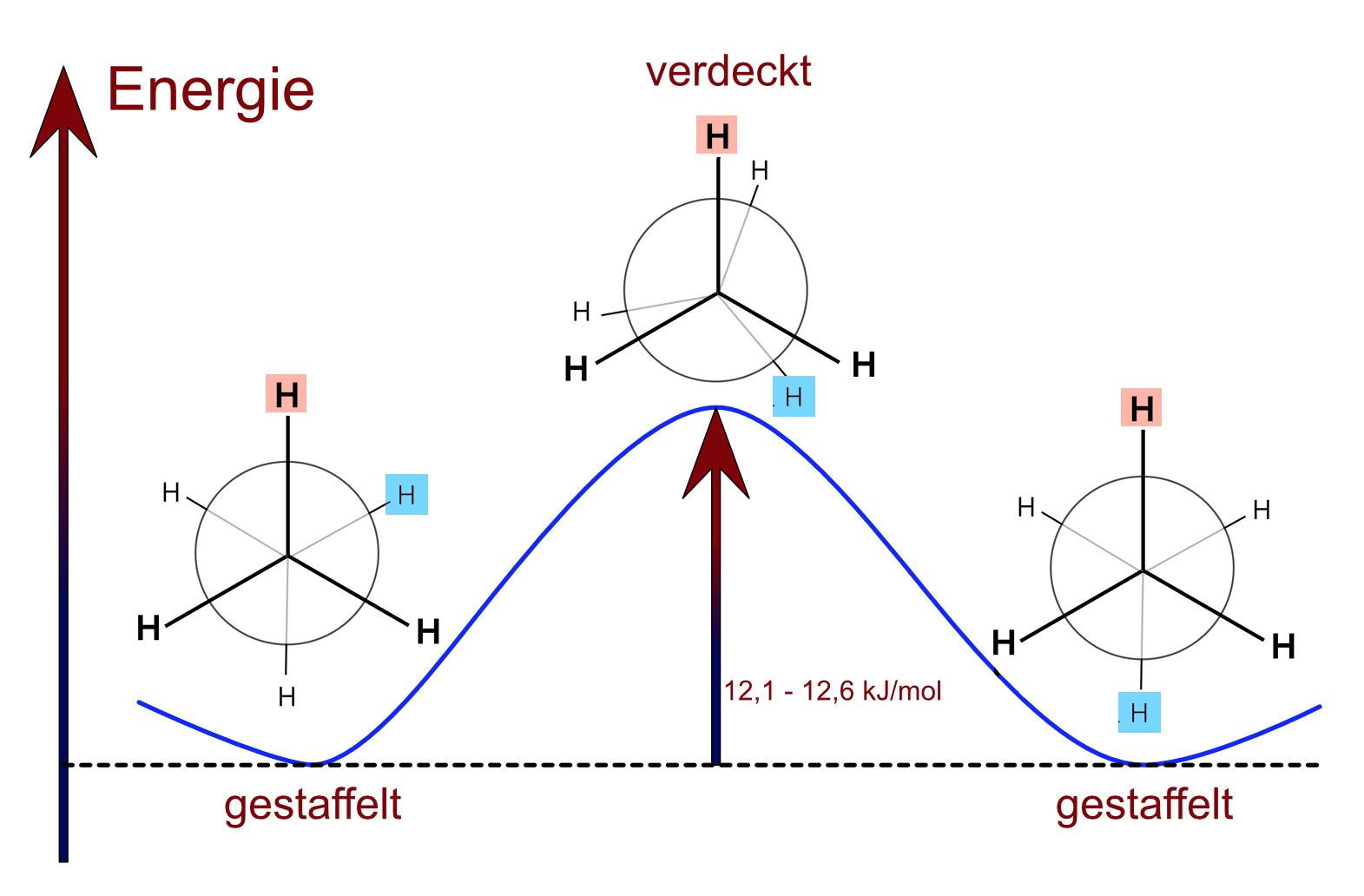
Der Energiegehalt der Ethan-Konformationen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die gestaffelte Konformation ist tatsächlich um ca. 12,1 bis 12,6 kJ/mol stabiler als die verdeckte. Trotz der extrem hohen Rotationsgeschwindigkeit (siehe oben) liegen bei Zimmertemperatur ca. 99,5% aller Ethan-Moleküle in der energieärmeren gestaffelten Konformation vor (von 200 Molekülen also 199) .
4.2.2 Konformationen des Propans
In den Hochschul-Lehrbüchern findet man meistens diese beiden Konformationen des Propans:
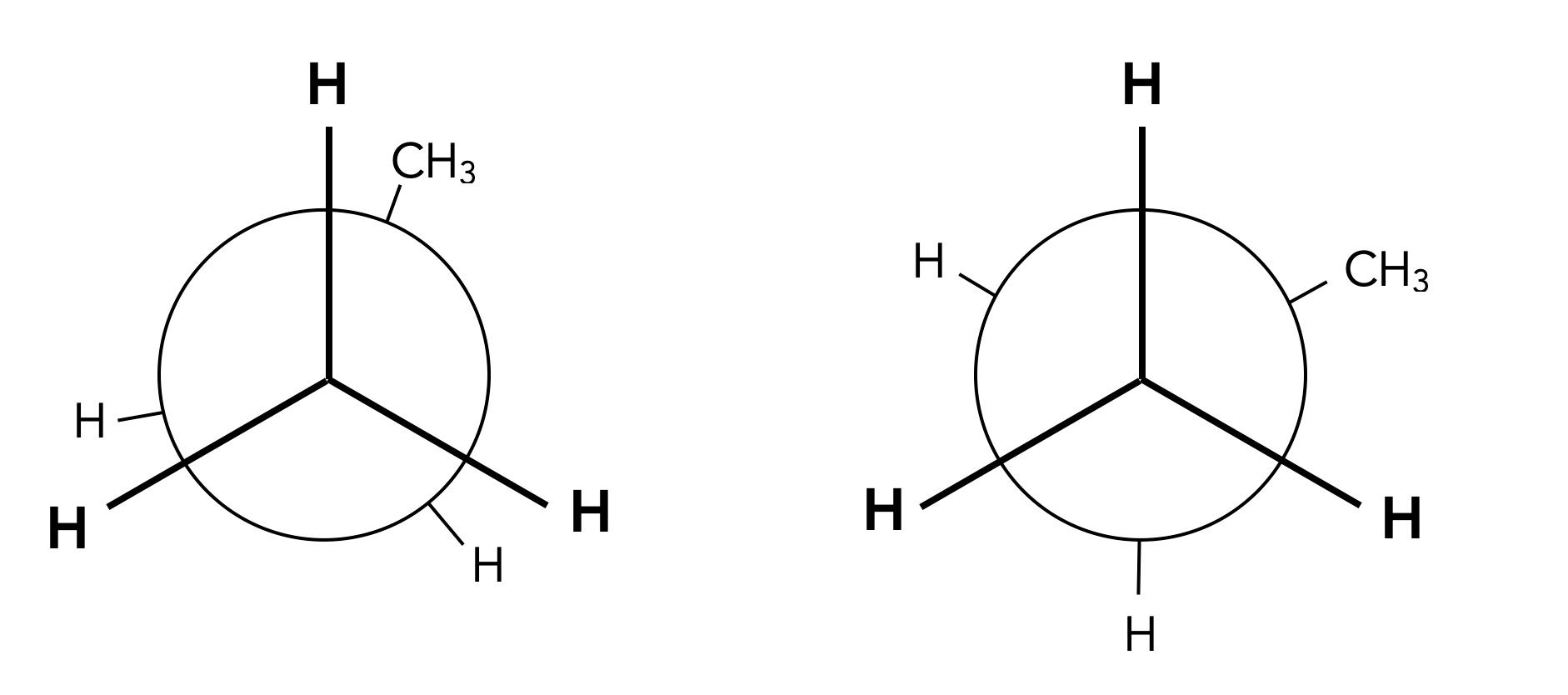
Die verdeckte und die gestaffelte Konformation des Propans
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Natürlich gibt es weitere Propan-Konformationen, aber interessant sind eigentlich nur die Konformationen, die durch Drehungen um C-C-Einfachbindungen um genau 60 Grad gebildet werden.
4.2.3 Konformationen des Butans
Beim Butan wird es noch interessanter. Die Lehrbücher erwähnen hier zwei verschiedene gestaffelte Konformationen, die als gauche und anti bezeichnet werden. Die Drehungen der C1- und C4-Methylgruppen werden dabei nicht berücksichtigt, dann gäbe es nämlich noch vier weitere Möglichkeiten für Konformationen.
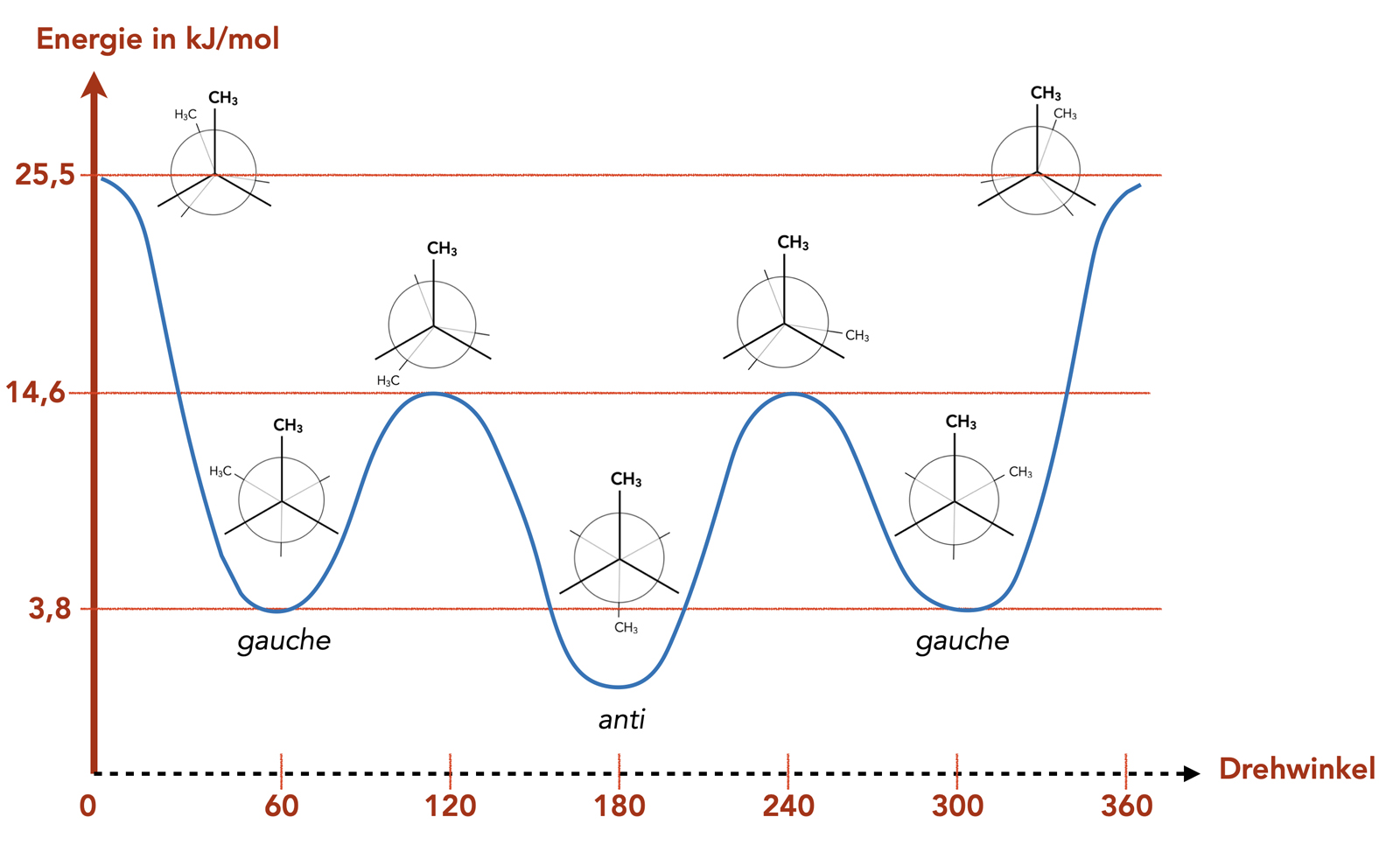
Der Energiegehalt der Butan-Konformationen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir ein Energiediagramm für die Übergänge zwischen den wichtigen "interessanten" Konformationen des Butans. Am stabilsten ist die anti-Konformationen, aber die beiden gauche-Konformationen sind ebenfalls recht stabil, aber nicht ganz so stabil wie die anti-Konformation.
Die drei verdeckten Konformationen sind quasi Übergangszustände zwischen den energetisch stabileren gestaffelten Konformationen.
Frage:
Warum ist die anti-Konformation noch etwas stabiler als die beiden gauche-Konformationen?
Antwort:
Die Methylgruppen sind im Verhältnis zum Butan-Molekül recht groß und beeinflussen sich daher gegenseitig. Man spricht auch von einer sterischen Hinderung. In der anti-Konformation ist diese Beeinflussung noch am geringsten, daher hat diese den niedrigsten Energiegehalt, ist also energetisch günstiger als die gauche-Konformation.
Die Übergangszustände sind nur von sehr kurzer Dauer (wie eigentlich immer bei Übergangszuständen) und haben daher keine speziellen Namen.
Übungen
Die Lösungen dieser Aufgaben und der Aufgaben der Kapitel 2 und 3 (Cycloalkane, Alkene) können Sie gegen eine Kostenbeteiligung von 5 Euro über Paypal als PDF-Datei von mir erhalten (einfach auf den Spenden-Button klicken und als Verwendungszweck "Lösungen Organik 1-3" angeben).
Aufgabe 4.1**
Ähnlich wie das Ethan-Molekül kommt auch das Propan-Molekül in einer verdeckten und einer gestaffelten Konformation vor. Während der Energieunterschied beim Ethan laut [4] 12.1kJ/mol beträgt, ist die verdeckte Konformation beim Propan um 13,4 kJ/mol energiereicher als die gestaffelte Konformation. Begründen Sie, woran das liegt.
Aufgabe 4.2**
Experimentelle Untersuchungen ergaben, dass der Winkel in den gauche-Konformationen des Butans etwas größer ist als die theoretisch angenommenen 60 Grad [2]. Finden Sie eine Begründung dafür.
Quellen und Literatur-Empfehlungen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Vorlesung "Organische Chemie 1.07" von Prof. Dyker auf Youtoube (2012).
Seitenanfang -
Weiter mit der Radikalischen Substitution ...