Am Ende dieser Seiten möchte ich noch kurz auf die drei wichtigsten Säure-Begriffe eingehen, nämlich die Säure-Begriffe von ARRHENIUS, BRØNSTED und LEWIS.
Säure/Base-Begriff von ARRHENIUS
Svante August Arrhenius (1859 - 1927) war ein schwedischer Physiker und Chemiker, der entdeckte, dass Salze in Kationen und Anionen dissoziieren, wenn man sie in einem polaren Lösemittel wie Wasser löst:
$NaCl{(s)} \to Na^{+}_{(aq)}+ Cl^{-}_{(aq)}$
Für diese Entdeckung erhielt Arrhenius 1903 den Nobelpreis für Chemie.
Einige Zeitgenossen von Arrhenius konnten sich nicht vorstellen, dass ein Salz wie NaCl in positive und negative Ionen zerfällt, ohne dass man vorher eine Spannung anlegen musste. Elektrolysen waren schon lange vorher bekannt, und viele Elemente wie Kalium oder Natrium wurden ja durch Elektrolyse von Salzschmelzen entdeckt, aber dass ein einfaches Lösemittel wie Wasser ausreicht, um ein Salz in seine Ionen zu zerlegen, war damals schon eine Sensation.
Doch nicht nur Salze wie NaCl konnten durch Wasser in Ionen zerlegt werden, auch viele saure (Zitronensäure, Weinsäure, Schwefelsäure...) und alkalische Verbindungen (Natriumhydroxid, Calciumhydroxid...). konnten durch polare Lösemittel in positive und negative Ionen getrennt werden.
Arrhenius nahm an, dass saure Verbindungen, wenn man sie in Wasser löst, in Protonen und einen negativen Säurerest zerfallen, während alkalische Verbindungen in Hydroxid-Ionen und einen positiven Baserest zerfallen, also zum Beispiel so:
$HCl{(g)}\to H^{+}_{(aq)}+ Cl^{-}_{(aq)}$
bzw. so:
$NaOH{(s)}\to OH^{-}_{(aq)}+ Na^{+}_{(aq)}$
Arrhenius definierte dann den Begriff der Säure bzw. Base folgendermaßen:
Säuren und Basen
Säuren sind Wasserstoff-Verbindungen, die in wässriger Lösung unter Bildung von Protonen und Säurerest-Anionen zerfallen.
Basen sind Verbindungen, die in wässriger Lösung unter Bildung von Hydroxid-Ionen und Baserest-Kationen zerfallen.
Säure/Base-Begriff von BrØnsted
Den Säure-Begriff von BRØNSTED haben wir ja bereits kennengelernt. Nach BRØNSTED sind Säuren Moleküle oder Ionen, die Protonen abgeben können und daher als Protonendonatoren bezeichnet werden.
Dieser Säure-Begriff ist weitgehend deckungsgleich mit dem Säure-Begriff von Arrhenius, bezieht sich aber auf Teilchen und nicht auf Verbindungen und ist daher wesentlich flexibler.
Salzsäure ist nach BRØNSTED keine Säure, sondern eine saure Lösung, während die Verbindung Chlorwasserstoff HCl(g) eine Säure ist.
Auch der Base-Begriff von BRØNSTED ist bereits bekannt. Danach sind Basen Atome, Moleküle oder Ionen, die ein Proton anlagern können. Basen werden von BRØNSTED auch als Protonenakzeptoren bezeichnet.
Dieser Base-Begriff unterscheidet sich stark von dem Base-Begriff von Arrhenius. Das wird am Beispiel NaOH bzw. Natronlauge deutlich.
Das Beispiel NaOH
Nach Arrhenius ist Natriumhydroxid eine Base. Wenn man NaOH in Wasser auflöst, dissoziiert das Salz in Natrium-Ionen und Hydroxid-Ionen, und damit ist die Definition einer Base nach Arrhenius erfüllt.
Nach BRØNSTED dagegen ist NaOH ein Salz, das beim Auflösen in Wasser Natrium-Ionen und Hydroxid-Ionen freisetzt. Die bei dieser Dissoziation gebildeten Hydroxid-Ionen sind nach BRØNSTED allerdings Basen, denn sie können ja Protonen aufnehmen.
Das Beispiel NH3
Ammoniak ist nach Arrhenius keine Base, denn das NH3-Molekül enthält ja keine OH-Gruppe, die als OH--Ion abgegeben werden könnte. Nach BRØNSTED aber ist Ammoniak eine Base, denn das N-Atom des NH3-Moleküls besitzt ein freies Elektronenpaar, an das sich ein Proton anlagern kann.
Säure/Base-Begriff von Lewis
Als ob es nicht schon genug Säure/Base-Begriffe gäbe, welche die Schülergehirne verwirren, hat der Chemiker Gilbert Newton Lewis (1875 - 1946) einen weiteren, noch moderneren Säure/Base-Begriff geschaffen. Im Chemieunterricht der gymnasialen Oberstufe spielt dieser Säure/Base-Begriff jedoch nur eine untergeordnete bis gar keine Rolle, trotzdem wollen wir uns die Definitionen einmal kurz anschauen.
Säure
Eine Lewis-Säure ist ein Elektronenpaar-Akzeptor.
Base
Eine Lewis-Base ist ein Elektronenpaar-Donator.
Das Beispiel Aluminiumchlorid
Aluminium ist ein Metall der dritten Hauptgruppe, es steht direkt unter dem Bor. Als Element der dritten Hauptgruppe hat Aluminium drei Außenelektronen, die es leicht an einen Elektronen-Akzeptor wie Chlor oder Brom abgibt. Daher bildet sich AlCl3 oder AlBr3 recht leicht in einer exothermen Reaktion.
Die Bildung von AlBr3 kann man übrigens schön als Demonstrationsexperiment im Abzug durchführen - sehr eindrucksvoll! Dazu gibt man etwas elementares Brom in ein großes Reagenzglas und stellt dann eine Röhre aus Aluminiumfolie in das Reagenzglas hinein. Zunächst passiert gar nichts, aber nach einiger Zeit kommt es dann zu einer heftigen Reaktion, bei der das Metall aufglüht und Bromdämpfe aus dem Reagenzglas herausquellen.
Aluminiumchlorid und -bromid sind klassische LEWIS-Säuren. Stellen wir uns das Aluminiumchlorid-Molekül nach dem Kugelwolkenmodell vor.

Das AlCl3-Molekül nach dem Kugelwolkenmodell
In der Mitte der Abbildung sehen wir ein Al-Atom mit seinen vier Kugelwolken (blau eigefärbt). Drei dieser Kugelwolken sind mit je einem Elektron besetzt, die vierte Kugelwolke ist leer (rot gefärbt).
Die drei einfach besetzten Kugelwolken überlappen nun mit den ebenfalls einfach besetzten Kugelwolken von Chlor-Atomen (grün eingefärbt).
Die Bindungen zwischen dem Al-Atom und den Cl-Atomen sind weder rein ionisch noch rein kovalent, sondern der Bindungstyp liegt irgendwo zwischen ionisch und kovalent-polar; das liegt an dem recht geringen EN-Unterschied zwischen Aluminium und Chlor. Für eine polare kovalente Bindung ist der EN-Unterschied zu groß, für eine Ionenbindung aber zu klein.
Was macht das Aluminumchlorid nun zu einer Lewis-Säure? Das Vorhandensein der leeren Kugelwolke ist hier entscheidend. Mit dieser leeren Kugelwolke kann sich das AlCl3-Molekül nun an andere Teilchen setzen, die ein freies Elektronenpaar (eine doppelt besetzte Kugelwolke) anbieten, zum Beispiel an das NH3-Molekül oder an ein Chlorid-Ion. Tatsächlich bildet sich aus AlCl3 und Cl- die Verbindung AlCl4-.
Aluminiumbromid AlBr3 hat die gleiche Struktur wie Aluminiumchlorid und ist auch eine Lewis-Säure. AlBr3 spielt eine wichtige Rolle bei der Bromierung von Aromaten (elektrophile Substitution). Das AlBr3-Molekül ist in der Lage, ein Br2-Molekül heterolytisch zu spalten, so dass ein Br+ - und ein Br--Ion entstehen. Das Br--Ion lagert sich dann an die freie Kugelwolke des AlBr3 an, und es entsteht der AlBr4-.-Komplex. Das Br+-Ion greift dann als Elektrophil das Benzol-Molekül an.
Die Base-Begriffe von BRØNSTED und Lewis ähneln sich sehr stark, weil beide Begriffe sich auf das freie Elektronenpaar (die doppelt besetzte Kugelwolke) des Teilchens beziehen. BRØNSTED-Basen können allerdings nur Protonen anlagern (Protonen-Akzeptoren), während Lewis-Basen alle möglichen Teilchen mit einer leeren Kugelwolke anlagern können.
Das Beispiel Carbenium-Ion
Aus der organischen Chemie kennen Sie vielleicht schon den Begriff Carbenium-Ion. Darunter versteht man ein organisches Molekül mit einem positiv geladenem C-Atom.
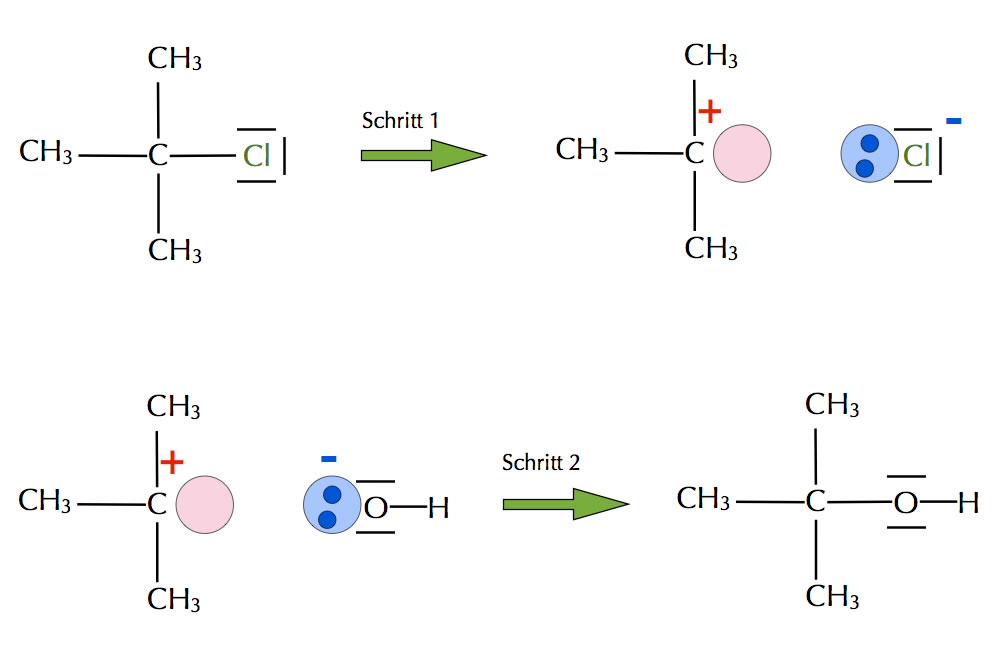
Beispiel für eine nucleophile Substitution
Dieses Bild zeigt eine sogenannte nucleophile Substitution nach dem SN1-Mechanismus, der in zwei Schritten erfolgt. Im ersten Schritt spaltet die Verbindung 2-Chlor-2-methyl-propan das Chlor-Atom als Chlorid-Ion ab. Zurück bleibt ein positiv geladenes Carbenium-Ion mit einer leeren Kugelwolke am zentralen C-Atom (roter Kreis). Dieses Carbenium-Ion ist jetzt eine klassiche Lewis-Säure, das abgespaltene Chlorid-Ion ist eine Lewis-Base.
Im zweiten Reaktionsschritt lagert die Lewis-Säure eine neue Lewis-Base an, nämlich das Hydroxid-Ion. Es entsteht der Alkohol 2-Methyl-propan-2-ol. Was in der organischen Chemie als "nucleophile Substitution nach dem SN1-Mechanismus" (siehe dort) bezeichnet wird, kann jetzt auch als Säure/Base-Reaktion nach Lewis angesehen werden.