523 Aufrufe im Zeitraum 28.04.2025 – 04.05.2025
Diese Seite war die meist aufgerufene Chemie-Seite meiner Homepage in diesem Zeitraum, also hochgerechnet über 2.000 mal im Monat.
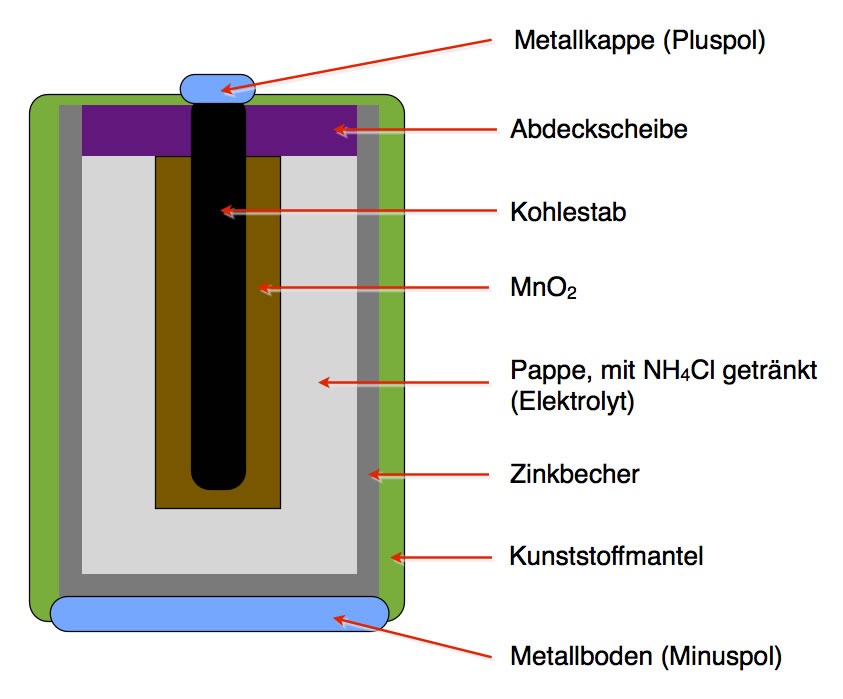
Hier sehen wir eine vereinfachte Schemazeichnung einer Zink-Kohle-Batterie im Längsschnitt. Das sogenannte Leclanché-Element wurde um 1865 von Georges LeclancÉ (1839-1882) entwickelt. Es sollte besser als Zink-Braunstein-Element bezeichnet werden, da nicht der Kohlenstoff an den chemischen Reaktionen teilnimmt, sondern der Braunstein MnO2. Der Graphit-Stab in der Mitte der Batterie dient nur dazu, dem Braunstein die Elektronen zuzuleiten.
Reaktionen an der Anode
Die Reaktionen des Minuspols, der Anode, sind zunächst recht einfach. Das Zink wird oxidiert und gibt dabei je zwei Elektronen ab:
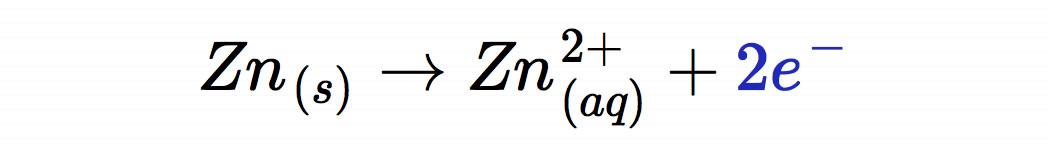
Mit den Begriffen "Anode" und "Kathode" muss man aufpassen. Bei einer Elektrolyse entspricht die Anode dem Pluspol. Hier werden die Anionen (negativen Ionen) von der Anode angezogen, und die Kationen (positiven Ionen) werden von der Kathode, dem Minuspol, angezogen.
Bei einer Batterie ist es genau anders herum. Hier bezeichnet man als Anode diejenige Elektrode (bzw. Halbzelle) mit dem negativeren Redoxpotenzial, dort, wo die Oxidationsreaktion stattfindet wie zum Beispiel die oben gezeigte Oxidation des Zinks. Bei galvanischen Elementen und Batterien ist die Anode also der Minuspol, und die Kathode der Pluspol.
Reaktionen an der Kathode
Was passiert nun am Pluspol der Batterie, der Kathode? Hier wird das Mangan(IV)oxid zu Mangan(III)hydroxid reduziert:
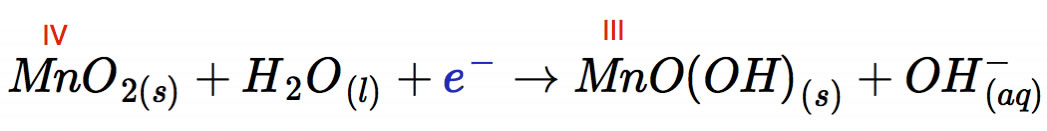
Für jedes oxidierte Zink-Ion läuft diese Reaktion zweimal ab.
Die Zahlen IV und III über den Symbolen in der obigen Reaktionsgleichung stellen die Oxidationszahlen dar. Wenn Sie nicht mehr wissen, wie man die Oxidationszahl eines Atoms oder Ions berechnet, sollten Sie auf diese Seite gehen und sich dort informieren.
Reaktionen im Elektrolyten
Neben diesen beiden Primärreaktionen laufen im Elektrolyten der Zink-Braunstein-Batterie weitere Reaktionen ab, die für die Funktion der Batterie wichtig sind.
Die technische Umsetzung der verschiedenen Typen dieser Batterie ist oft unterschiedlich, aber allen gemeinsam ist das Vorhandensein eines Elektrolyten, der Ammoniumchlorid enthält. Ob es nun wie auf der obigen Zeichnung eine mit Ammoniumchlorid-Lösung getränkte Pappe ist oder eine Paste, die Ammoniumchlorid enthält, ist im Prinzip egal.
Die bei der Reduktion gebildeten Hydroxid-Ionen reagieren mit den Ammonium-Ionen des Elektrolyten:
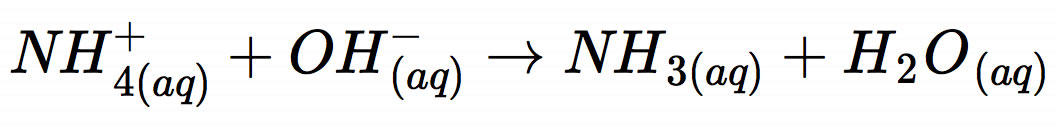
Bei dieser klassischen Protolyse entsteht Ammoniak, ein giftiges Gas, das hier noch in dem Elektrolyten gelöst ist. Aber keine Sorge; die giftigen Ammoniak-Moleküle reagieren mit den Zink-Ionen und werden dadurch gebunden und unschädlich gemacht:
![Zn2+ + 2 NH3 ==> [Zn(NH3)2]2+](Bilder/ZnC05.jpg)
Diese Reaktion ist weder eine Protolyse noch eine Redoxreaktion, sondern eine Komplexbildungsreaktion. Zwei oder mehrere Moleküle oder Ionen lagern sich einfach zu einem komplexeren Gebilde zusammen, ohne das Protonen bzw. Elektronen von einem Donator zu einem Akzeptor fließen. Mit dem Kugelwolkenmodell kann man solche Reaktionen leider nicht erklären, da hier Atomorbitale eine Rolle spielen, die das Kugelwolkenmodell nicht kennt.
Die gelösten Komplex-Kationen verbinden sich nun mit den Chlorid-Ionen der Elektrolyt-Lösung zu einem schwerlöslichen komplexen Feststoff:
![[Zn(NH3)2]2+ + 2Cl- ==> [Zn(NH3)2]Cl2](Bilder/ZnC06.jpg)
Ich glaube, das Ganze schauen wir uns noch einmal besser im Schema an:
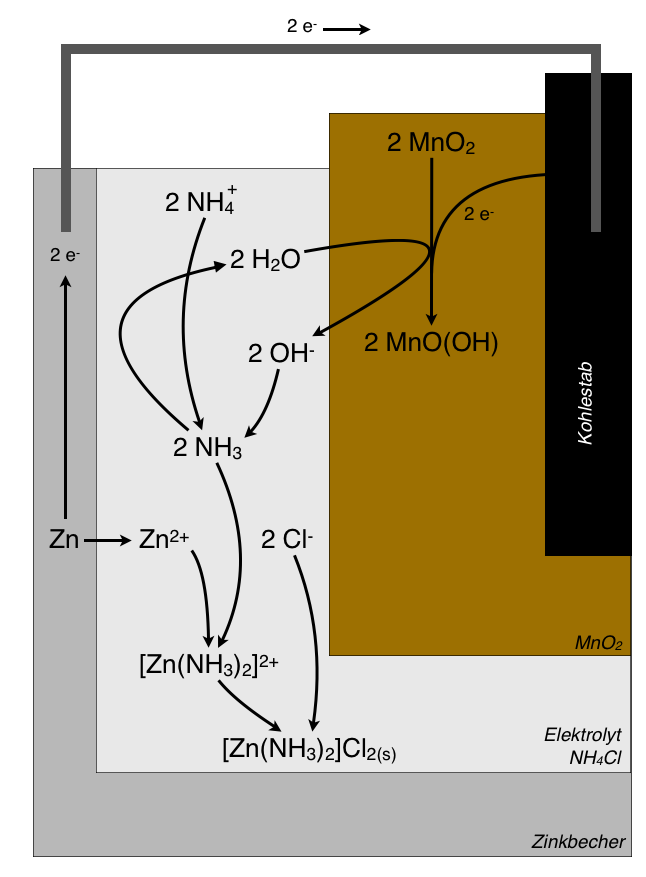
Dieses Schema spricht eigentlich für sich, die einzelnen Reaktionen wurden bereits ausführlich erläutert.
Auf der Seite LearningApps.org habe ich eine Zuordnungsaufgabe zum Thema Zink-Braunstein-Batterie erstellt:
Falls die App nicht korrekt angezeigt wird, hier ist der Direktlink zu LearningApps.