Der Lithium-Ionen-Akku ist der "Star der Akkus im Consumerbereich" (Salters Chemie, Theoretische Grundlagen, Braunschweig 2012) oder der "Trendsetter" bei den Akkus (Chemie 2000+, Buchner-Verlag 2014). Er findet sich fast in allen Handys, Smartphones, Digitalkameras und so weiter. Aber auch in größerer Ausführung verdrängt der Lithium-Ionen-Akku andere Systeme, zum Beispiel bei Elektroautos oder E-Bikes (Elektro-Fahrrädern).
Hierfür gibt es vor allem zwei Gründe:
Erstens hat Lithium von allen Metallen das negativste Redoxpotenzial. Das Standardpotenzial des Lithiums beträgt -3,04 Volt! In Kombination mit Edelmetallen oder anderen Materialien kann man also sehr hohe Spannungen mit Lithium als Minuspol erzeugen. Die üblichen Lithium-Ionen-Akkus liefern dann tatsächlich Spannungen zwischen 3,3 und 3,8 Volt, das ist wesentlich mehr als bei anderen Batterien oder Akkumulatoren (zum Vergleich: Zink-Kohle-Batterie 1,5 Volt, Blei-Akku 2,1 Volt, Nickel-Cadmium-Akku 1,2 Volt).
Zweitens ist Lithium ein Leichtmetall, während Blei-Akkus wegen der hohen Dichte des Bleis sehr schwer sind. Die Dichte von Lithium beträgt nur 0,534 g/cm3, die von Blei dagegen 11,34 g/cm3, also gut das 21 mal so viel.
Ungünstigerweise ist Lithium als Alkalimetall aber auch sehr reaktiv. Sie kennen sicherlich den Schulversuch, bei dem man einen kleinen Lithium-Würfel in eine Schüssel mit Wasser gibt. Das Lithium reagiert recht heftig mit Wasser unter Bildung von Lithiumhydroxid und Wasserstoff. Darum muss man bei der Konstruktion von Lithium-Akkumulatoren darauf achten, dass nicht einmal Spuren von Wasser mit dem Lithium in Kontakt kommen. Als Elektrolyte setzt man folglich nichtwässrige Materialien ein. Ein Beispiel hierfür ist eine Lösung von Lithiumperchlorat LiClO4 in einem polaren organischen Lösemittel.
Aufbau
Die folgende Graphik zeigt grob den Aufbau einer Zelle eines Lithiumionen-Akkus, wenn man sie "auseinanderwickeln" würde:
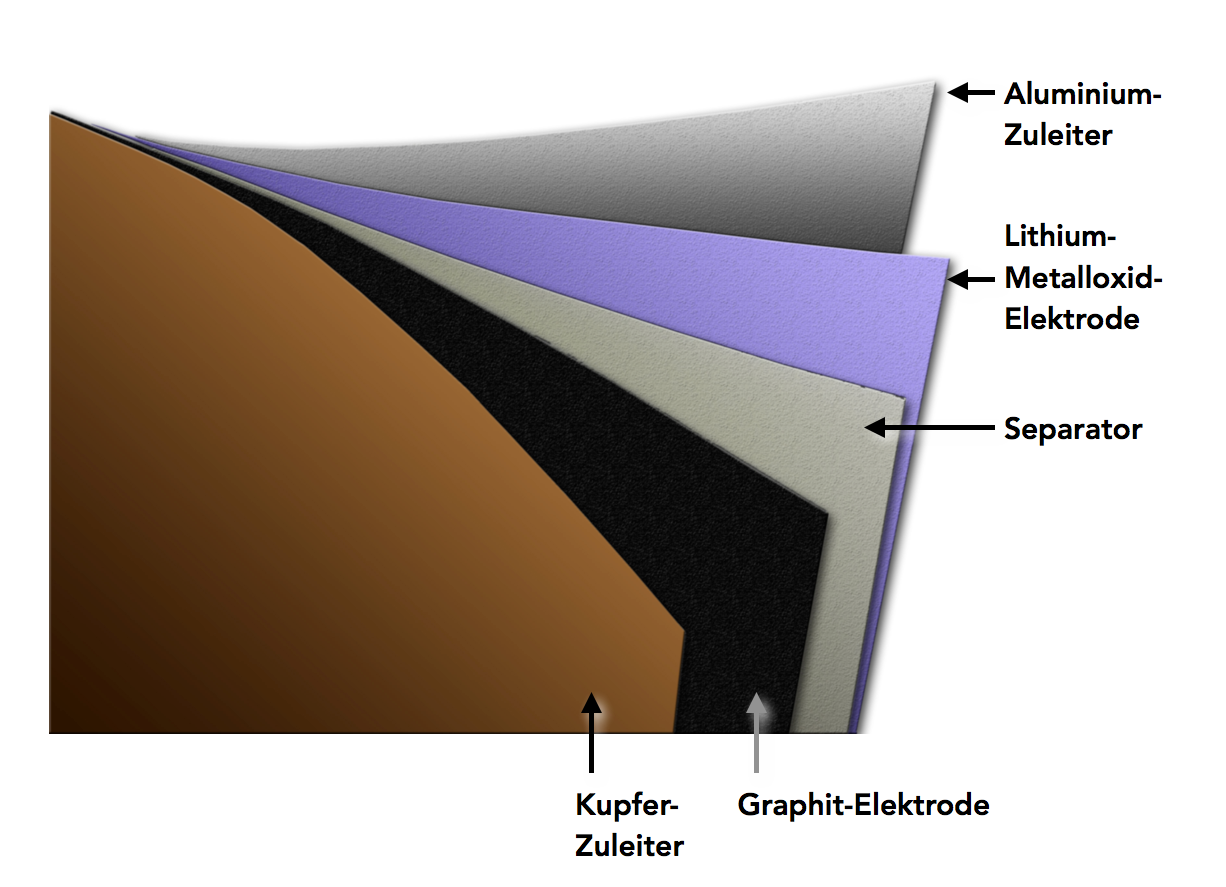
Grobe Darstellung der Schichten eines Lithiumionen-Akkus
"Wickelt" man einen runden Lithiumionen-Akku Schicht für Schicht auseinander, dann erhält man in etwa ein Bild wie in Abbildung 1 gezeigt. Ganz innen findet man eine Kupferschicht. Das Kupfer selbst nimmt an den Reaktionen allerdings nicht teil, die im Akku ablaufen, sondern dient nur als Leiter für Elektronen. Die eigentliche Elektrode ist dann eine Graphitschicht, im Bild schwarz gezeichnet. Näheres dazu siehe "Die Graphit-Elektrode" im folgenden Abschnitt.
Wie in jeder Batterie und in jedem Akkumulator müssen die beiden Elektroden einerseits voneinander getrennt sein, damit es zu keinem Kurzschluss kommt. Diese Aufgabe übernimmt der Separator. Andererseits müssen Ionen zwischen den beiden Elektroden transportiert werden können, damit der Stromkreis geschlossen wird. Diese Aufgabe übernimmt in jeder Batterie und jedem Akkumulator der Elektrolyt, der hier nicht eingezeichnet ist.
Die andere Elektrode ist ein komplexes Gebilde aus verschiedenen Materialien, oft sind Metalloxide wie Cobaltoxid oder Manganoxid in der Elektrode verbaut. Eine genauere Beschreibung der Lithium-Metalloxid-Elektrode findet sich weiter unten. Die Aluminiumschicht ganz außen hat eine ähnliche Funktion wie die Kupferschicht ganz innen, sie dient als Leiter für die Elektronen.
Die Graphit-Elektrode / Minuspol
Aufbau
Eine der beiden Elektroden besteht beim Lithium-Ionen-Akku aus Graphit. Elektroden aus Graphit haben wir ja bereits des öfteren kennengelernt, beispielsweise bei der "alten" Zink-Kohle-Batterie. Während bei klassischen Batterien der Kohlenstoff die Funktion eines Elektronen-Zuleiters hat, dient beim Lithium-Ionen-Akku der Graphit als Speicher für Lithium-Ionen. Die Rolle des Elektronen-Zuleiters übernimmt Kupfer, das mit dem Graphit verbunden ist.
Zur Erinnerung: Graphit
Graphit besteht bekanntlich aus vielen kleinen Sechsecken aus Kohlenstoff-Atomen, die zu einem dichten Gitter zusammengelagert sind. Hier eine Aufsicht auf eine einzelne Schicht des Graphitgitters:

Einfache Darstellung einer Ebene des Graphitgitters
Jedes Sechseck besteht aus sechs C-Atomen, die durch abwechselnde C-C-Einfachbindungen und C=C-Doppelbindungen zusammengehalten werden und damit vom Aufbau her einem Benzol-Molekül entsprechen. Die obige Zeichnung kann den Aufbau einer solchen Graphit-Ebene nur unzureichend darstellen, weil die eingezeichneten Doppelbindungen nicht lokalisiert sind. Wer mehr dazu wissen will, liest sich den Experten-Teil durch.
Für Experten:
Alle C-Atome des Graphits liegen in sp2-hybridisierter Form vor. Die pz-Orbitale der C-Atome einer Graphitschicht überlappen sich daher, und es bildet sich - ähnlich wie in einem Metall - ein Elektronengas, das sich in einem elektrischen Feld sehr leicht bewegen lässt. Daher hat Graphit eine recht hohe elektrische Leitfähigkeit, weil alle Elektronen der pz-Orbitale über die gesamte Graphitschicht delokalisiert sind.
Die p-Orbitale der einzelnen Graphitschichten dagegen überlappen sich so gut wie gar nicht, so dass sich die Graphitschichten leicht gegeneinander verschieben lassen. Beim Schreiben mit einer Graphitmine lösen sich dann einzelne Schichten von dem Stift und bleiben auf dem Papier haften.
Ladevorgang
Der Minuspol einer Gleichspannungsquelle wird über den Kupfer-Zuleiter mit der Graphitelektrode des Akkus verbunden. Diese lädt sich negativ auf und zieht Lithium-Kationen aus dem Elektrolyten an, wirkt beim Laden also als Minuspol. Die Lithium-Ionen lagern sich in den negativ geladenen Kohlenstoff ein, so dass eine Lithium-Graphit-Einlagerungsverbindung entsteht. Den Vorgang der Einlagerung bezeichnet man übrigens als Intercalation (intercalare (lat.) = einschieben).
Für Experten
Unter einer Intercalation versteht man die "Einlagerung einer beweglichen Gastspezies in ein Wirtsgitter ohne Zerstörung des Bauprinzips der Wirtssubstanz." [4]
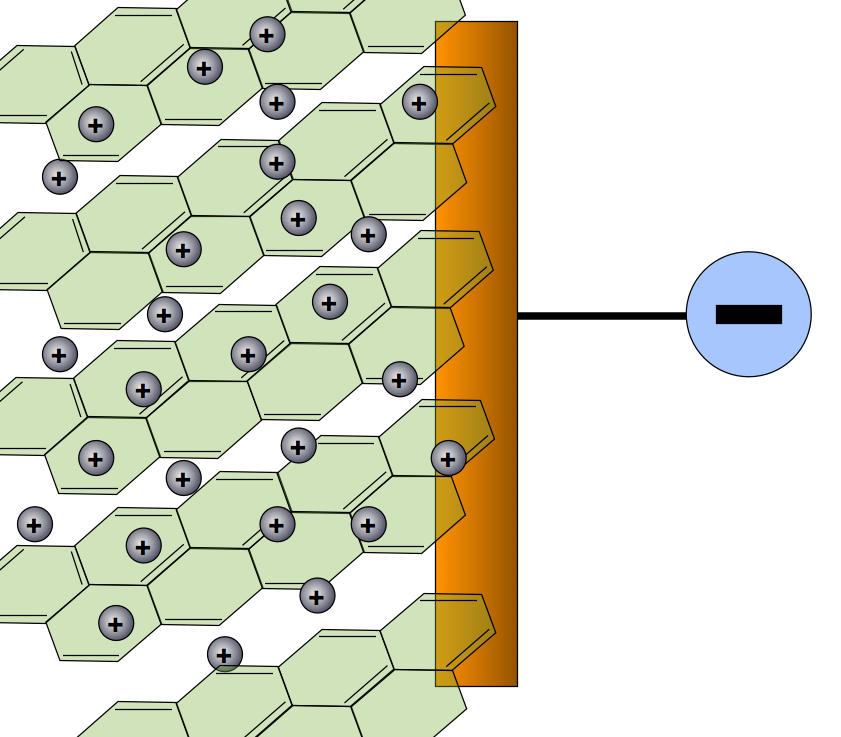
Der Graphit mit eingelagerten Lithium-Atomen während des Aufladens.
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz. Autor: Ulrich Helmich
Statistisch gesehen kommt auf jeweils sechs Kohlenstoff-Atome ein Lithium-Ion. Die chemische Formel für die Graphit-Elektrode nach dem Aufladen wäre also Li+[C6]-.
Wichtig: Die Lithium-Ionen selbst nehmen zwar an dem Ladevorgang teil, dienen aber nur als Ladungsträger. Es findet keine Reduktion der Li+-Ionen statt!
Den Ladevorgang könnte man nun so formulieren [3]:
$Li^{+}_{(solv)} + C_{6(s)} + e^{-} \rightarrow Li^{+}[C_{6}]^{-}_{(s)}$
Dabei sind $Li^{+}_{(solv)}$ die im nichtwässrigen Lösemittel gelösten Lithium-Ionen und $C_{6(s)}$ ist der Graphit. $C_{6}]^{-}_{(s)}$ ist der negativ aufgeladene Graphit. Die negative Ladung verteilt sich auf sechs C-Atome und ist delokalisiert.
Entladevorgang
Beim Entladen des Lithiumionen-Akkus passiert im Prinzip das Umgekehrte. Die positiven Lithium-Ionen werden von der Lithium-Metalloxid-Elektrode angezogen und wandern durch den Elektrolyten und den Separator dorthin. Man könnte nun meinen, dass die Lithium-Ionen dort wieder ein Elektron aufnehmen, wenn sie in der Lithium-Metalloxid-Elektrode ankommen. Aufgrund des sehr negativen Redoxpotenzials des Lithiums ist das aber nicht möglich. Vielmehr nehmen die "edleren" Cobalt-Kationen dort ein Elektron auf und werden reduziert. Einzelheiten siehe folgenden Abschnitt.
Die Lithium-Metalloxid-Elektrode
Elementares Lithium ist eines der reaktivsten Metalle überhaupt, es wird in seiner Reaktivität nur noch von den anderen Alkalimetallen übertroffen. Gibt man etwas Lithium beispielsweise in eine Schüssel mit Wasser, so fängt sofort eine heftige Reaktion an, bei der das Lithium kreuz und quer über die Wasseroberfläche huscht und dabei zischt. Das Zischen rührt daher, dass Lithium mit Wasser zu Lithiumhydroxid und Wasserstoff reagiert. Auch mit dem Luftsauerstoff reagiert das Lithium sehr schnell zu Lithiumoxid.
Eine solche Reaktion muss im Lithiumionen-Akku natürlich verhindert werden. Wasser oder Luft haben daher im Akku nichts zu suchen.
Interessant ist nun Folgendes: Obwohl Lithium ein sehr reaktives Metall ist, verhält sich Lithium doch recht "friedlich", wenn man es mit Oxiden anderer Metalle in Kontakt bringt. Daher besteht die Lithium-Metalloxid-Elektrode eines Lithiumionen-Akkus aus einem Metalloxid, in das Lithium-Ionen eingelagert sind.
Die Lithium-Cobaltoxid-Elektrode
Ein beliebtes Metalloxid für Lithiumionen-Akkus ist Cobaltoxid CoO2. An sich ist das Cobalt-Ion hier vierwertig, wie man leicht nachrechnen kann. Schauen wir uns das einmal im Bild an:
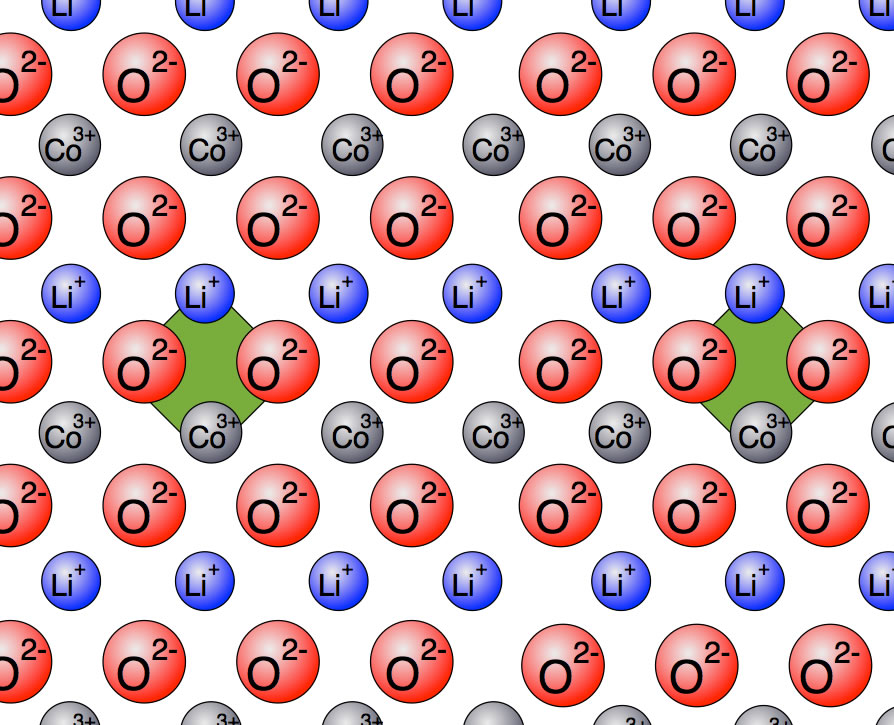
Die Cobaltoxid-Schicht mit zwei markierten "Elementarzellen"
Eine Elementarzelle (kleinste Einheit eines Kristallgitters) der Cobaltoxid-Elektrode besteht aus einem dreiwertig positiven Cobalt-Ion Co3+, zwei Sauerstoff-Ionen O2- und einem Lithium-Ion Li+. Wir haben hier also insgesamt vier negative Ladungen und vier positive, die Elementarzelle ist also elektrisch neutral.
Der Ladevorgang
Beim Aufladen des Lithiumionen-Akkus wird die Lithium-Metalloxid-Elektrode mit dem Pluspol einer Gleichspannungsquelle verbunden. Es werden also Elektronen "abgesaugt". Eine Elementarzelle der Lithium-Cobaltoxid-Elektrode besteht aus drei verschiedenen Ionen: Co3+, O2- und Li+. Die Lithium-Ionen können kein weiteres Elektron mehr abgeben, die Sauerstoff-Ionen könnten es, tun es aber nicht. Das wäre auch sehr ungünstig, weil dann ständig gasförmiger Sauerstoff freigesetzt würde. Also bleiben nur noch die Cobalt-Ionen übrig, die als Elektronenspender in Frage kommen. Es läuft folgende Reaktion ab:
$Co^{3+} \to Co^{4+}+e^{-}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Die Graphit-Elektrode wird während des Ladevorgangs mit dem Minuspol der Gleichspannungsquelle verbunden, dadurch lädt sich das Graphit negativ auf. Die kleinen Lithium-Ionen aus der Lithium-Cobaltoxid-Elektrode werden nun von der negativ aufgeladenen Graphit-Elektrode angezogen und wandern durch den Elektrolyten dorthin. Der Separator wirkt wie eine semipermeable Membran, die nur ganz bestimmte Teilchen passieren lässt. Nur die Lithium-Ionen können den Separator passieren, keine anderen Ionen. Dann lagern sich die Lithium-Ionen in das Graphitgitter ein, wie bereits weiter oben beschrieben.
Der Entladevorgang
Die Graphit-Elektrode gibt ihre negative Ladung wieder ab. Über den Kupfer-Zuleiter, der jetzt eigentlich Ableiter heißen müsste, wandern die Elektronen durch das angeschlossene Gerät (zum Beispiel das Handy) und dann weiter über den Aluminum-Zuleiter in die Lithium-Metalloxid-Elektrode.
Hier sind es aber nicht die Lithium-Ionen, welche die Elektronen aufnehmen, sondern das vierwertige Cobalt wird zu dreiwertigem Cobalt reduziert:
$Co^{4+}+e^{-} \to Co^{3+}$
Das liegt schlicht und einfach daran, dass vierwertige Cobalt-Ionen ein stark positives Redoxpotenzial haben, nämlich je nach pH-Wert zwischen +1,2 Volt (neutrales Medium) und +0,83 Volt (alkalisches Medium). Das Redoxpotenzial für Lithium liegt dagegen bei -3,045 Volt [1].
Elektrolyt und Separator
Der Elektrolyt muss vollkommen wasserfrei sein, weil Lithium bei Zimmertemperatur heftig mit Wasser zu Lithiumhydroxid und Wasserstoff reagiert. Außerdem muss es sich bei dem Elektrolyten um ein aprotisches Lösemittel handeln, es dürfen also keine Protonen abgegeben werden. Ethanol beispielsweise würde sich nicht als Elektrolyt eignen. Die abgegebenen Protonen würden zur negativ geladenen Graphitschicht wandern und dort Elektronen aufnehmen, was zur Bildung von gasförmigem Wasserstoff führen würde.
Die bekanntesten wasserfreien Elektrolyte sind - und hier zitiere ich einfach mal aus der deutschen Wikipedia:
- Salze wie Lithiumhexafluorophosphat (LiPF6), Lithiumtetrafluorborat (LiBF4) oder Lithiumbis(oxalato)borat (LiBOB) gelöst in wasserfreien aprotischen Lösungsmitteln wie z. B. Ethylencarbonat, Propylencarbonat, Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan.
- Polymere aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP) im Lithium-Polymer-Akkumulator
Als Separator fungieren Kunststoffe, die aus Alkenen wie Ethen, Propen oder Buten durch Polymerisation hergestellt werden, sogenannte Polyolefine.
Quellen:
- www.periodensystem-online.de
- deutsche Wikipedia, Artikel "Lithium-Ionen-Akkumulator"
- Chemie heute SII, Qualifikationsphase NRW, Braunschweig 2014, S. 40.
- "Primäre und wiederaufladbare Lithium-Batterien", ein Skript der TU Graz.
Seitenanfang -
Blei -
Lithium -
Zinkoxid