Isomere Substitutionsprodukte
Was passiert, wenn wir Propan bromieren? Es können zwei verschiedene Mono-Bromierungsprodukte entstehen, einmal das 1-Brompropan, und einmal das 2-Brompropan.
In welchem Verhältnis werden diese beiden Produkte wohl entstehen?
Das kann man leicht ausrechnen! Das Propan-Molekül besitzt 8 H-Atome. Sechs davon befinden sich an den beiden äußeren C-Atomen, zwei an dem mittleren C-Atom. Daher sollte man bei den Produkten von sechs Anteilen 1-Brompropan und zwei Anteilen 2-Brompropan ausgehen. Oder in Prozenten ausgedrückt: 75% und 25
Wenn man den Versuch bei Zimmertemperatur durchführt, entstehen bei der Bromierung von Propan aber nur 4% 1-Brompropan und sage und schreibe 96% 2-Brompropan. Es bildet sich also weit mehr 2-Brompropan als erwartet.
Die Ursache für diese hohe Selektivität ist in der Stabilität der Alkyl-Radikale zu finden.
Selektivität
Unter Selektivität versteht man bei chemischen Reaktionen das Phänomen, dass von mehreren möglichen Reaktionsprodukten bevorzugt eines gebildet wird - entgegen der rein statistischen Erwartung.
Stabilität von Alkylradikalen
Die Erfahrung zeigt immer wieder, dass tertiäre Alkylradikale stabiler sind (und damit leichter/schneller gebildet werden) als sekundäre Alkylradikale. Diese sind wiederum stabiler als primäre Alkylradikale.
Radikal-Stabilität: tertiär > sekundär > primär > *CH3
Die naheliegende Ursache für diese Reihenfolge sind die +I-Effekte der Alkyl-Gruppen, die an dem radikalischen C-Atom sitzen. Alkyl-Gruppen üben einen elektronenschiebenden Effekt auf dieses C-Atom aus. Dadurch wird die Elektronendichte in der einfach besetzten Kugelwolke des radikalischen C-Atoms erhöht, und die Stabilität des Radikals nimmt zu.
Bei tertiären Radikalen üben drei Alkyl-Gruppen einen +I-Effekt auf das zentrale C-Atom aus, bei sekundären Radikalen zwei Alkyl-Gruppen und bei primären Radikalen nur eine Alkyl-Gruppe.
Tertiäre H-Atome lassen sich wegen der hohen Stabilität von tertiären Alkylradikalen leichter abstrahieren als sekundäre oder gar primäre H-Atome. Daher bildet sich bei der Bromierung von Propan übermäßig viel 2-Brompropan und verhältnismäßig wenig 1-Brompropan.
Bei der Bromierung von 2-Methylpropan entsteht extrem viel 2-Brom-2-methylpropan, während die sekundären und primären Bromierungsprodukte kaum noch gebildet werden.
Aufgabe 1
Recherchieren Sie die Bindungsdissoziationsenergien für primäre, sekundäre und tertiäre C-H-Bindungen und überprüfen Sie dann, ob die Ergebnisse in Einklang mit der oben aufgeführten Reihenfolge tertiär > sekundär > primär > *CH3 stehen.
Eine Lösung dieser Aufgabe finden Sie hier...
Der Einfluss des Halogens
Betrachten Sie nun folgende Graphik:
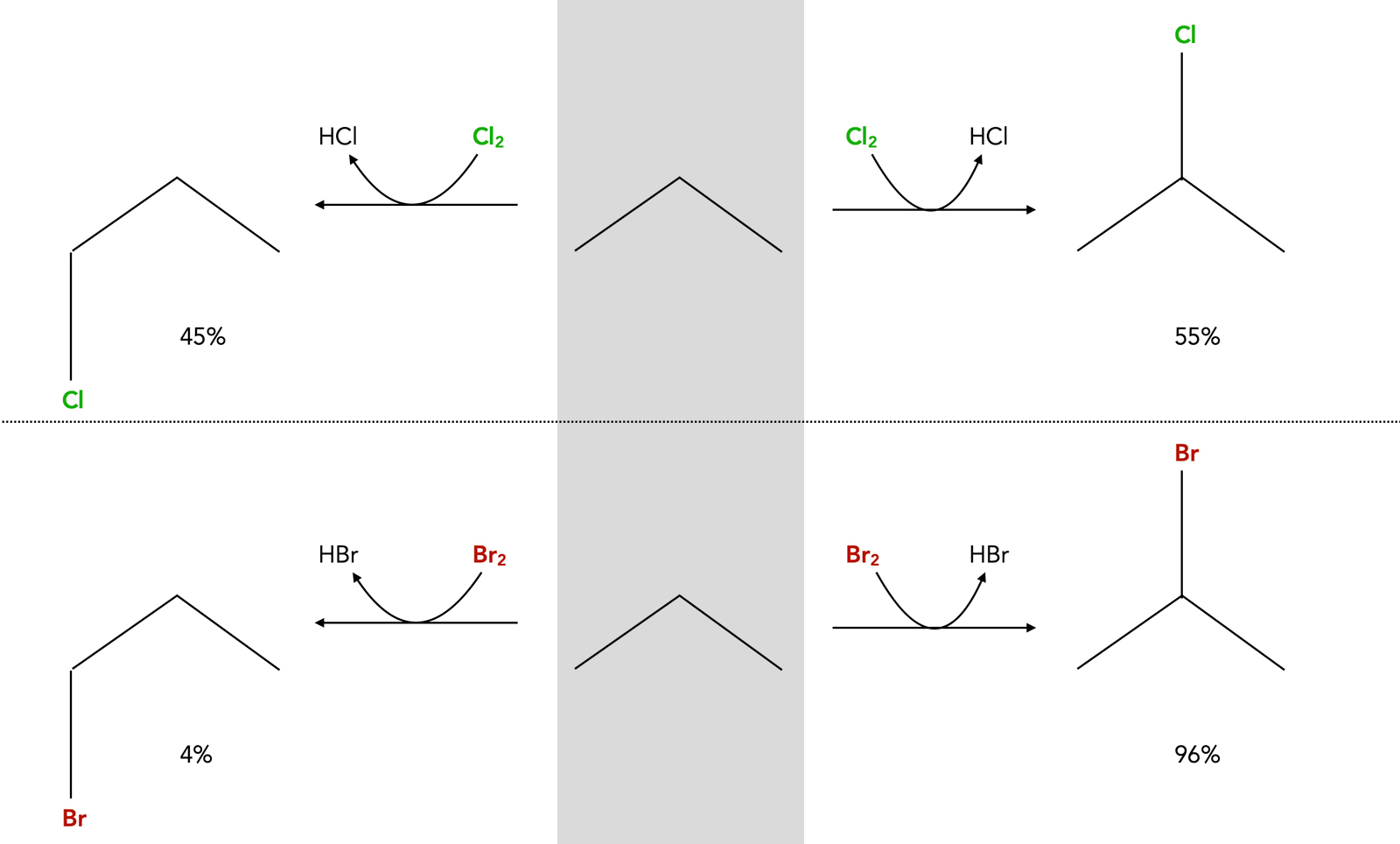
Chlorierung (oben) und Bromierung (unten) von Propan
Autor:
Ulrich Helmich 2015, Lizenz: Public domain.
Aufgabe 2
Erläutern Sie, welches neue Phänomen in der obigen Abbildung dargestellt wird.
Diese Aufgabe wollen wir einmal gemeinsam lösen:
Aufgabe 2, Lösung
Man sieht sofort, dass die Selektivität bei der Chlorierung viel geringer ist als bei der Bromierung.
Die Chlorierung ist zwar ebenfalls selektiv, denn statt der erwarteten 25% 2-Chlorpropan werden 55% gebildet, das sekundäre Reaktionsprodukt wird also bevorzugt gebildet. Aber das ist kein Vergleich zu den 96% 2-Brompropan bei der Bromierung.
Wie kann man die geringere Selektivität der Chlorierung nun erklären?
Wenn man in Chemie-Hochschulbücher schaut, findet man eine sehr komplizierte Erklärung, die als Hammond-Postulat ↑Lex bezeichnet wird. Wir wollen aber eine einfache Erklärung finden, die für das Chemie-Abitur locker ausreicht, falls so etwas überhaupt gefragt wird.
Ein Beispiel aus dem Alltag: Wenn Sie nur wenig Geld zur Verfügung haben und sich ein neues Handy kaufen wollen, vergleichen Sie gründlich die Preise und wählen wahrscheinlich ein sehr günstiges Modell. Haben Sie aber jede Menge Geld zur Verfügung, sind ihnen die Preise egal und Sie achten auf andere Dinge bei der Auswahl.
Übertragen wir das nun auf die Chlorierung und Bromierung:
Das Brom-Radikal ist nicht so reaktionsfreudig (ärmer an Reaktivität) wie das Chlor-Radikal. Daher spielt die Leichtigkeit, mit der es H-Atome abstrahieren kann, eine wichtige Rolle. Aus diesem Grund werden bei der Bromierung bevorzugt tertiäre H-Atome abgespalten, gefolgt von sekundären.
Das Chlor-Radikal ist wesentlich reaktiver (reicher an Reaktivität) als das Brom-Radikal. Daher kann es ihm quasi egal sein, ob es primäres, ein sekundäres oder ein tertiäres H-Atom abstrahiert werden muss. Das Chlor-Radikal ist lange nicht so selektiv wie das Brom-Radikal.
Aufgabe 3
Bei Raumtemperatur liefert die Chlorierung von Propan 25% 1-Chlorpropan und 75% 2-Chlorpropan. Bei 600 ºC aber entstehen 75% 1-Chlorpropan und nur 25% 2-Chlorpropan.
Finden Sie eine Erklärung für dieses Phänomen!
Hier geht es zur Lösung dieser Aufgabe...
Aufgabe 4 (für Spezialisten)
Bei Zimmertemperatur betragen die Produktanteile der Bromierung eines Alkans 1 : 250 : 6300. Die Bildung eines sekundären Bromalkans ist also 250 mal wahrscheinlicher als die Bildung eines primären. Ein tertiäres Bromalkan wird 6300 mal so leicht/schnell gebildet wie ein primäres.
Berechnen Sie das Produktverhältnis bei der Bromierung von 2-Methylbutan.
Auch für diese Aufgabe gibt es eine Lösung...
Aufgabe 5 (für Spezialisten)
a) Nennen Sie sämtliche Chlorierungsprodukte von Ethan.
b) Beurteilen Sie, ob die Chlorierung von Chlorethan leichter/schneller abläuft als die Chlorierung von Ethan.
Auch für diese Aufgabe gibt es eine Lösung...
Wenn Sie noch nicht genug haben von der Radikalischen Substitution, dann sollten Sie sich die Seiten anschauen, die ich speziell für Studienanfänger oder für Schüler geschrieben haben, die sich für ein Chemie-Studium interessieren.
Seitenanfang -
weiter mit "Weiterführende Themen"