Bindungsdissoziationsenergie DHº
Das homolytische Aufbrechen einer kovalenten Bindung kostet viel Energie, die als Bindungsdissoziationsenergie DHº bezeichnet wird. Die Stärke einer kovalenten Bindung und somit die Größe von DHº hängt von mehreren Faktoren ab, die wir auf dieser Seite erarbeiten wollen.
C-H-Bindungen in Alkanen
In jedem guten Chemiebuch findet sich eine Tabelle mit den verschiedenen Bindungsdissziationsenergien der Alkane. Die folgenden Zahlen habe ich dem Buch von Vollhardt entnommen [1].
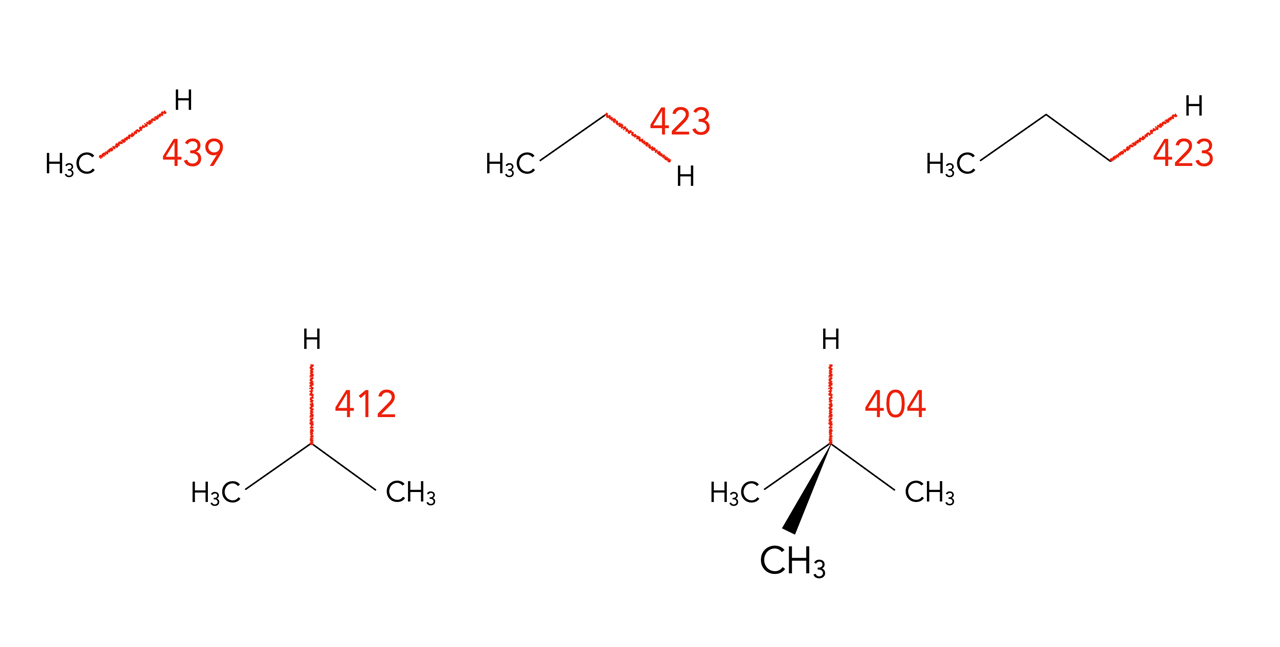
Bindungsdissziationsenergien von C-H-Bindungen, Werte in kJ/mol.
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Welche allgemeinen Zusammenhänge bezüglich der Bindungsdissziationsenergien lassen sich aus dieser Abbildung ableiten?
Bei tertiären H-Atomen ist DHº am geringsten, bei sekundären H-Atomen ist sie etwas höher, bei primären H-Atomen noch höher und im Methan-Molekül ist DHº am größten. Vergleichen wir die beiden primären C-H-Bindungen im Ethan und im Propan, so stellen wir fest, dass DHº nicht von der Position der primären C-H-Bindung im Molekül oder von der Länge des Moleküls abhängt.
Wie kann man diese Reihenfolge von DHº (Methan > primär > sekundär > tertiär) erklären?
Die Erklärung für die unterschiedlichen Bindungsdissziationsenergien liegt in der Stabilität der Radikale, die sich bilden, wenn das H-Atom homolytisch abgetrennt wird.
Tertiäre Radikale sind aufgrund verschiedener Faktoren (+I-Effekt von Alkylgruppen, Hyperkonjugation) stabiler als sekundäre, daher kann die entsprechende C-H-Bindung mit weniger Energieaufwand gespalten werden. Und sekundäre Radikale sind wiederum stabiler als primäre. Am wenigsten stabil sind die Methylradikale, daher ist die Bindungsdissziationsenergie für die Spaltung einer C-H-Bindung beim Methan-Molekül am größten.
C-C-Bindungen in Alkanen
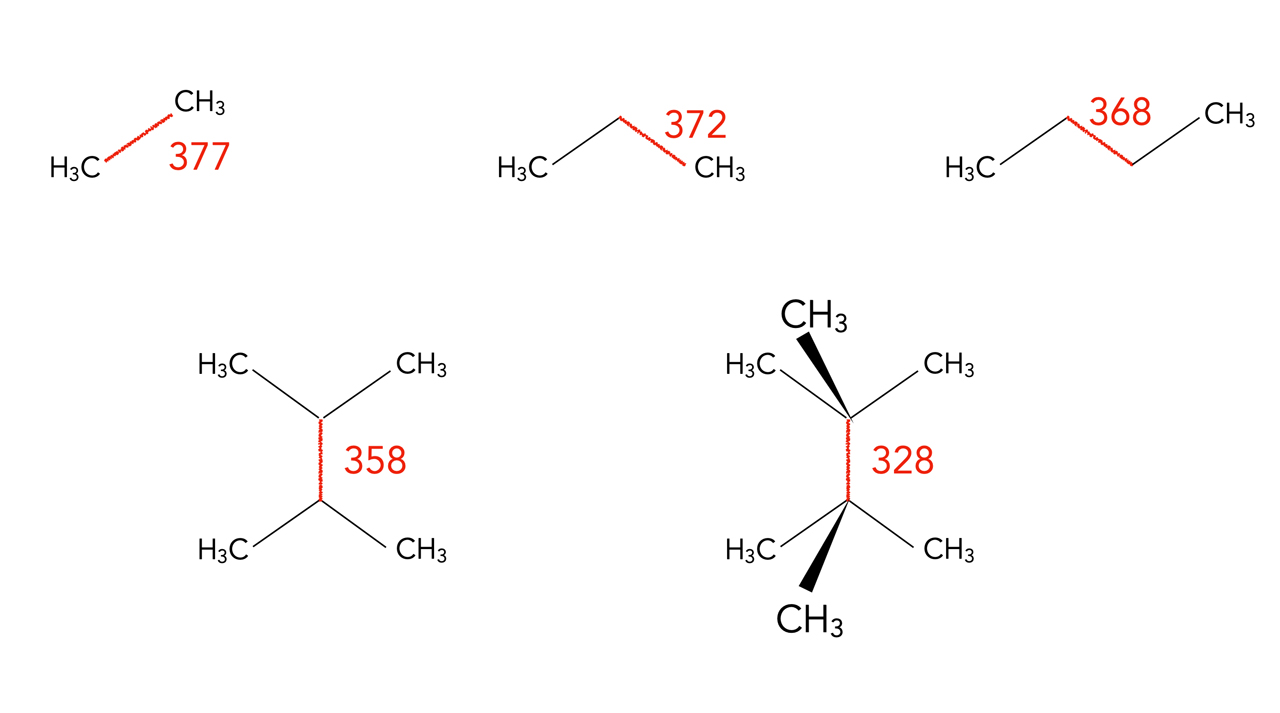
Bindungsdissziationsenergien von C-C-Bindungen, Werte in kJ/mol.
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Auch diese Werte wurden dem aktuellen Vollhardt [1] entnommen.
Bei der Spaltung der C-C-Einfachbindung im Ethan entstehen zwei Methylradikale, also zwei sehr instabile Teilchen. Daher ist die Bindungsdissziationsenergie der C-C-Einfachbindung im Ethan am größten. Das andere Extrem ist das Molekül rechts unten, das 2,2,3,3-Tetramethyl-butan. Bei der Spaltung der rot eingezeichneten C-C-Einfachbindung entstehen zwei tertiäre Radikale, die wie oben erwähnt am stabilsten sind. Entsprechend gering ist hier die Bindungsdissziationsenergie.
Folgen für die Radikalische Substitution
Welche Folgen hat nun die unterschiedliche Höhe der Bindungsdissziationsenergien für die radikalischen Substitutionsreaktionen der Alkane?
Diese Frage wird bereits im Unterricht der Qualifikationsphase thematisiert, wenn man folgendes Problem behandelt:
Bei der Bromierung von Propan entsteht ein Produktgemisch, das rein statistisch aus 6/8 1-Brom-propan und 2/8 2-Brom-propan bestehen müsste. Man findet jedoch fast ausschließlich das sekundäre 2-Brom-propan als Reaktionsprodukt. Das liegt natürlich daran, dass bei der Bildung des sekundären Produkts ein stabiles sekundäres Radikal entsteht, bei der Bildung des primären Produkts ein instabileres primäres Radikal.
Auf dieser Seite wird näher auf dieses Thema eingegangen.