Das Bromonium-Ion tritt bei der Bromierung von Alkenen als Zwischenprodukt auf.
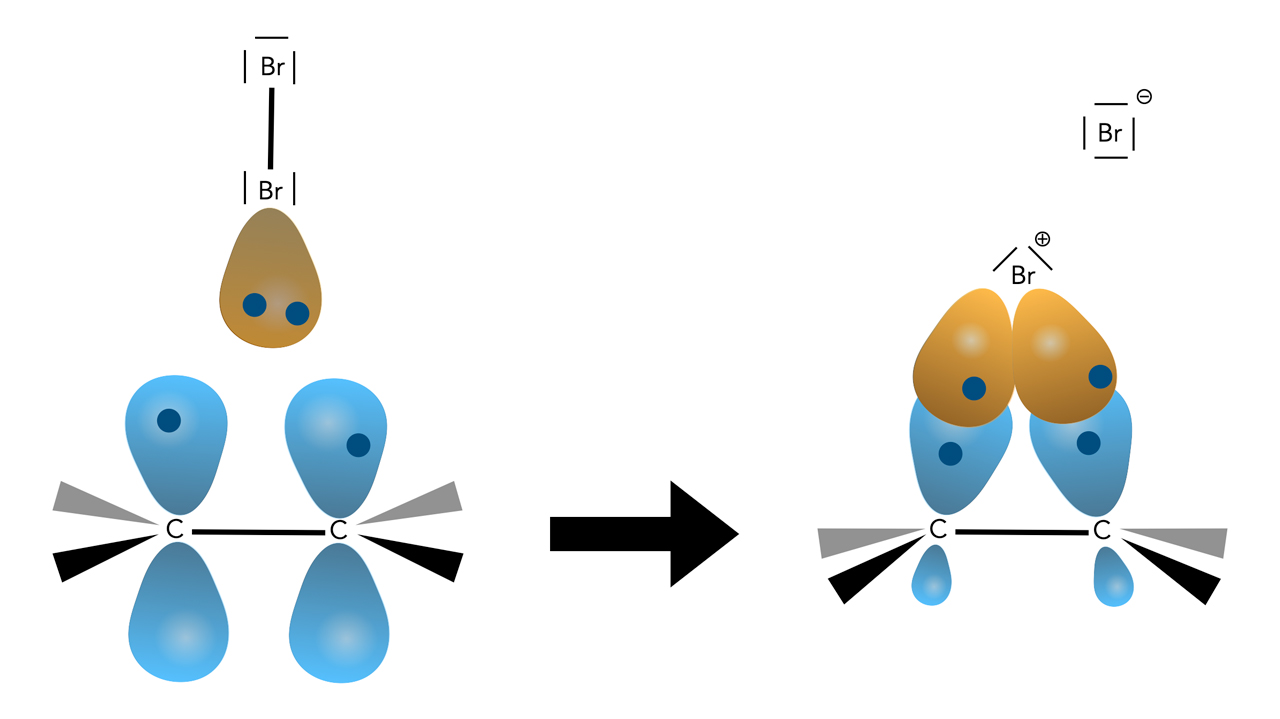
Bildung des Bromonium-Ions
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
| Links sehen wir die C=C-Doppelbindung mit ihren beiden p-Orbitalen, darüber ein Brom-Molekül mit den freien Elektronenpaaren. Das eine freie Elektronenpaar des "unteren" Br-Atoms wurde als Orbital dargestellt. Zu sehen sind außerdem die Elektronen (kleine blaue Kreise) in den Orbitalen. | Rechts sehen wir das Bromonium-Ion, das sich gebildet hat. Von den vier Orbitalen des Brom-Kations überlappen zwei einfach besetzte mit den beiden einfach besetzten p-Orbitalen der C-Atome. Die positive Ladung ist zunächst beim Brom-Kation, verteilt sich dann aber über den gesamten Dreierring C-Br-C, die Ladung ist also delokalisiert. Allerdings liegt der Schwerpunkt der positiven Ladung beim Brom (Chemgapedia), in vielen Büchern wird die positive Ladung direkt am Brom-Atom eingezeichnet, so wie in der Abbildung hier auch. |
Die delokalisierte positive Ladung des Bromonium-Ions zieht nun nucleophile Teilchen wie Bromid-Ionen oder Hydroxid-Ionen an. Dabei ist das Bromonium-Ion nur von der Rückseite her frei zugänglich, also von der dem Brom-Atom entfernten Seite. Es findet daher eine sogenannte anti-Addition des Nucleophils statt, ein sogenannter Rückseiten-Angriff, was man bei Cyclohexen sehr leicht experimentell nachweisen konnte:
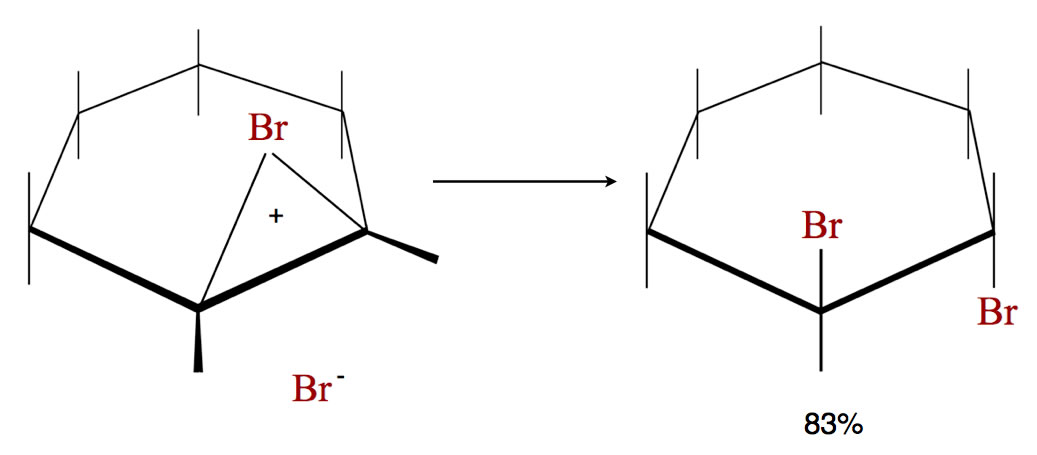
Das Bromonium-Ion des Cyclohexens reagiert vorwiegend zum trans-Produkt
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
Das trans-Produkt bildet sich zu 83 bis 85%, das cis-Produkt nur zu 15 bis 17%.
Zur Stabilität des Bromonium-Ions
Statt eines Bromonium-Ions könnte sich ja theoretisch auch ein Carbenium-Ion bilden:
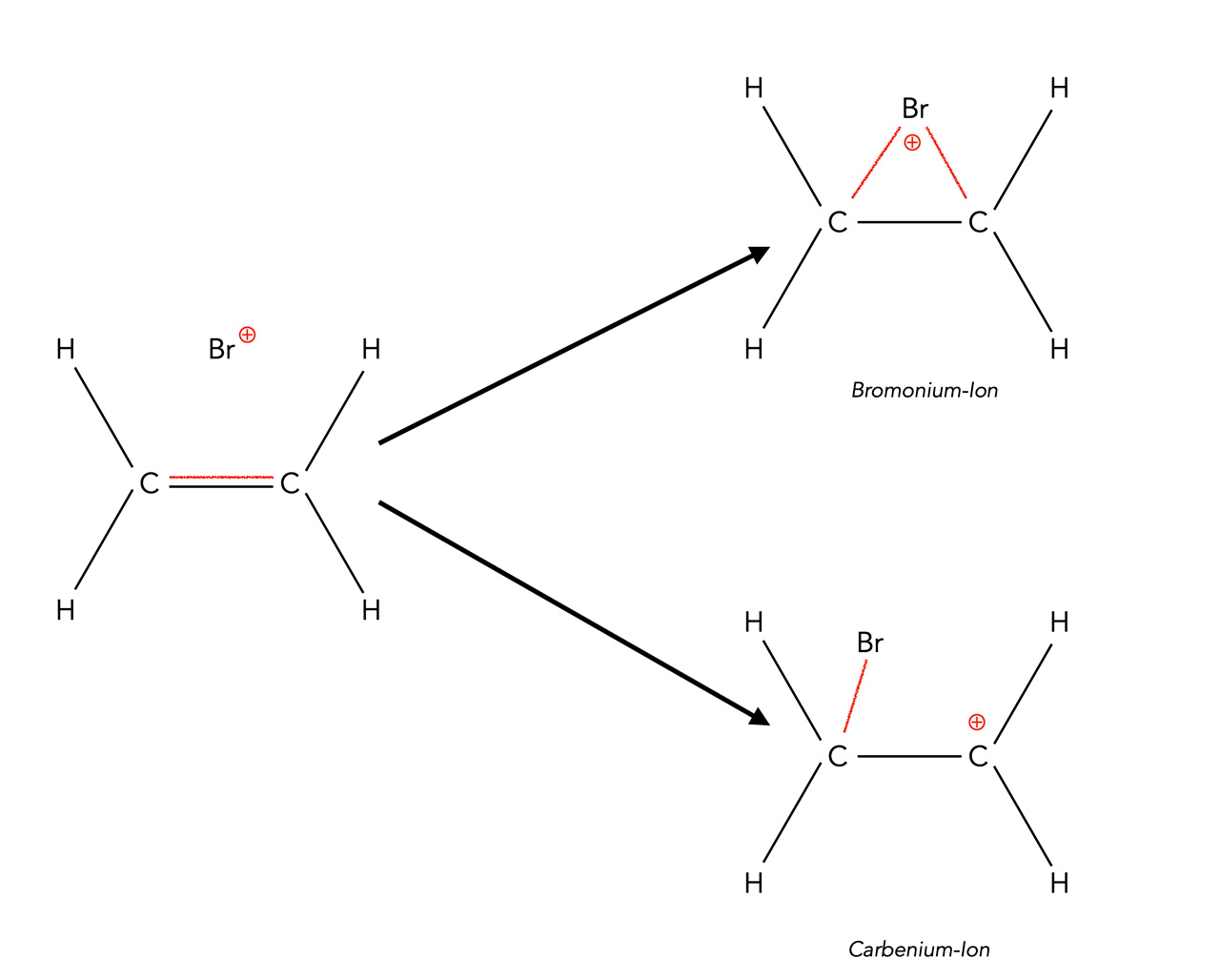
Alternativ zu einem Bromonium-Ion könnte sich auch ein Carbenium-Ion bilden
Autor: Ulrich Helmich 2023, Lizenz: siehe Seitenende.
Experimentelle Untersuchungen wie zum Beispiel die eben dargestellte Bromierung von Cyclohexen zeigen jedoch, dass die Bildung des Bromonium-Ions deutlich überwiegt. Warum ist das Bromonium-Ion so vorteilhaft gegenüber einem Carbenium-Ion?
- Beim Carbenium-Ion ist die positive Ladung an einem C-Atom fixiert, während sie beim Bromonium-Ion über drei Atome delokalisiert ist, was energetisch günstiger ist.
- Bei der Entstehung des Bromonium-Ions bilden sich zwei neue stabile sigma-Bindungen, was mit einem erheblichen Energiegewinn verbunden ist.
- Zwar herrscht eine große Ringspannung in dem C-Br-C-Heterozyklus, jedoch ist diese wegen der Größe und "Weichheit" des Brom-Atoms geringer als beispielsweise im Cyclopropan.
Hier der Versuch einer maßstabsgetreuen Zeichnung eines Bromonium-Ions im Vergleich zum Cyclopropan-Ring, die Winkeldaten für das Bromonium-Ion kommen aus [5], die Winkeldaten für das Cyclopropan aus [6], und die Bindungslängen aus allgemeinen Tabellenwerken. Ob die C-Br-Bindungslänge im Bromonium-Ion tatsächlich 194 pm beträgt (so wie eine "normale" C-Br-Bindung) entzieht sich meiner Kenntniss, ich habe darüber nichts im Internet oder der Literatur gefunden.
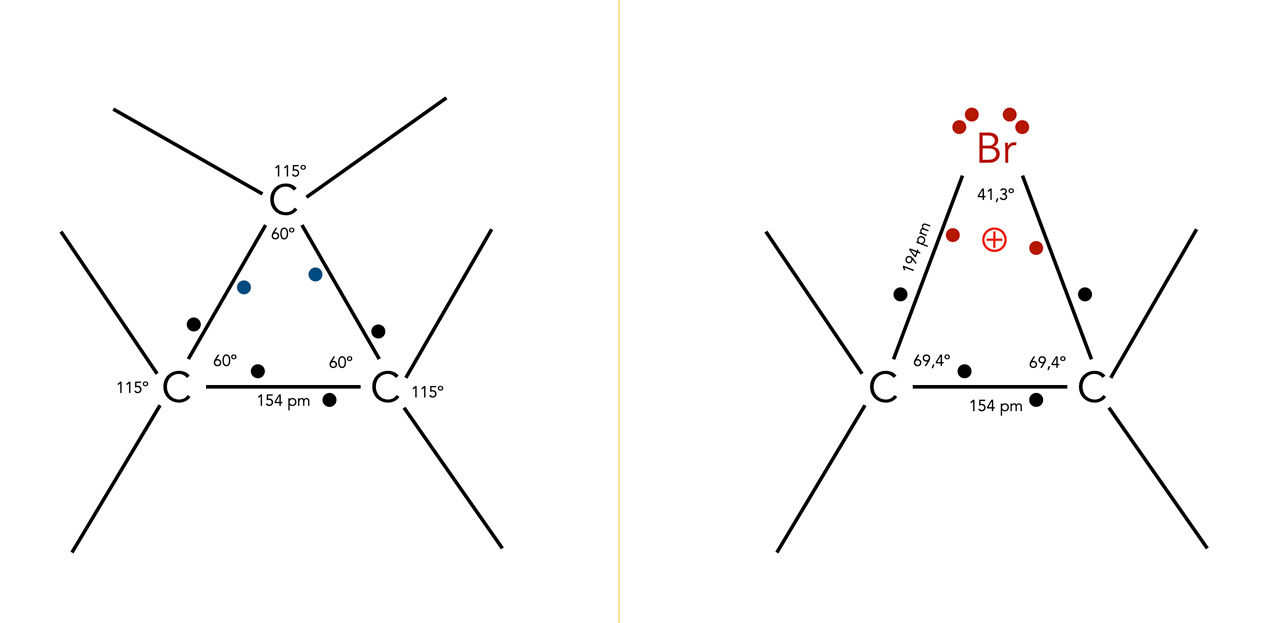
Versuch einer maßstabsgetreuen Darstellung des Cyclopropan-Moleküls und des Bromonium-Ions
Autor: Ulrich Helmich 02/2023, Lizenz: siehe Seitenende
Hier kann man gut sehen, dass die beiden Bindungswinkel an den C-Atomen des Bromonium-Ions "entspannter" sind als im Cyclopropan-Molekül.
Quellen:
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Wikipedia, Artikel "Cyclopropan".