van-der-Waals-Wechselwirkungen
Die Debye-Wechselwirkung gehört zu den van-der-Waals-Wechselwirkungen.
Grundsätzlich kann man drei Typen der van-der-Waals-Wechselwirkungen beobachten.
- Anziehung permanenter Dipol - permanenter Dipol (Keesom-Wechselwirkung, 2-25 kJ/mol)
- Anziehung permanenter Dipol - polarisierbares Teilchen (Debye-Wechselwirkung, 2-10 kJ/mol)
- Anziehung polarisierbares Teilchen - polarisierbares Teilchen (London-Wechselwirkung, 0,1-40 kJ/mol)
Die Debye-Wechselwirkung
Ein permanenter Dipol wie Aceton kann auch völlig unpolare Moleküle oder Atome anziehen, indem er in diesen Teilchen einen Dipol induziert. Zwischen Aceton und Pentan bestehen zum Beispiel solche Debye-Wechselwirkungen.
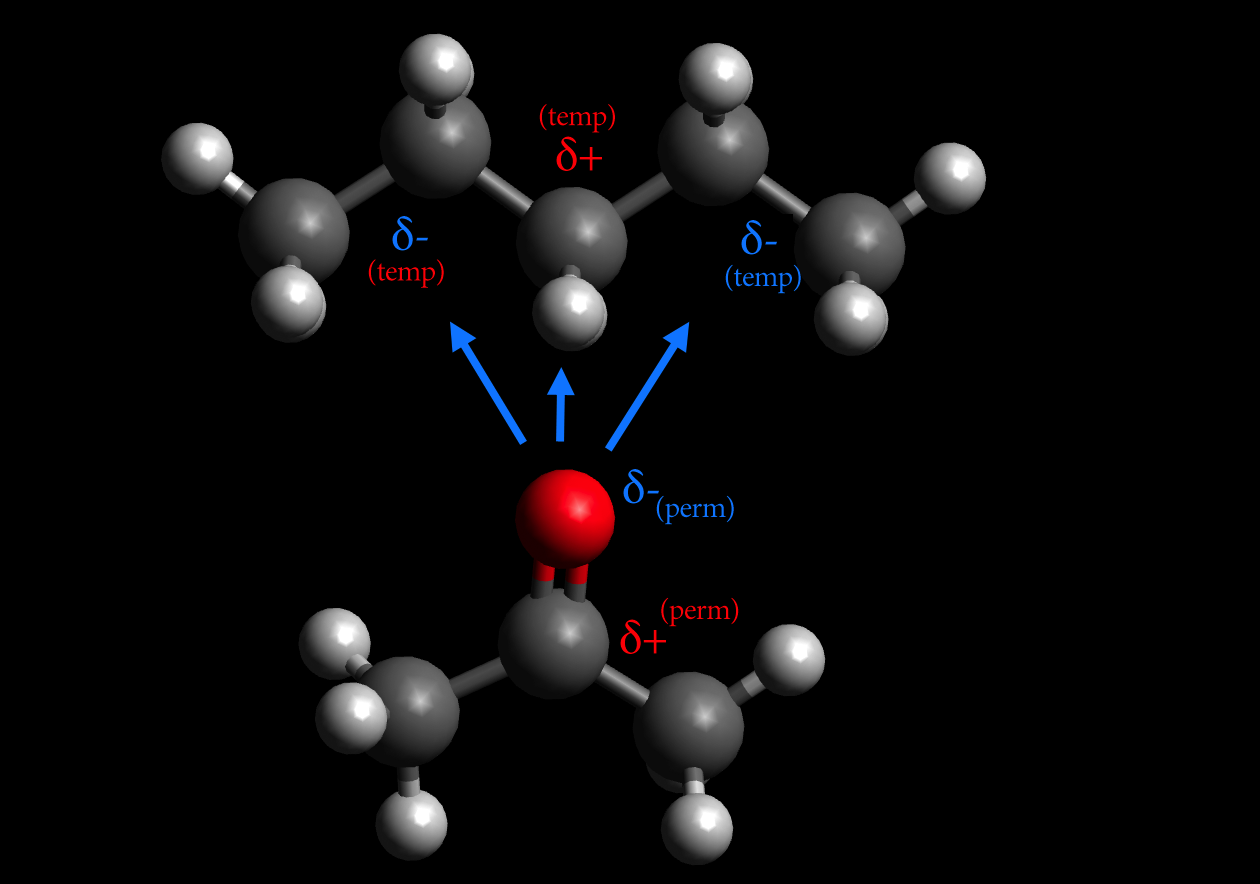
Debye-Wechselwirkung zwischen Aceton und Pentan
Autor: Ulrich Helmich, Lizenz: Public domain
Der permanente Aceton-Dipol verdrängt die Elektronen des Pentan-Moleküls, so dass dort ein temporärer Dipol entsteht (blaue Pfeile).
Ein anderes Beispiel ist das Brom-Molekül Br2, das leicht zu einem temporären Dipol umgewandelt werden kann, wenn es in die Nähe einer elektronenreichen C=C-Doppelbindung kommt, wie es beispielsweise bei der Bromierung eines Alkens der Fall ist. Die Doppelbindung zieht den Br2-Dipol dann an.
Die Energie der Debye-Wechselwirkung berechnet sich nach folgender Formel:
$E = -\frac{\mu^2 \cdot \alpha}{4 \cdot \pi \cdot \varepsilon_0 \cdot r^6}$
Dabei ist $\mu$ das Dipolmoment des permanenten Dipols in Debye, $\alpha$ ist die Polarisierbarkeit des anderen Moleküls, $r$ der Abstand zwischen den Molekülen und $T$ die absolute Temperatur in Kelvin. $\varepsilon_0$ ist elektrische Feldkonstante (8,854 * 10-12 F/m).
Diese Formel zeigt uns, dass die Debye-Wechselwirkung vor allem von drei Faktoren abhängt:
- Dipolmoment des permanenten Dipols: Je stärker dieser Dipol, desto größer die Debye-Kraft.
- Polarisierbarkeit des Nicht-Dipols: Je leichter dessen Teilchen polarisierbar sind, desto stärker die Debye-Kraft. Iod-Atome sind beispielsweise leichter zu polarisieren als Chlor-Atome, weil sie eine größere Elektronenhülle besitzen.
- Abstand zwischen den Molekülen: Je größer der Abstand zwischen den Molekülen, desto kleiner die Debye-Kraft. Der Abstand fließt hier mit der sechsten Potenz ein. Ein doppelter Abstand führt also zu einer 26 = 64 mal so schwachen Anziehungskraft.
Interessanterweise fließt die Temperatur nicht in die Formel ein.
Das liegt daran, dass die Debye-Kraft eine induzierte Wechselwirkung ist. Der permanente Dipol des einen Moleküls erzeugt ein elektrisches Feld, das den Dipol im anderen Molekül induziert. Diese induzierten Dipole sind nicht von der thermischen Bewegung der Moleküle abhängig, da die Induktion eine direkte Folge des elektrischen Feldes ist. Daher tritt der Temperatur-Faktor nicht in der Formel auf.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "elektrisches Dipolmoment"