Verbindungen mit gleicher Summenformel, aber unterschiedlicher Struktur werden allgemein Isomere genannt. Das Phänomen an sich, also die Tatsache, dass es solche Isomere gibt, wird als Isomerie bezeichnet. In der organischen Chemie gibt es zwei Hauptarten der Isomerie, die Konstitutions-Isomerie und die Stereoisomerie.

Die verschiedenen Arten der Isomerie
Autor: Ulrich Helmich 09/2024, Lizenz: Public domain
1. Konstitutions-Isomerie / Strukturisomerie
Unter der Konstitution einer organischen Verbindung versteht man die genau Anordnung der Atome: Welches Atom ist mit welchen anderen Atomen wie verbunden?
Konstitution erklärt am Beispiel Propen
Das Propen-Molekül besteht aus drei Kohlenstoff-Atomen und sechs Wasserstoff-Atomen. Die C-Atome 1 und 2 sind durch eine C=C-Doppelbindung miteinander verbunden, die C-Atome 2 und 3 durch eine C-C-Einfachbindung. Am C-Atom 1 befinden sich zwei H-Atome, am C-Atom 2 ein H-Atom, und am C-Atom 3 sitzen drei H-Atome.
Im obigen Kasten sehen Sie ein Beispiel für eine verbale Konstitutions-Beschreibung. Natürlich hätte man auch einfach eine Strukturformel zeichnen können.
Konstitutions-Isomere oder Strukturisomere besitzen die gleiche Summenformel, haben aber eine unterschiedliche Konstitution. Ein einfaches Beispiel hierfür sind die beiden Isomere des Butans.
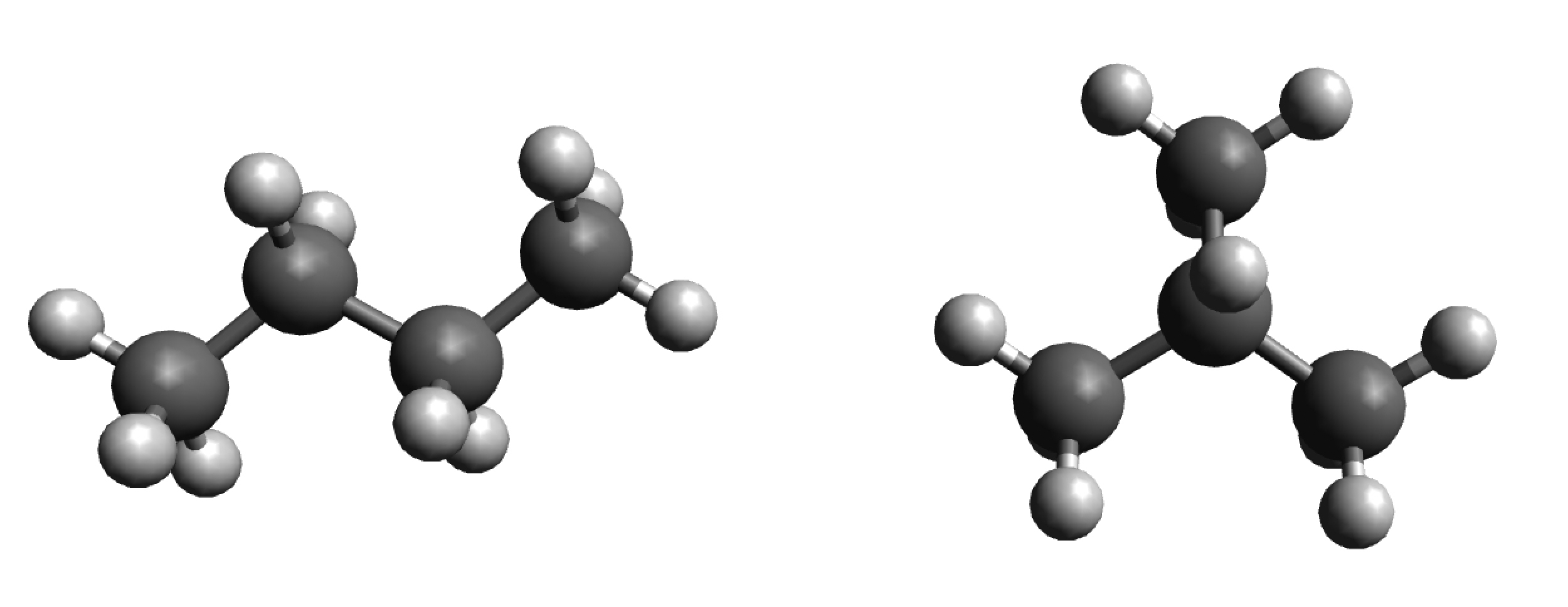
n-Butan und 2-Methylpropan als Kugel-Stab-Modell
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Neben dem unverzweigten n-Butan C4H10 gibt es das 2-Methylpropan C4H10, also ein Propan, an dessen mittlerem C-Atom eine dritte Methylgruppe sitzt.
Vom Pentan C5H12 gibt es drei Konstitutions-Isomere:

Die drei Pentan-Isomere
Autor: Ulrich Helmich 09/2024, Lizenz: Public domain
Links sehen wir das n-Pentan, in der Mitte das Methylbutan und rechts das Dimethylpropan.
Bei der Konstitutions-Isomerie unterscheidet man noch mehrere Formen, wie schon in der Abb. 1 zu sehen ist:
- Rumpf-Isomerie. Das klassische Beispiel aus dem Schulunterricht ist hier n-Butan und 2-Methylpropan.
- Stellungs-Isomerie. Hier sitzt eine funktionelle Gruppe an unterschiedlichen C-Atomen. Beispiel: Pentan-1-ol, Pentan-2-ol und Pentan-3-ol. Das Grundgerüst, der Rumpf der Isomere ist aber gleich bei allen drei Isomeren.
- Funktions-Isomerie. Klassisches Beispiel sind Ethanol und Dimethylether. Die Isomere haben die gleiche Summenformel, aber verschiedene funktionelle Gruppen.
- Valenz- oder Bindungs-Isomerie. Als Beispiel könnte man hier Pent-1-en und Pent-2-en nennen: Gleicher Rumpf, aber unterschiedliche Position der C=C-Doppelbindung.
Weitere Einzelheiten zum Thema Konstitutions-Isomere bzw. Strukturisomere finden Sie auf dieser Lexikon-Seite.
2. Stereoisomerie
Während zwei Konstitutions-Isomere unterschiedliche Konstitutionen haben, besitzen zwei Stereoisomere die gleiche Konstitution, aber die Atome oder Atomgruppen sind räumlich unterschiedlich angeordnet.
2.1 Konformations-Isomerie
Der einfachste Fall der Stereoisomerie ist die Konformations-Isomerie, hier gezeigt am Beispiel des n-Butans:

Zwei Konformationen des n-Butans
Autor: Ulrich Helmich 09/2024, Lizenz: Public domain
Durch Drehungen um Einfachbindungen können leicht viele verschiedene Konformationen des Moleküls entstehen. Größere Moleküle haben unzählbar viele verschiedene Konformationen. Bei kleineren, überschaubaren Molekülen wie zum Beispiel Ethan haben bestimmte Konformationen sogar eigene Namen:
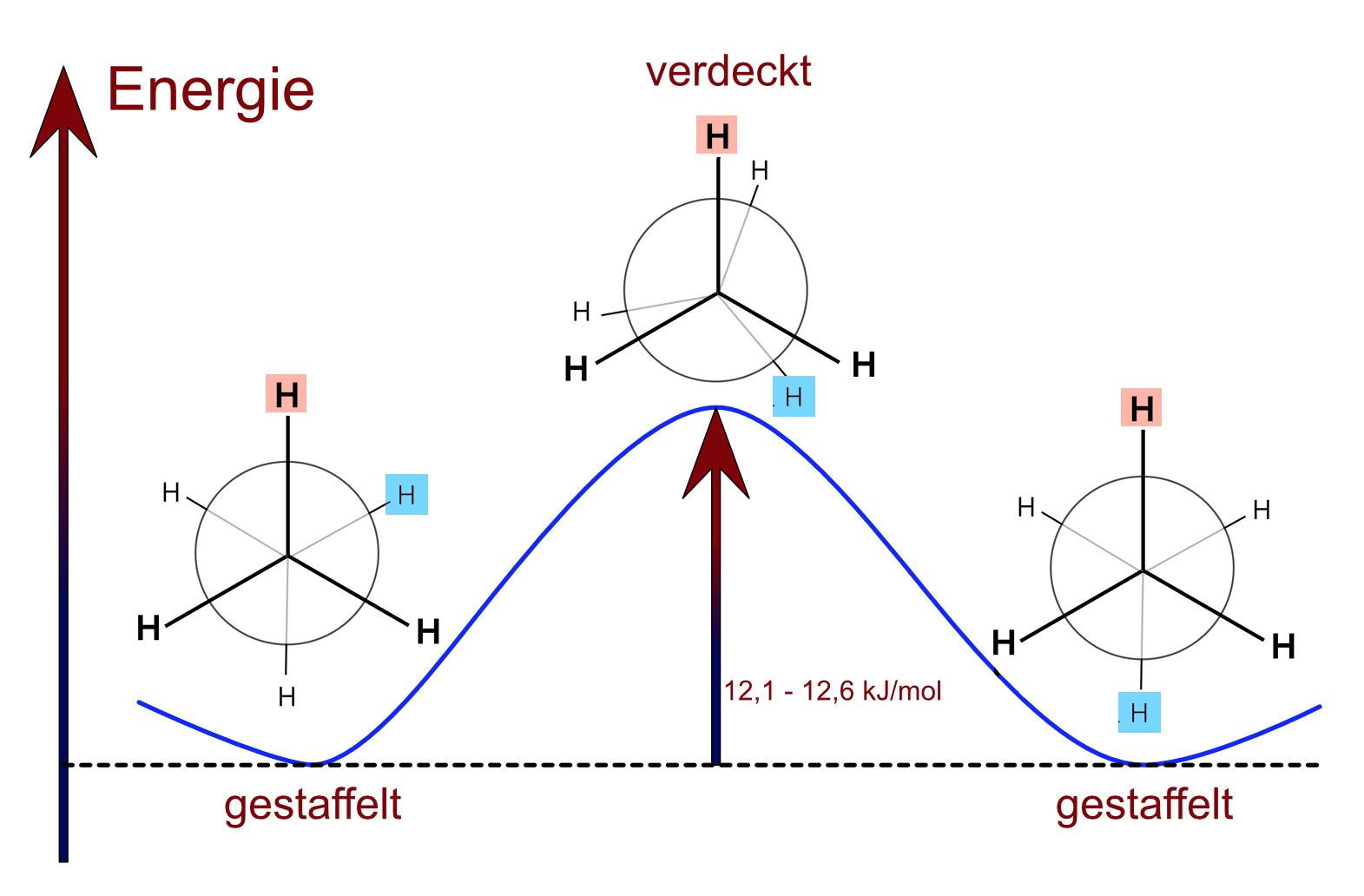
Konformationen des Ethan-Moleküls
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Die energetisch günstigste Konformation wird als "gestaffelt" bezeichnet, die H-Atome der beiden C-Atome sind maximal weit voneinander entfernt, so dass sich die Bindungselektronen der C-H-Bindungen nicht "in die Quere" kommen. Die energetisch ungünstigste Konformation wird als "verdeckt" bezeichnet. Zwischen diesen beiden bekannten Konformationen existieren aber unzählig viele andere Konformationen, die natürlich keine besonderen Namen mehr haben.
2.2 Konfigurations-Isomerie
Bei der Konfigurations-Isomerie haben die Isomere einer Verbindung zwar die gleiche Strukturformel (im Gegensatz zur Konstitutions- oder Struktur-Isomerie), aber die Atome sind unterschiedlich räumlich angeordnet. Man unterscheidet bei der Konfigurations-Isomerie zwei Fälle: die Enantiomerie (Spiegelbild-Isomerie) und die Diastereomerie (Isomere verhalten sich nicht wie Bild und Spiegelbild).
2.2.1 Enantiomerie
Bei dieser Art der Konfigurations-Isomerie verhalten sich die Isomere X und Y wie Bild und Spiegelbild, daher spricht man gelegentlich auch von Spiegelbild-Isomerie.
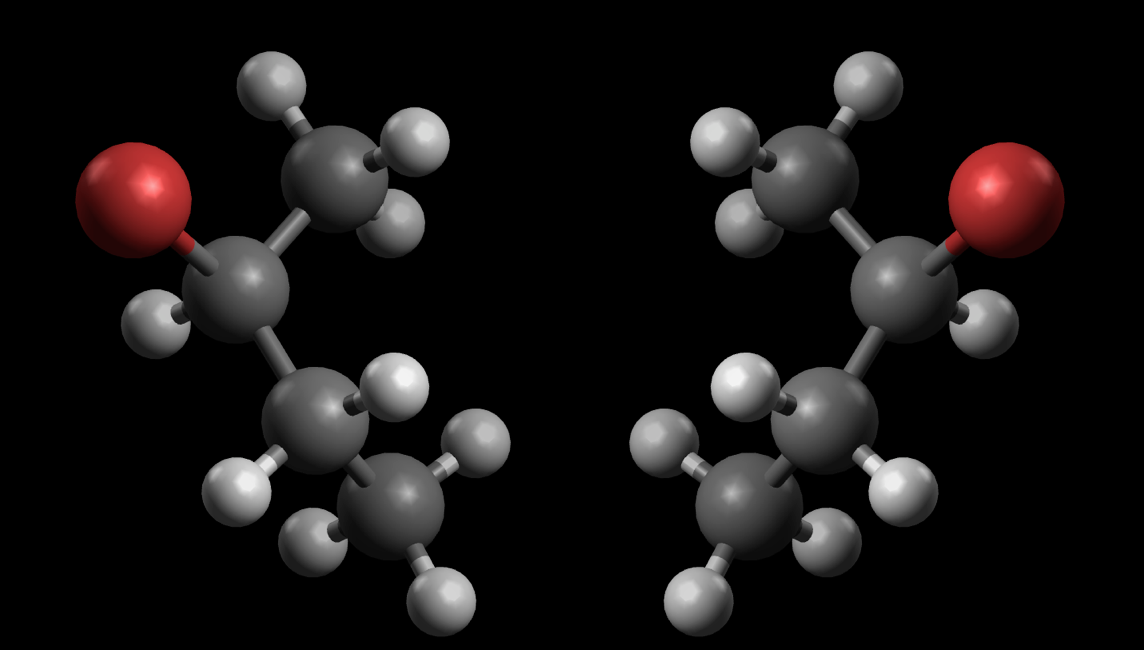
Bild und Spiegelbild des 2-Brom-butan
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir die beiden Enantiomere des 2-Brom-butans.
Wenn Sie gerade einen Molekülbaukasten zur Hand haben, bauen Sie doch einmal die beiden Modelle nach und versuchen dann, durch einfaches Drehen um die X-, Y- oder Z-Achse das eine Isomer in sein Spiegelbild zu überführen. Sie werden garantiert keinen Erfolg haben. Wenn Sie das linke Isomer in das rechte überführen wollen, müssen Sie in dem Modell kovalente Bindungen lösen und die Atome bzw. Atomgruppen neu verbinden.
Zwei Enantiomere einer Verbindung haben die gleichen physikalischen und chemischen Eigenschaften. Eine Ausnahme aus der Biologie sind die Enzyme, die nach dem Schlüssel-Schloss-Prinzip mit ihren Substraten reagieren. Das Spiegelbild eines solchen Substrats passt nicht in das aktive Zentrum des Enzyms hinein und wird daher auch nicht (oder nicht so gut) verarbeitet.
Weitere Einzelheiten zum Thema Spiegelbild-Isomerie finden Sie auf dieser Lexikon-Seite.
2.2.2 Diastereomerie
Konfigurations-Isomere, die sich nicht wie Bild und Spiegelbild verhalten, werden als Diastereomere bezeichnet. Bei der Diastereomerie unterscheidet man wieder zwei Fälle, nämlich die cis-trans-Isomerie und die Epimerie.
2.2.2.1 cis-trans-Isomerie
Die wohl bekannteste Form der Diastereomerie ist die bereits aus dem Chemieunterricht bekannte cis-trans-Isomerie, die meistens im Zusammenhang mit Alkenen oder Cycloalkanen behandelt wird.
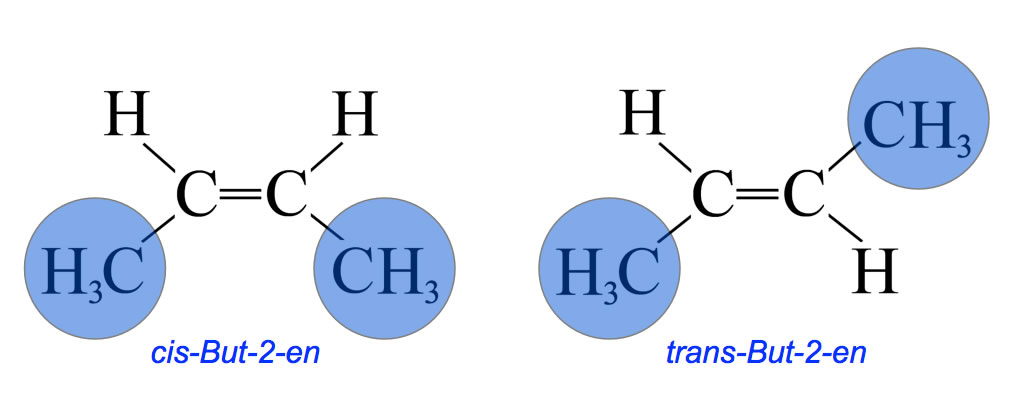
cis-trans-Isomerie am Beispiel But-2-en
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das cis-Isomer kann nur dann in das trans-Isomer überführt werden, wenn die C=C-Doppelbindung in eine C-C-Einfachbindung umgewandelt wird, beispielsweise durch Addition von Wasserstoff. Dann kann die eine Ethyl-Gruppe um 180 Grad gedreht werden, und anschließend muss die C=C-Doppelbindung neu erzeugt werden, zum Beispiel durch Eliminierung von Wasserstoff.
Auf dieser Lexikonseite wird diese Art der Stereoisomerie ausführlich erläutert. Auch auf die Z/E-Terminologie bei komplexeren Fällen wird eingegangen.
2.2.2.2 Epimerie
Epimere sind Diastereomere, die sich nicht wie cis-trans-Isomere verhalten. Das hört sich zunächst kompliziert an, wird aber sofort klar, wenn man sich wieder ein einfaches Beispiel anschaut.

Konfigurations-Isomere bei Aldotetrosen: Erythrose und Threose
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier sehen wir die Moleküle von zwei Aldotetrosen, also Monosacchariden mit vier C-Atomen und einer Aldehyd-Funktion.
Die Strukturformen ähneln sich stark, die Konstitution der beiden Isomere ist identisch: Eine Kette von vier C-Atomen, das C1-Atom ist Teil einer Aldehyd-Gruppe, die C2- und C3-Atome tragen je eine OH-Gruppe und ein H-Atom, und das C4-Atom besitzt eine OH-Gruppe und zwei H-Atome. Wie Bild und Spiegelbild verhalten sich die beiden Isomere nicht, und eine cis-trans-Isomerie liegt auch nicht vor.
Könnte man nicht die Erythrose durch Drehen des C2-Atoms um 180 Grad in die Threose umwandeln? Dann hätten wir es gar nicht mit Diastereomeren zu tun, sondern mit einfachen Konformations-Isomeren.
Um diese Frage zu beantworten, muss man entweder ein sehr gutes räumliches Vorstellungsvermögen haben oder - so wie ich - einfach mal ein Molekülmodell der Erythrose bauen.
Epimere sind Konfigurations-Isomere, die sich weder wie Enantiomere noch wie cis-trans-Isomere verhalten.
Auf dieser Lexikonseite finden Sie weitere Einzelheiten zu dem Thema.