Struktur und Strukturdaten
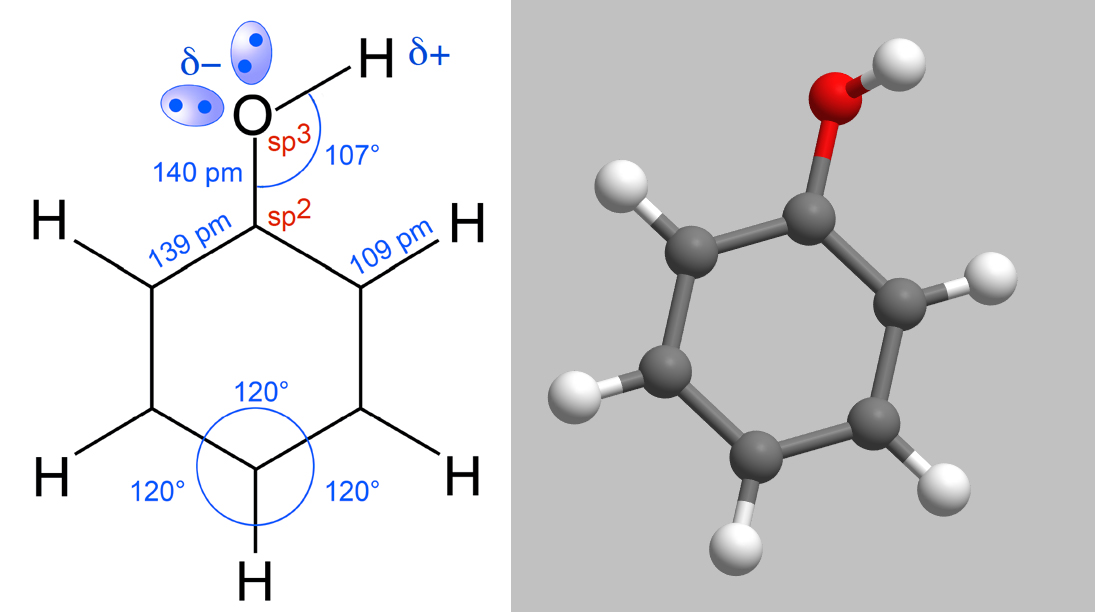
Strukturdaten des Phenol-Moleküls
Bindungslänge C-C im Benzolring = 139 pm; Bindungslänge C-H = 109 pm, Bindungslänge C-O = 140 pm. Bindungswinkel im Ring 120 Grad, Bindungswinkel O-H = 107 Grad.
Die sechs C-Atome des Benzolrings sind sp2-hybridisiert, wie man es vom Benzol-Molekül her kennt. Das nicht im Benzolring liegende O-Atom ist dagegen sp3-hybridisiert. Die Bindungslängen und -winkel sind aus der linken Abbildung erkenntlich, der räumliche Aufbau aus der rechten.
Physikalische Eigenschaften
Wasserlöslichkeit
Löst man ein paar Phenol-Kristalle in wenig Wasser, erhält man eine mehr oder weniger klare Lösung. Löst man die gleiche Menge Phenol in etwas mehr Wasser, so geht das nicht. Gibt man dann aber noch mehr Wasser dazu, löst sich das Phenol wieder und es entsteht eine klare Lösung.
Solch ein Phänomen nennt man in der physikalischen Chemie eine Mischungslücke. Hat man viel Phenol und wenig Wasser, so löst sich das Wasser quasi im Phenol. Hat man dagegen viel Wasser und wenig Phenol, so löst sich das Phenol im Wasser. Sind die Mengen an Wasser und Phenol ausgeglichen, so löst sich weder Wasser in Phenol noch Phenol in Wasser.
Betrachten wir dazu folgendes Diagramm:
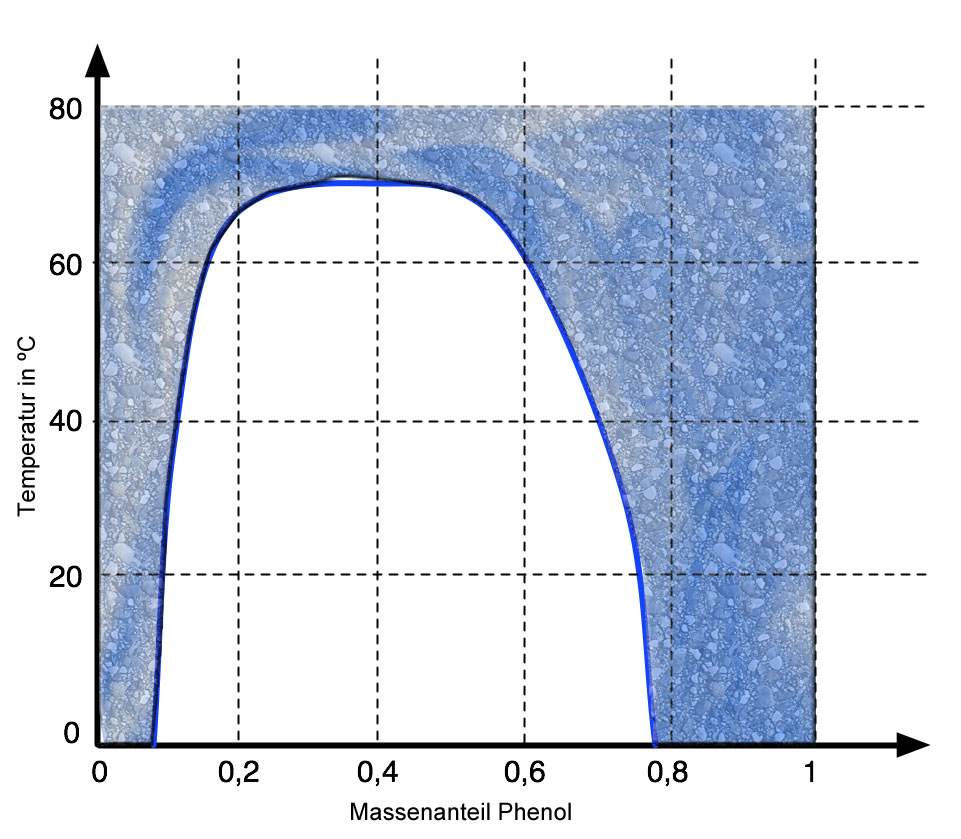
Die Mischungslücke des Phenol-Wasser-Systems
Autor: Ulrich Helmich, Lizenz: Public domain
Diese Abbildung zeigt die Mischungslücke im Phenol-Wasser-System, die aber nur bei Temperaturen unterhalb von ca. 72 ºC besteht. Oberhalb dieser Temperatur verschwindet die Mischungslücke, und man kann dann Phenol und Wasser in beliebigen Massenanteilen mischen.
Schmelzpunkt und Siedepunkt
Der Schmelzpunkt von Phenol liegt bei 41 ºC, der Siedepunkt bei 182 ºC. Wenn wir diese Daten mit denen von Benzol vergleichen (6 ºC bzw. 80 ºC), dann fällt auf, das beide Werte beim Phenol deutlich höher sind, was natürlich an der zusätzlichen OH-Gruppe liegt. Einen ähnlichen Effekt sieht man ja auch beim Vergleich von Ethan und Ethanol.
Chemische Eigenschaften
Als Aromat geht Phenol gern elektrophile Substitutionen ein. Die OH-Gruppe erhöht die Reaktivität des Benzolringes. Für den Chemieunterricht ist dies höchst interessant, denn eigentlich müsste die OH-Gruppe die Elektronendichte des Ringes vermindern, wegen des -I-Effekts, den die OH-Gruppe hat. Das Gegenteil ist aber der Fall. Durch den +M-Effekt wird die Elektronendichte im Ring sogar erhöht. Daher ist Phenol reaktiver als beispielsweise Toluol, das ja auch schon recht reaktiv ist, wegen des +I-Effekts der Methylgruppe. So kann Phenol beispielsweise bereits bei Zimmertemperatur mit Bromwasser zu einem dreifach substituierten Bromphenol reagieren. Auch Sulfonierungen, Friedel-Crafts-Alkylierungen und -Acylierungen und weitere Reaktionen sind kein Problem.
Weitere Einzelheiten dazu auf der Seite "+M-Effekt vs. -I-Effekt beim Phenol" im Bereich "Aromaten".
Abgesehen von diesen elektrophilen Substitution kann Phenol auch als Alkohol reagieren. So ist es möglich, Phenol beispielsweise mit Essigsäurechlorid zu verestern:
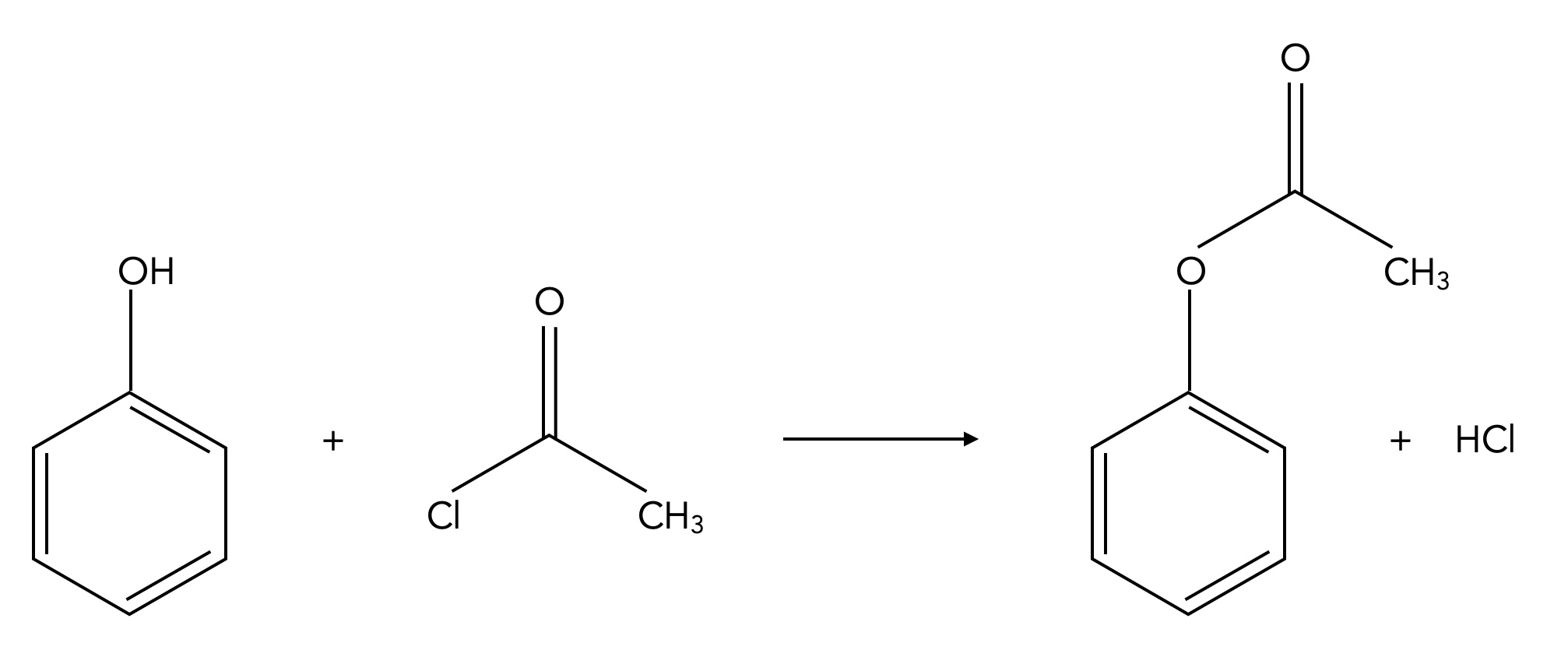
Veresterung von Phenol mit Essigsäurechlorid
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain