Definition
Redoxpaar
Bezeichnung für ein System, in denen ein Oxidations- neben einem korrespondierenden Reduktionsmittel vorliegt und sich ein Gleichgewicht nach dem Massenwirkungsgesetz einstellt[1].
Dies ist die Definition des Begriffs "Redoxsystem" aus dem berühmten RÖMPP Chemie-Lexikon.
Erklärungen
Betrachten wir zwei solcher Redoxpaar, nämlich Fe/Fe2+ und Cu/Cu2+.
Bei beiden Redoxpaaren stellt das Metall das Reduktionsmittel dar, weil die Metall-Atome Elektronen abgeben können, die dann für eine Reduktion eingesetzt werden können. Die Metall-Kationen sind dann die Oxidationsmittel, weil sie die Elektronen aufnehmen können, die bei einer Oxidation freigesetzt werden.
Ein Oxidationsmittel ist ein Teilchen, das einem anderen Teilchen Elektronen entzieht und es dadurch oxidiert. Das Oxidationsmittel (der Elektronenakzeptor) wird dadurch selbst reduziert.
Ein Reduktionsmittel ist ein Teilchen, das einem anderen Teilchen Elektronen zuführt und es dadurch reduziert. Das Reduktionsmittel (der Elektronendonator) wird dadurch selbst oxidiert.
Oft werden auch die Stoffe selbst als Oxidations- oder Reduktionsmittel bezeichnet und nicht nur die Teilchen, aus denen die Stoffe bestehen. So könnte man bei dem Eisennagel-Versuch sagen, dass Kupfersulfat das Oxidationsmittel ist, das dem Eisen Elektronen entzieht. Hier muss man stets zwischen der Teilchenebene (Eisen-Atome, Kupfer-Ionen) und der Stoffebene (Eisen, Kupfersulfat) unterscheiden.
Redoxpaare und Massenwirkungsgesetz
Was hat nun das Massenwirkungsgesetz mit dem Begriff "Redoxpaar" oder "Redoxsystem" zu tun? Dazu schauen wir uns einmal folgende Gleichung an:
$Fe_{(s)} \rightleftharpoons Fe^{2+}_{(aq)}+ 2 \ e^{-}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Das Gleichgewicht dieser Reaktion liegt unter Normalbedingungen weit auf der linken Seite.
Bei der Reaktion des Kupfers:
$Cu_{(s)} \rightleftharpoons Cu^{2+}_{(aq)}+ 2 \ e^{-}$
liegt das Gleichgewicht der Reaktion ebenfalls weit auf der linken Seite. Genauer gesagt, liegt das Gleichgewicht des Kupfer-Systems noch weiter links als das Gleichgewicht des Eisen-Systems, da Kupfer edler ist als Eisen und ein positiveres Redoxpotenzial hat.
Das Redoxpotenzial ist im Grunde nicht anderes als eine Maßeinheit dafür, wie stark das Gleichgewicht der Oxidation
$Me_{(s)} \rightleftharpoons Me^{n+}_{(aq)}+ n \ e^{-}$
auf der linken Seite liegt. Je negativer das Redoxpotenzial, desto leichter gibt das Metall Elektronen ab, und desto weiter liegt das Gleichgewicht auf der rechten Seite. Bei Metallen wie Natrium oder Kalium liegt das Gleichgewicht sogar "richtig" auf der rechten Seite, diese Metalle sind ja bekanntlich so unedel, dass sie bei Normalbedingungen heftig mit Sauerstoff oder Wasser reagieren. Metalle wie Zink haben auch ein negatives Redoxpotenzial, jedoch liegt das Gleichgewicht der Reaktion auf der linken Seite, allerdings nicht allzu weit links. Bei Edelmetallen wie Kupfer oder Silber liegt das Gleichgewicht dann ganz stark auf der linken Seite.
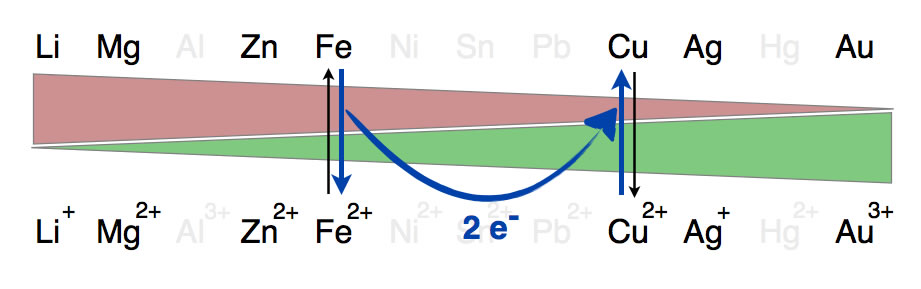
Verschiedene Redoxpaare aus der Redoxreihe der Metalle
Dieses Bild zeigt noch einmal die beiden oben besprochenen Redoxpaare Fe/Fe2+ und Cu/Cu2+. Der Elektronentransfer von den Eisen-Atomen auf die Kupfer-Ionen ist durch den dicken blauen Pfeil verdeutlicht. Der rote Keil zeigt die abnehmende Bereitschaft der Metall-Atome zur Elektronenabgabe, der grüne Keil verdeutlicht die zunehmende Bereitschaft der Metall-Kationen zur Aufnahme von Elektronen.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992, Band 5