Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- erläutern können, wieso Prokaryoten innerhalb kürzester Zeit sehr viele Proteine herstellen können,
- begründen können, warum das für Prokaryoten ein Überlebensvorteil ist.
Initiation - Start der Translation
Die beiden ersten Schritte
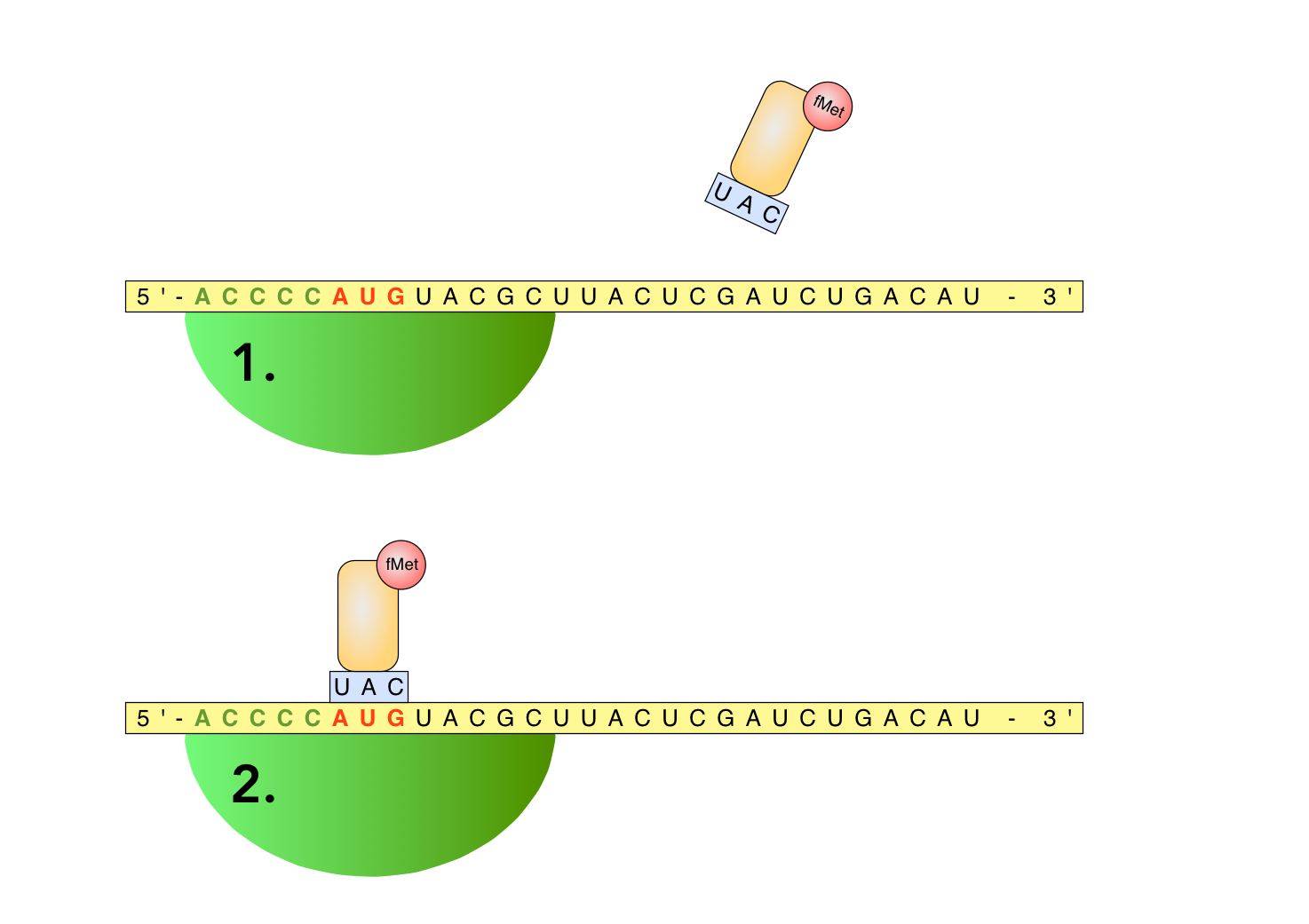
Die ersten Schritte der Translations-Initiation
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bild 1
Die kleine Ribosomen-Untereinheit setzt sich an die Ribosomen-Erkennungssequenz der mRNA. Das Startcodon AUG der Translation ist hier rot hervorgehoben. Neben vielen anderen beladenen und unbeladenen tRNAs befindet sich auch eine beladene fMettRNA im Cytoplasma.
Bild 2
Die fMettRNA setzt sich mit ihrem Anticodon UAC an das Startcodon AUG der mRNA. Es bilden sich Wasserstoffbrücken-Bindungen zwischen den drei Basen des Codons AUG und den drei Basen des Anticodons UAC aus.
Die beiden MettRNAs
Es gibt bei Prokaryoten zwei verschiedene MettRNAs, nämlich die "normale" MettRNA, und die fMettRNA. Die "normale" MettRNA dient zum Einbau der Aminosäure Methionin in die wachsende Peptidkette. Die etwas anders aufgebaute fMettRNA wird nur beim Start der Translation verwendet. Das Methionin am Anfang des Peptids ist kein "normales" Methionin, sondern an die Aminogruppe wurde ein Formylrest "angebaut":
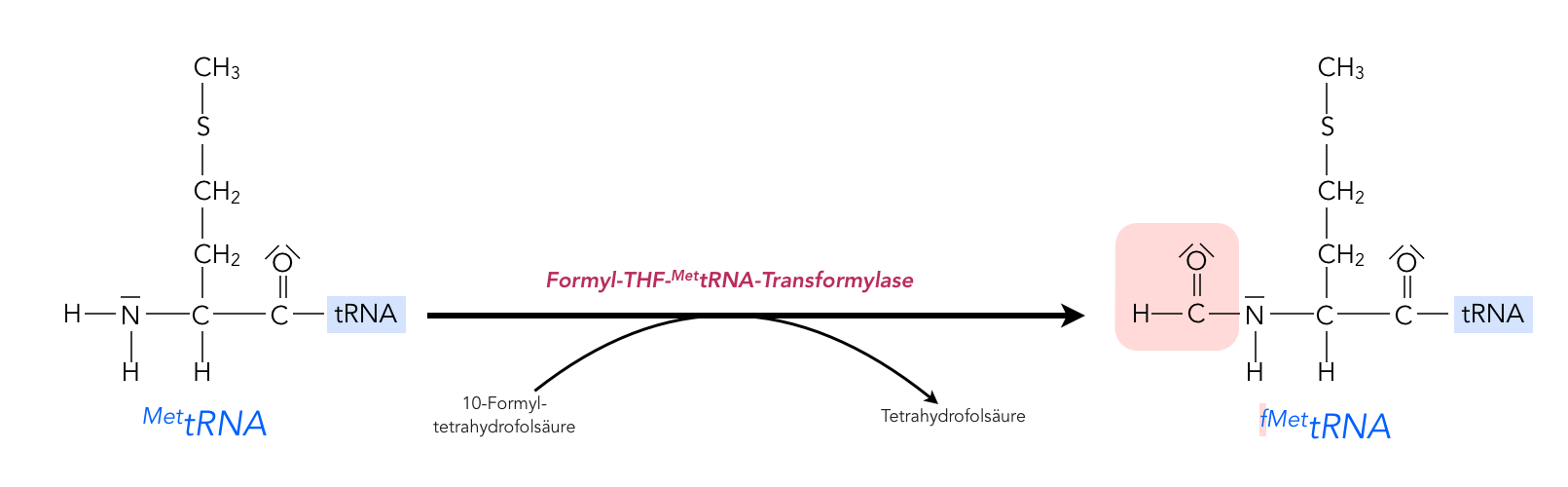
Bildung der fMettRNA
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese Reaktion findet erst dann statt, wenn das Methionin bereits mit der tRNA verbunden wurde. Die Formylgruppe (H-C=O, von der Ameisensäure H-COOH bzw. vom Formaldehyd H2C=O abgeleitet) wird von dem Enzym Formyl-THF-MettRNA-Transformylase von einem 10-Formyl-tetrahydrofolsäure-Molekül auf das Methionin-Molekül der MettRNA übertragen.
Man vermutet, dass durch diese chemische Modifizierung dafür gesorgt wird, dass die nächste Aminosäure nur an die COOH-Gruppe des Methionins angebaut werden kann. Die NH2-Gruppe wird ja durch die Formyl-Gruppe blockiert, hier kann also keine Aminosäure angebaut werden. Nach der Translation, der Fertigstellung des Peptids, wird die Formylgruppe von der ersten Aminosäure wieder entfernt, und zwar durch das Enzym Polypeptid-Deformylase. Oft wird auch das komplette Formyl-Methionin-Molekül entfernt (durch Methionin-Aminopeptidase), denn nicht alle Peptide der Bakterien beginnen mit Methionin.
Elongation
Die Initiation ist jetzt beendet, wir befinden uns nun in der Elongationsphase. Schauen wir uns die Einzelschritte der Elongation mal näher an.
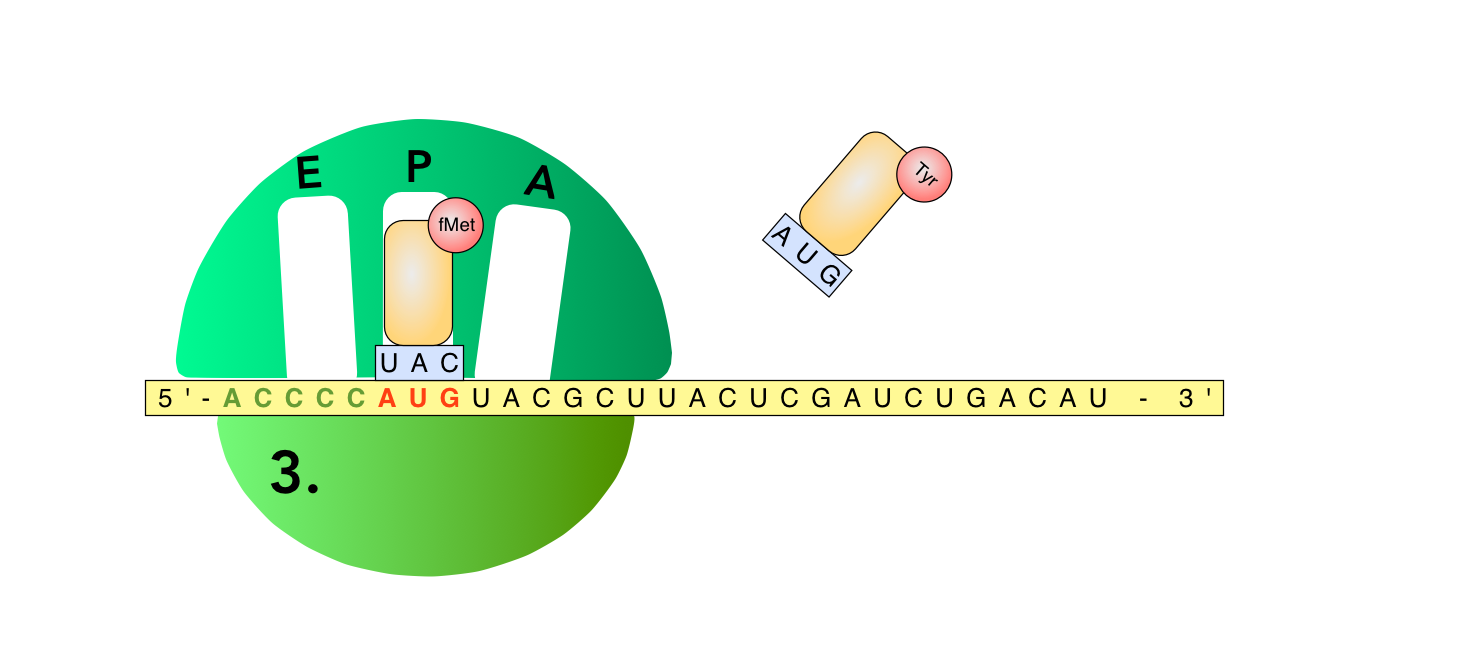
Der nächste Schritt der Translations-Initiation
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bild 3
Im nächsten Schritt setzt sich die große Ribosomen-Untereinheit an den Komplex aus mRNA und kleiner Untereinheit. Die große Ribosomen-Untereinheit besitzt drei spezielle "Taschen", in die jeweils eine beladene tRNA hineinpasst. Diese Taschen werden in der Literatur stets mit den Buchstaben E, P und A gekennzeichnet. Die große Untereinheit platziert sich so, dass die gebundene fMettRNA von der P-Tasche aufgenommen wird. Die E- und die A-Taschen bleiben zunächst leer.
Kleine Denkaufgabe:
Aber wenn Sie genau hinschauen und etwas voraus denken, sollten Sie schon erahnen, was als Nächstes passiert: Die im Cytoplasma herum diffundierende TyrtRNA hat das Anticodon AUG, welches wie ein Schlüssel ins Schloss zum nächsten Codon UAC auf der mRNA passt - und die A-Tasche ist noch frei!
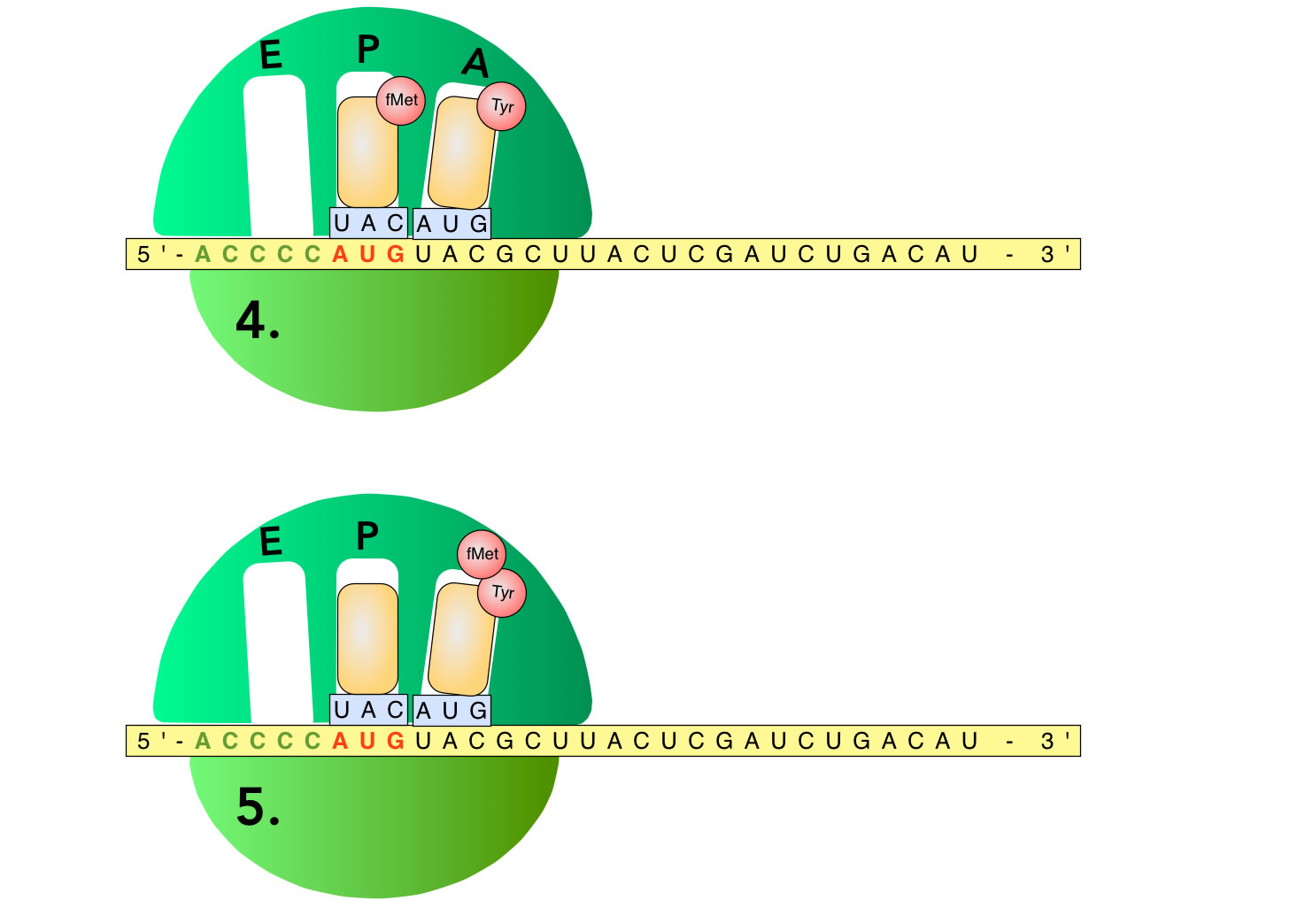
Die Schritte 4 und 5 der Translation
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bild 4
Wie Sie sicherlich schon geahnt haben, setzt sich jetzt die beladene TyrtRNA in die A-Tasche.
Bild 5
Jetzt passiert etwas sehr Interessantes: die Aminosäure der fMettRNA wird an die Aminosäure angehängt, die sich auf der tRNA in der A-Tasche (A = Aminosäure) befindet. Es ist ein Dipeptid entstanden.
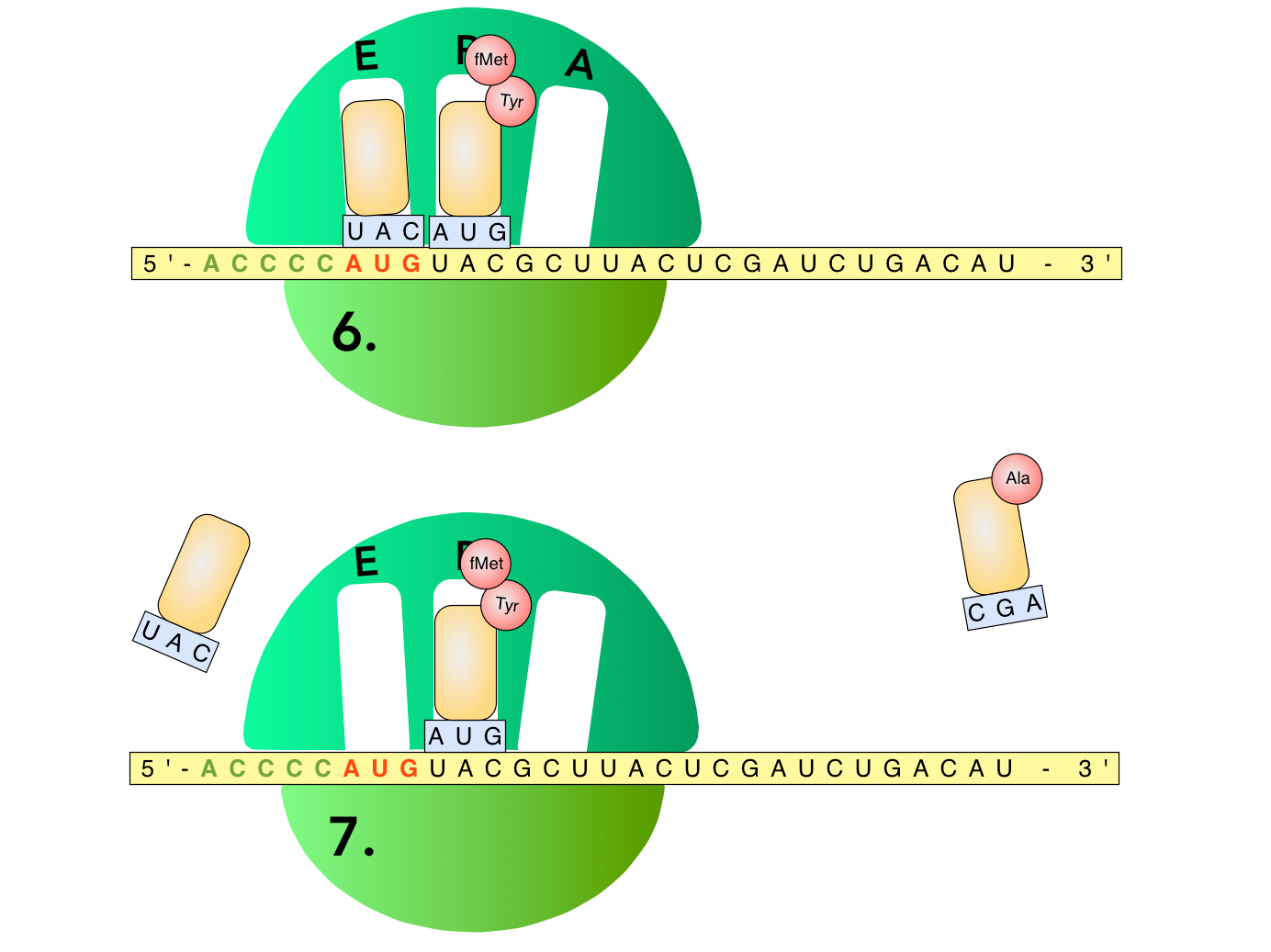
Die beiden nächsten Schritte
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Schritt 6
Das Ribosom bewegt sich nun drei Basen weiter zum 3'-Ende der mRNA hin. Dadurch gerät die erste tRNA, die jetzt ihre Aminosäure abgegeben hat, in die E-Tasche. Der Buchstabe 'E' steht für "Exit", also "Ausgang". Die zweite tRNA mit dem Dipeptid befindet sich durch den Bewegungsvorgang plötzlich in der P-Tasche. Das 'P' steht hier für "Peptid". Und die A-Tasche ist wieder frei geworden, so dass die nächste beladene tRNA aufgenommen werden kann, deren Anticodon zu dem nächsten Codon der mRNA passt: CGU.
Schritt 7
Die "alte", nicht mehr benötigte, entladene tRNA verlässt das Ribosom über die E-Stelle.
Kleine Denkaufgabe:
Was passiert als Nächstes?
Antwort:
Die AlatRNA hat das Anticodon CGA, welches zum nächsten Codon GCU auf der mRNA passt. Diese tRNA setzt sich also in die freie A-Stelle, und das Dipeptid fMet-Tyr wird auf die "mitgebrachte" Aminosäure Alanin übertragen, so dass sich jetzt eine tRNA mit dem Tripeptid fMet-Tyr-Ala in der A-Stelle befindet.
Und dann?
Dann rückt das Ribosom wieder drei Basen weiter zum 3'-Ende hin, und die tRNAs gelangen so vom P- in den E-Platz bzw. vom A- in den P-Platz. Schauen wir uns da einmal an:
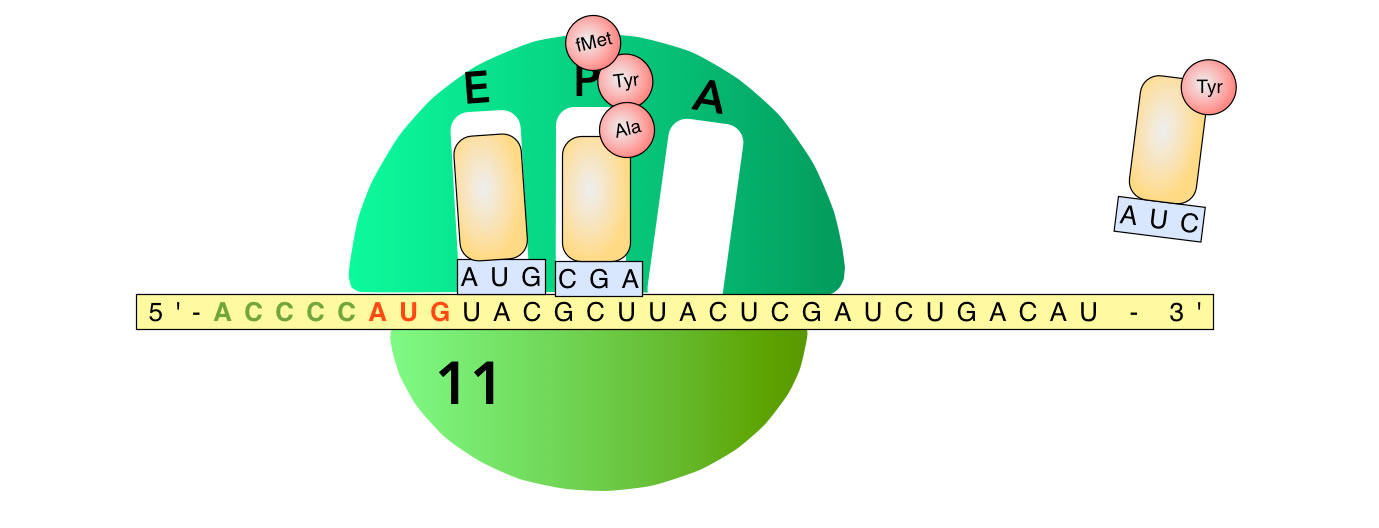
Der gerade beschriebene Schritt
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Und so geht das immer weiter, bis schließlich das Stopp-Codon im A-Platz liegt.
Termination
Die Translation terminiert (wird beendet), wenn ein Stopp-Codon in der A-Stelle des Ribosoms liegt. Für das Codon UGA und die anderen Stopp-Codons gibt es keine passende tRNA. Der Elongationsmechanismus wird unterbrochen, das Ribosom zerfällt in seine beiden Untereinheiten, und die Translation stoppt.
Die mRNA existiert natürlich noch ein paar Minuten weiter, und in dieser Zeit können andere Ribosomen an den Anfang der mRNA andocken und erneut mit einer Translation beginnen. Ein einziges mRNA-Molekül kann also viele Peptid- oder Protein-Moleküle produzieren. Bei Bakterien wie Escherichia coli hat man sogar beobachtet, dass viele Ribosomen hintereinander auf der mRNA sitzen und Peptide produzieren; man spricht dann von Polysomen.
Wenn Sie immer noch nicht genug haben von der Translation, gehen Sie doch auf die Vertiefungsseite, die ich extra für Studierende der Biologie geschrieben habe. Vielleicht finden Sie dort ja genug "Lesefutter". Wenn nicht, sollten Sie sich eines der unten genannten Lehrwerke kaufen und dort die entsprechenden Kapitel lesen. Vor allem der Stryer ist sehr zu empfehlen, er stellt in Kapitel 30 alle Phasen der Translation wesentlich ausführlicher dar als der Knippers oder der Graw.
Quellen:
- Alfred Nordheim, Rolf Knippers: Molekulare Genetik, 11. Auflage, Thieme-Verlag Stuttgart 2018.
- Jochen Graw: Genetik, 7. Auflage, Springer Spektrum, Berlin 2021.
- Nelson, Cox: LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.