Das Enzym Ribulose-1,5-bisphosphat-carboxylase-oxygenase, abgekürzt als RuBisCO, katalysiert den ersten Schritt des Calvin-Zyklus, der Dunkelphase der Photosynthese. Ribulose-1,5-bisphosphat-carboxylase-oxygenase ist das häufigste Enzym der Erde, denn es kommt in jeder grünen Pflanze vor und zudem in allen photosynthetisch aktiven Algen und Prokaryoten (Bakterien und Archaeen).
Einzelheiten zum Calvin-Zyklus finden Sie auf der entsprechenden Seite in der Stoffwechsel-Abteilung meiner Homepage.
Rolle von BuBisCO im Calvin-Zyklus
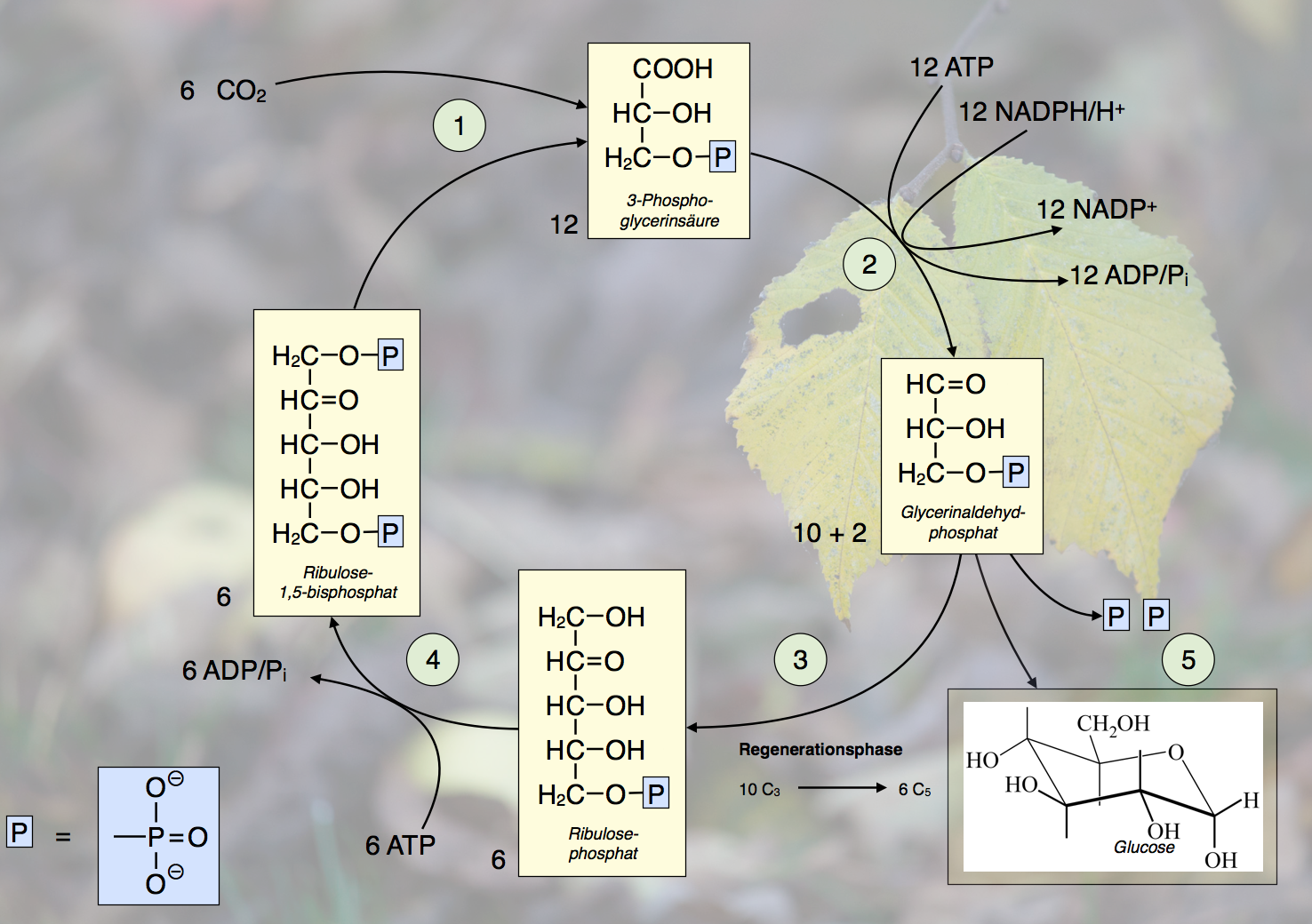
Der Calvin-Zyklus der Photosynthese
Autor: Ulrich Helmich, Lizenz: Public domain
Ribulose-1,5-bisphosphat-carboxylase-oxygenase katalysiert die Anlagungerung von Kohlendioxid an das CO2-Akzeptor-Molekül Ribulose-1,5-bisphosphat.
Im Schritt 1 des Calvin-Zyklus lagert sich ein CO2-Molekül an das Ribulose-1,5-bisphosphat-Molekül an. Dabei entsteht ein sehr instabiles Zwischenprodukt mit sechs C-Atomen, das hier aber nicht eingezeichnet ist. Das Zwischenprodukt zerfällt dann sehr schnell in zwei 3-Phosphoglycerinsäure-Moleküle mit jeweils drei C-Atomen [1].
Sauerstoff als Konkurrent des Kohlendioxids
Das Enzym Ribulose-1,5-bisphosphat-carboxylase-oxygenase katalysiert allerdings auch die Anlagerung von Sauerstoff an Ribulose-1,5-bisphosphat. Dabei entstehen dann ein Molekül 2-Phosphoglycolat und ein Molekül 3-Phosphoglycerinsäure. Das erste Produkt, das 2-Phosphoglycerat, ist aber für die Pflanze giftig. Es wird dann in den Peroxisomen und Mitochondrien unter CO2-Abspaltung abgebaut.
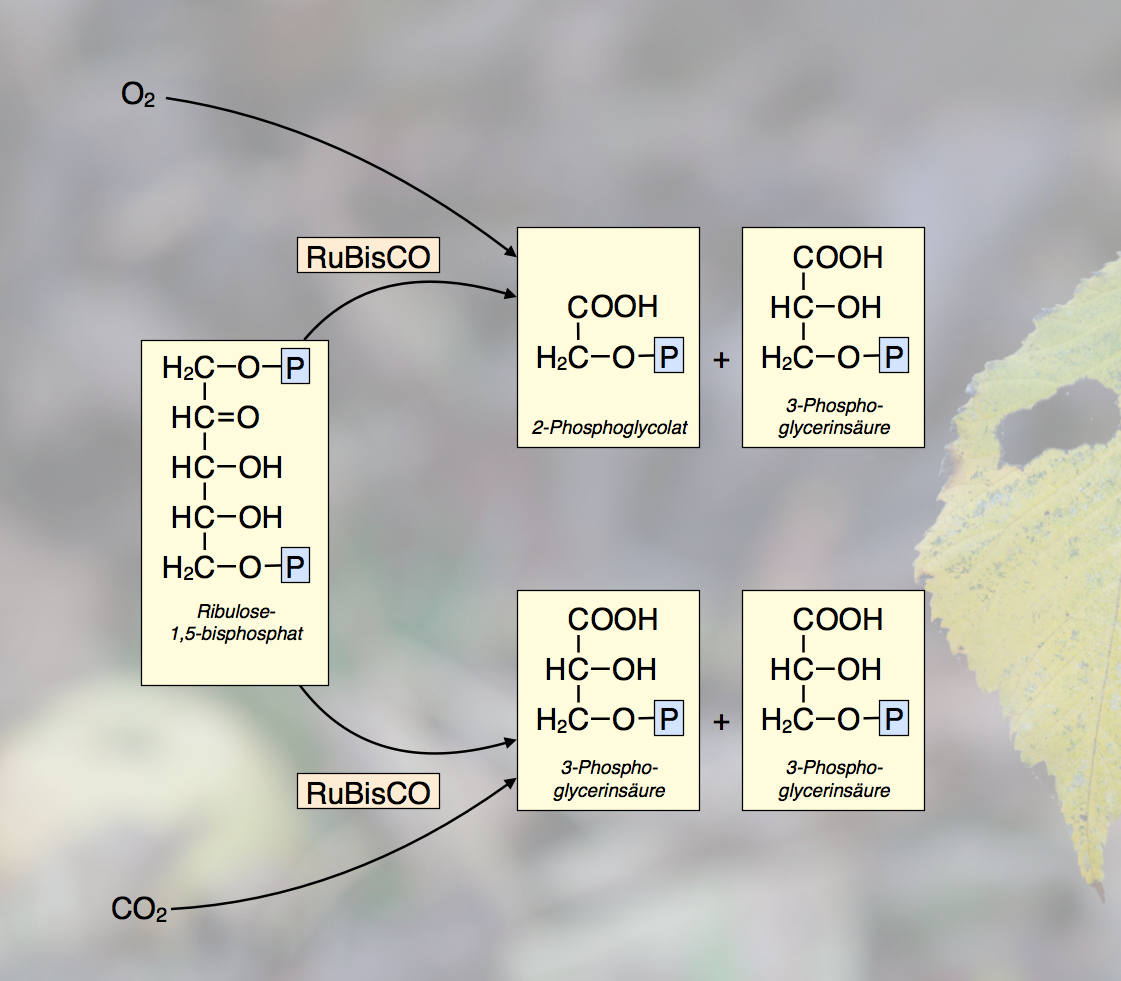
Die doppelte Rolle der RuBisCO
Autor: Ulrich Helmich, Lizenz: Public domain
Dieser "Fehler" passierte vor ca. 2,5 Milliarden Jahren [2]. CO2 und O2 haben eine sehr ähnliche Struktur. Vor 2,5 Milliarden Jahren, als die ersten Organismen anfingen, Photosynthese zu betreiben, waren die Enzyme noch nicht so substratspezifisch wie heute. Die hohe Substratspezifität, wie wir sie heute kennen, musste sich ja erst langsam entwickeln. Außerdem gab es vor 2,5 Milliarden Jahren überhaupt noch keinen Sauerstoff auf der Erde, also bestand für die Ribulose-1,5-bisphosphat-carboxylase gar kein Grund, zwischen CO2 und O2 zu unterscheiden.
Die Geschwindigkeit der CO2-Addition an die Ribulose-1,5-bisphosphat-carboxylase/oxygenase ist ca. viermal so hoch wie die der O2-Addition, daher ist die CO2-Konzentration in den Chloroplasten auch 25 mal geringer als die O2-Konzentration [3].
Allerdings nahm im Laufe der Zeit der Sauerstoffgehalt der Atmosphäre langsam zu, weil ja immer mehr Bakterien, Archaeen und dann einige Zeit später auch viele Eukaroten Sauerstoff produzierten, weil sie Photosynthese betrieben.
Die Prokaryoten und Eukaryoten haben dann verschiedene Wege entwickelt, um mit diesem Problem fertig zu werden, dass das Schlüsselenzym des Calvin-Zyklus nicht nur CO2 bindet, sondern auch O2, was ja kontraproduktiv zur Photosynthese ist [2].
C3-Pflanzen
Die sogenannten C3-Pflanzen, also die meisten grünen Pflanzen, die wir kennen, lösen das Problem nach dem Motto "Viel hilft viel". Sie produzieren unheimlich viel RuBisCO-Moleküle, die allerdings eine geringere Affinität (Bindungsfähigkeit) zu CO2 und O2 haben. Das Enzym arbeitet auf diese Weise deutlich langsamer, hat dadurch aber mehr Zeit, "genauer hinzuschauen", welches Substrat es eigentlich verarbeitet. Diese Strategie der C3-Pflanzen ist auch der Grund dafür, dass RuBisCO das mengen- bzw. massemäßig häufigste Enzym der Erde ist.
C4-/CAM-Pflanzen
Ca. 3% aller Bedecktsamer gehören zu den C4- oder CAM-Pflanzen. Vor allem Süßgräser wie Mais gehören zu dieser Gruppe.
Diese C4-Pflanzen binden das Kohlendioxid zunächst chemisch in einem C4-Körper, meisten Äpfelsäure (Malat) (daher auch der Name C4-Pflanzen). Dieser C4-Körper kann dann das CO2 wieder an den Calvin-Zyklus abgeben, ohne dass Sauerstoff-Moleküle "dazwischenfunken". Die C4-Pflanzen führen diesen Speichermechanismus tagsüber aus, während die CAM-Pflanzen die beiden Prozesse zeitlich trennen. Tagsüber wird CO2 gespeichert, Nachts wird das CO2 wieder freigesetzt und fließt in den Calvin-Zyklus ein.
Blaualgen
Die raffinierteste Lösung des Problems haben die Cyanobakterien (Blaualgen) entwickelt. In den Zellen der Blaualgen ist das RuBisCO-Enzym von einer Proteinhülle umschlossen, die als Carboxysom bezeichnet wird. Diese Proteinhülle wirkt nun wie ein Filter: Kohlendioxid wird durchgelassen, Sauerstoff nicht.
Bau und Regulation des Enzyms
Das Schlüsselenzym des Calvin-Zyklus, die Ribulose-1,5-bisphosphat-Carboxylase/Oxidases (RuBisCO) ist ein Protein, das aus 16 Untereinheiten zusammengesetzt ist, 8 großen und 8 kleinen. Jede große Untereinheit besitzt ein aktives Zentrum und ein allosterisches Zentrum.
Die acht großen Untereinheiten werden in den Plastiden synthetisiert; das Gen für die Untereinheit liegt auf der Plastiden-DNA. Interessanterweise werden die kleinen Untereinheiten im Zellplasma synthetisiert, das Gen liegt auf der DNA im Zellkern [4]. Es muss im Laufe der Evolution aus den symbiontischen Prokaryoten und jetzigen Plastiden herausgewandert und von der Zell-DNA übernommen worden sein (siehe auch Endosymbionten-Theorie).
Das Enzym macht ca. 30% des gesamten Blatt-Proteis aus. Wie bereits weiter oben ausgeführt, liegt das daran, dass RuBisCO nicht nur CO2 als Substrat akzeptiert, sondern auch O2. In der Evolution der Pflanzen hat sich daher eine Enzymvariante durchgesetzt, die eine nur sehr geringe Affinität zu CO2/O2 hat und daher sehr langsam arbeitet, damit das Enzym "mehr Zeit hat", zwischen O2 und CO2 zu unterscheiden. Diese geringe Enzymaktivität (es werden maximal nur ca. 3 Substrat-Moleküle pro Sekunde umgesetzt) muss jetzt durch Masse ausgeglichen werden [3, 4].
Das Enzym arbeitet nur dann korrekt, wenn zweiwertige Magnesium-Ionen anwesend sind.
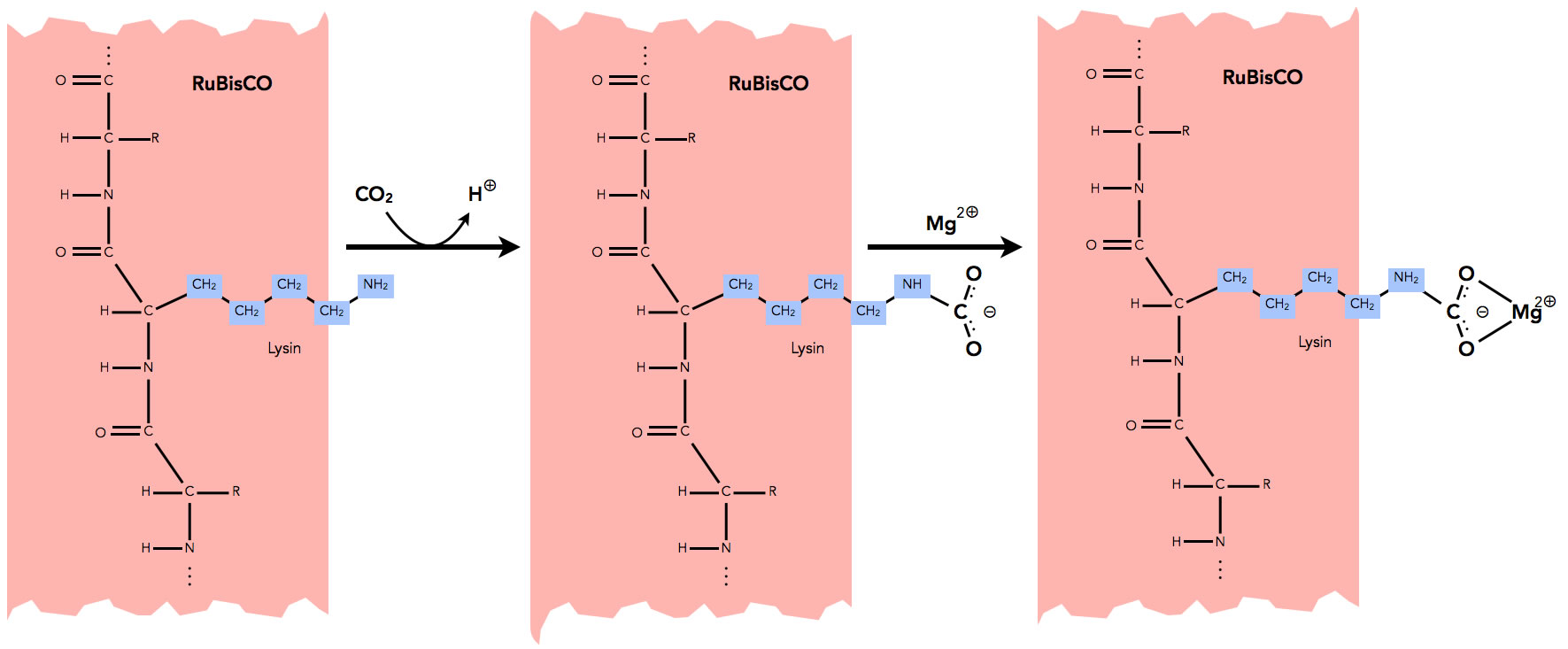
Bindung des Magnesium-Ions an RuBisCO (durch Klicken vergrößern)
Autor: Ulrich Helmich, Lizenz: Public domain
Das CO2-Molekül bindet an eine Lysin-Seitenkette der RuBisCO (Position 201 im Protein). Ein Proton wird dabei abgegeben, es entsteht eine negativ geladene COO--Gruppe. An diese bindet sich jetzt das Magnesium-Ion und neutralisiert dadurch die negative Ladung. Erst jetzt ist das Enzym "richtig" aktiv und kann die Reaktion durchführen. Das Magnesium-Ion wiederum dient jetzt als Bindungsstelle für den CO2-Akzeptor Ribulose-1,5-bisphosphat.
Dass Mg2+ als Aktivator fungiert, sollte damit klar sein. Aber auch das Substrat CO2 ist gleichzeitig ein allosterischer Aktivator des Enzyms [4], denn ohne CO2 kann sich kein Mg2+ anlagern, und ohne Mg2+ kann sich das organische Haupt-Substrat Ribulose-1,5-bisphosphat nicht in das aktive Zentrum des Enzyms setzen:
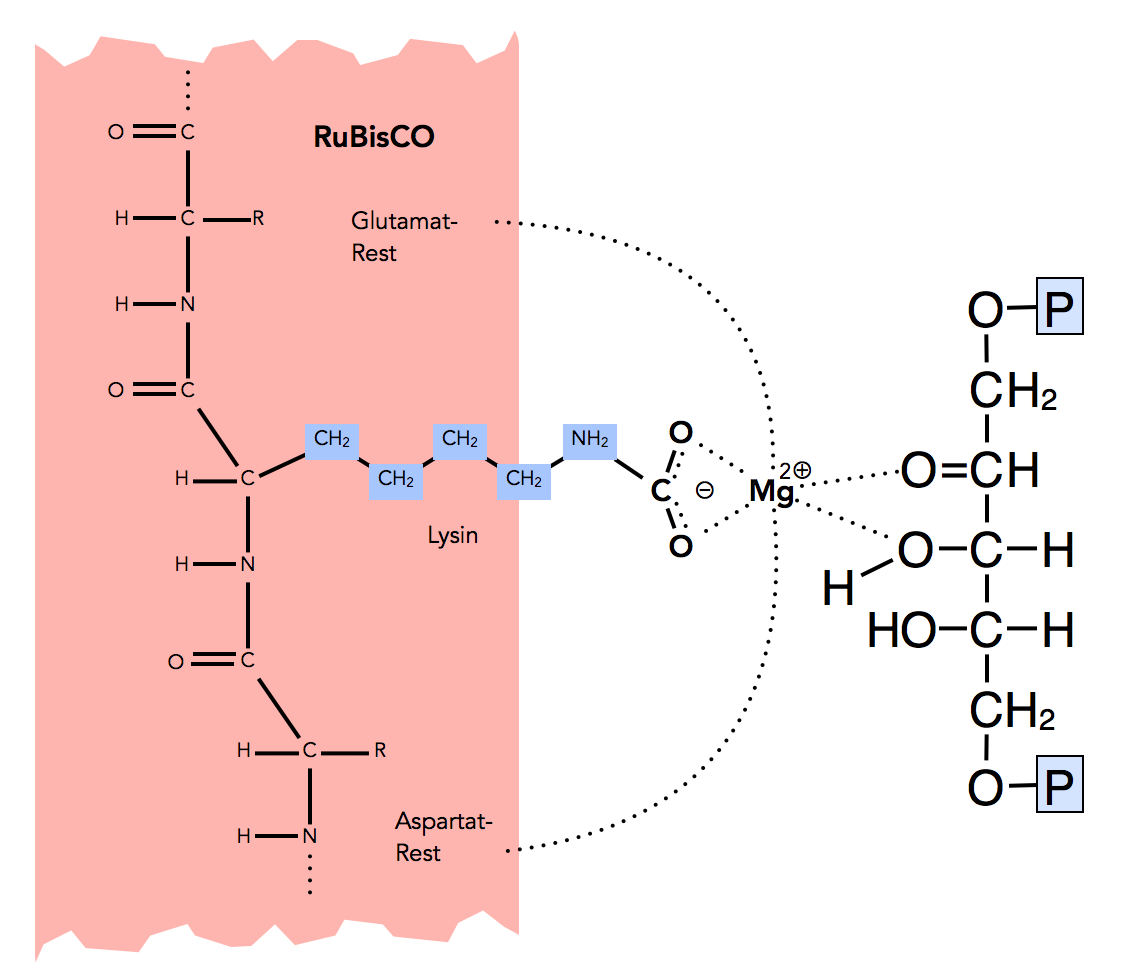
Ribulose-1,5-bisphosphat bindet an RuBisCO
Autor: Ulrich Helmich, Lizenz: Public domain
Das Magnesium-Ion wird nicht nur durch den Lysin-COO--Rest gebunden, sondern auch noch durch zwei weitere negativ geladene Seitenketten der RuBisCO, nämlich durch einen Glutamat-Rest (Glutaminsäure) und durch einen Aspartat-Rest (Asparaginsäure). Das Substrat Ribulose-1,5-bisphosphat bindet sich mit zwei seiner elektronegativen O-Atome an das Magnesium-Ion.
So, mit der Regulation der RuBisCO sind wir aber noch nicht fertig, sorry! Es gibt ein anderes Enzym, das die Aktivität der RuBisCo positiv beeinflusst, nämlich RuBisCO-Aktivase.
Es ist nämlich so, dass sich das Substrat Ribulose-1,5-bisphosphat in das aktive Zentrum der RuBisCO setzen kann, wenn noch kein CO2-Molekül im aktiven Zentrum sitzt. Das Enzym wird dadurch blockiert und inaktiviert, es kann kein CO2 mehr aufnehmen. Die RuBisCO-Aktivase kann dieses "fehlgeleitete" Substrat wieder aus dem aktiven Zentrum entfernen, benötigt dazu aber Energie in Form von ATP [4]. Diese Energie ist erforderlich, weil die RuBisCO-Aktivase das aktive Zentrum der RuBisCO ziemlich stark "verbiegen" muss, damit das Ribulose-1,5-bisphosphat wieder freigesetzt werden kann [3].
"Mit der aus der Hydrolsye von ATP stammenden Energie wird der C-Terminus vorübergehend in die zentrale Pore der Aktivase gezogen." [3]
Durch diesen Vorgang wird die RuBisCO wieder in einen für CO2 aufnahmebereiten Zustand versetzt.
Quellen:
- Allgemeines Schulbuchwissen
- Michael Gross: "Photosynthese mit Turbolader" in Spektrum der Wissenschaft 02/2015, S. 17ff
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Kadereit , Körner, Nick, Sonnewald: Strasburger - Lehrbuch der Pflanzenwissenschaften, 38. Auflage, Springer Berlin Heidelberg 2021.