Chlor-Atome, Teil 1
Betrachten wir zunächst ein Chlor-Atom:
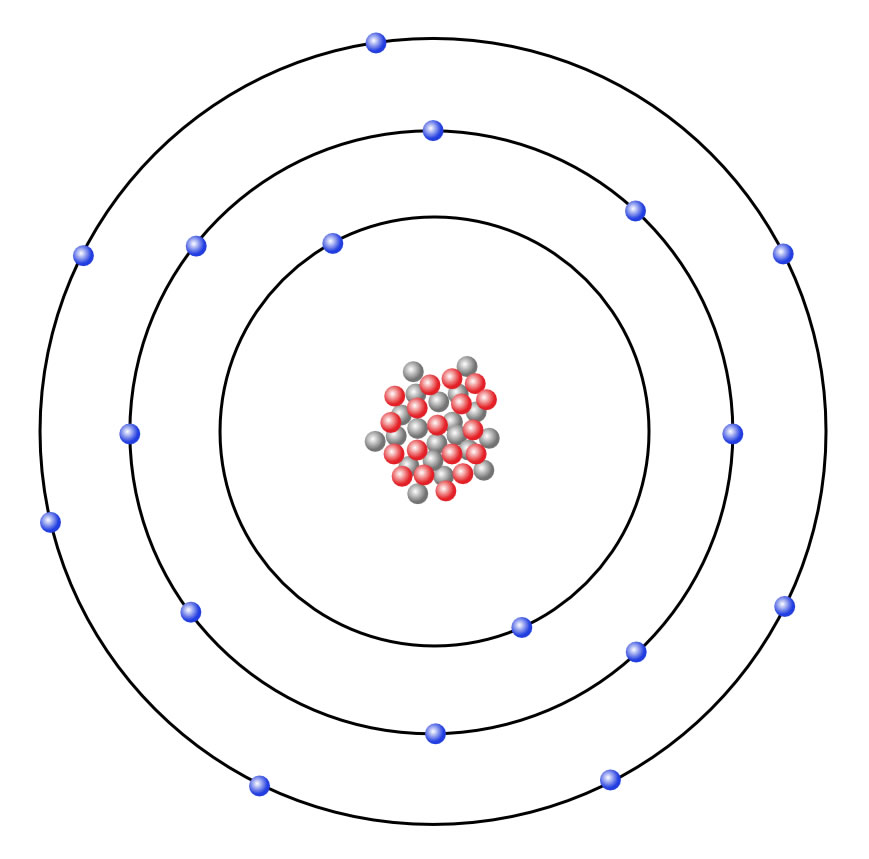
Ein Chlor-Atom nach dem Schalenmodell
Nach dem Schalenmodell besteht ein Chlor-Atom aus dem Atomkern mit 17 Protonen und 18 Neutronen sowie 17 Elektronen, die auf drei Schalen verteilt sind. In der innnersten Schale, der K-Schale, befinden sich 2 Elektronen, auf der nächsten Schale, der L-Schale, 8 Elektronen und auf der Außenschale, der M-Schale, noch einmal 7 Elektronen. Zusammen also 17 Elektronen. Da die Zahl der Protonen ebenfalls 17 beträgt, ist das Chlor-Atom nach außen hin elektrisch neutral.
Chlor ist ein extrem reaktives Element, das haben wir bei dem Versuch auf der letzten Seite ja gerade gesehen. Aber warum ist das Chlor derart reaktiv?
Edelgase
Ein eng mit dem Chlor verwandtes Element ist das Argon. Atome des Elementes Argon haben nur ein Proton und ein Elektron mehr als Atome des Elementes Chlor. Das ist ja eigentlich nur ein sehr winziger Unterschied. Trotzdem hat das Argon völlig andere Eigenschaften als das Chlor, es ist nämlich ein Edelgas.
Edelgase heißen so, weil sie überhaupt keine chemischen Reaktionen eingehen. Es besteht nämlich keine Notwendigkeit, für ein Edelgas-Atom, eine Reaktion einzugehen. Edelgas-Atome haben alle eine voll besetzte Außenschale. Helium hat die Elektronenkonfiguration K2, Neon die Konfiguration K2 L8 und Argon die Konfiguration K2 L8 M8. Immer ist die jeweilige Außenschale voll mit Elektronen besetzt.
Und die Tatsache, dass die Edelgase "edel" sind, also keine chemischen Reaktionen eingehen, lässt sich eindeutig auf dieses Phänomen zurückführen. Offensichtlich ist der Zustand "Außenschale von besetzt" super günstig für ein Atom. In der Tat bezeichnet man diesen Zustand dann auch als Edelgaszustand.
Edelgaszustand
Eine Elektronenkonfiguration, bei der die Außenschale mit Elektronen voll besetzt ist, bezeichnet man als Edelgaszustand. Dieser Zustand ist energetisch extrem stabil.
Chlor-Atome, Teil 2
Ein Edelgaszustand ist energetisch so stabil, dass er für andere Elemente auch erstrebenswert ist. Schauen wir uns das am Beispiel Chlor an.
Chlor-Atome haben bereits sieben Außenelektronen. Wenn das Chlor-Atom jetzt noch ein weiteres Elektron aufnehmen würde, hätte es eine voll besetzte Außenschale und würde damit einem Edelgas gleichen, und zwar dem Edelgas Argon.
- Elektronenkonfiguration von Chlor: K2 L8 M7
- Elektronenkonfiguration von Chlor mit einem zusätzlichen Elektron: K2 L8 M8
- Elektronenkonfiguration von Argon: K2 L8 M8
Durch Aufnahme eines Elektrons erhält Chlor also den Edelgaszustand. Allerdings werden die Chlor-Atome Cl durch dieses zusätzliche Elektron zu negativ geladenen Chlorid-Ionen Cl-.
Obwohl das Chlorid-Ion hat die gleiche Elektronenkonfiguration hat wie das Argon-Atom, ist es im Atomkern immer noch einChlor-Teilchen, denn die Protonenzahl von 17 hat sich ja nicht verändert.
Nachdem diese wichtige Frage geklärt ist, bleibt noch ein kleines Problem:
Woher bekommt das Chlor-Atom das fehlende Elektron, um zum Chlorid-Ion zu werden?
Für ein Chlor-Atom ist es äußerst erstrebenswert, ein 18. Elektron aufzunehmen, weil es dann eine Edelgaskonfiguration hat. Aber woher kommt dieses Elektron eigentlich, wer "spendet" es? Gibt es irgend einen Elektronen-Spender in der Nähe, der bereit ist, ein Elektron freiwillig abzugeben? Schauen wir uns dazu einmal ein Natrium-Atom näher an.
Natrium-Atome
Betrachten wir ein Natrium-Atom, wie es sich nach dem Schalenmodell darstellt:
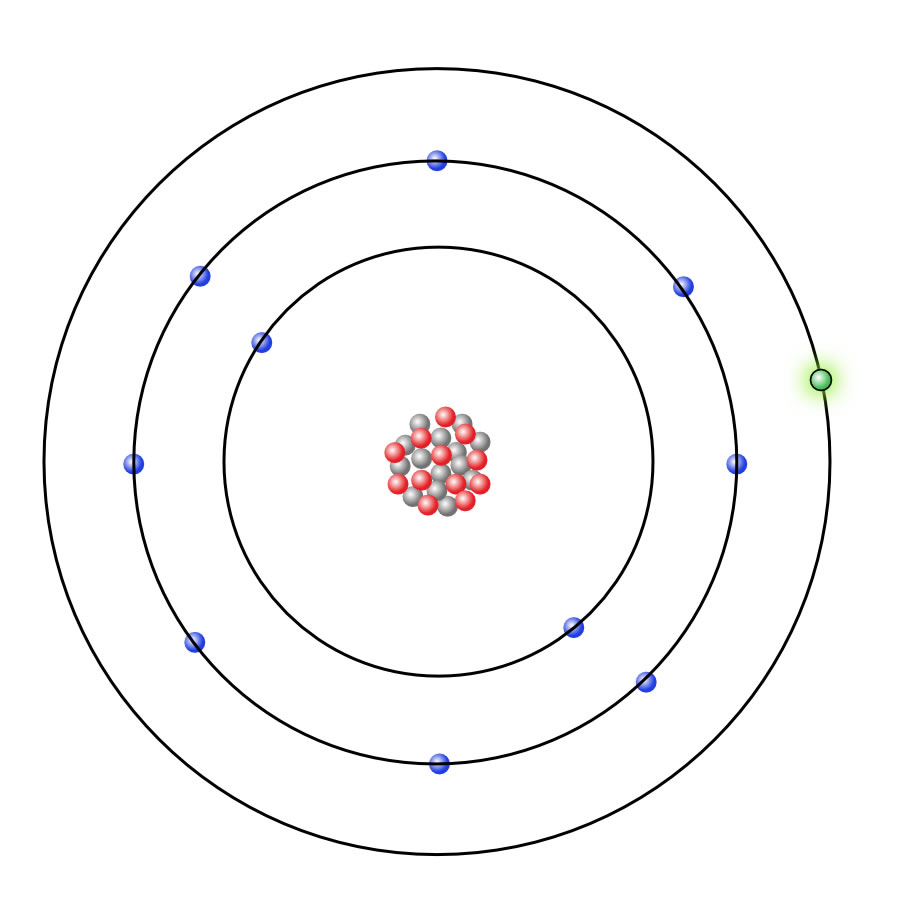
Ein Natrium-Atom nach dem Schalenmodell
Natrium-Atome haben nur ein einziges Elektron auf der Außenschale (auf der Abbildung grün hervorgehoben). Der erste logische Gedanke wäre jetzt: Wenn das Natrium einen Edelgaszustand erreichen will, muss es sieben weitere Elektronen aufnehmen. Dann hätte es den gleichen Zustand wie das Argon-Atom. Allerdings wäre es dann auch siebenfach negativ geladen. So etwas gibt es in der Chemie aber nicht. Schon dann, wenn ein Ion zwei- oder dreifach negativ geladen ist, ist es sehr schwer, noch eine weitere negative Ladung aufzunehmen, denn gleichnamige Ladungen stoßen sich bekanntlich ab. Aber ein sechsfach negativ geladenes Ion kann unmöglich noch eine negative Ladung aufnehmen.
Gibt es nicht einen einfacheren Weg? Wir denken jetzt mal ganz radikal:
Was wäre denn, wenn das Natrium sein einziges Außenelektron abgibt?
Wenn ein Na-Atom das einzige Außenelektron abgibt, "verschwindet" die äußere M-Schale, und die darunter liegende L-Schale wird jetzt zur Außenschale. Diese L-Schale ist mit acht Elektronen besetzt, die aber zu Außenelektronen werden, wenn die M-Schale verschwunden ist. Dann hat das positiv geladene Natrium-Ion aber plötzlich die gleiche Elektronenkonfiguration wie das EdelgasNeon.
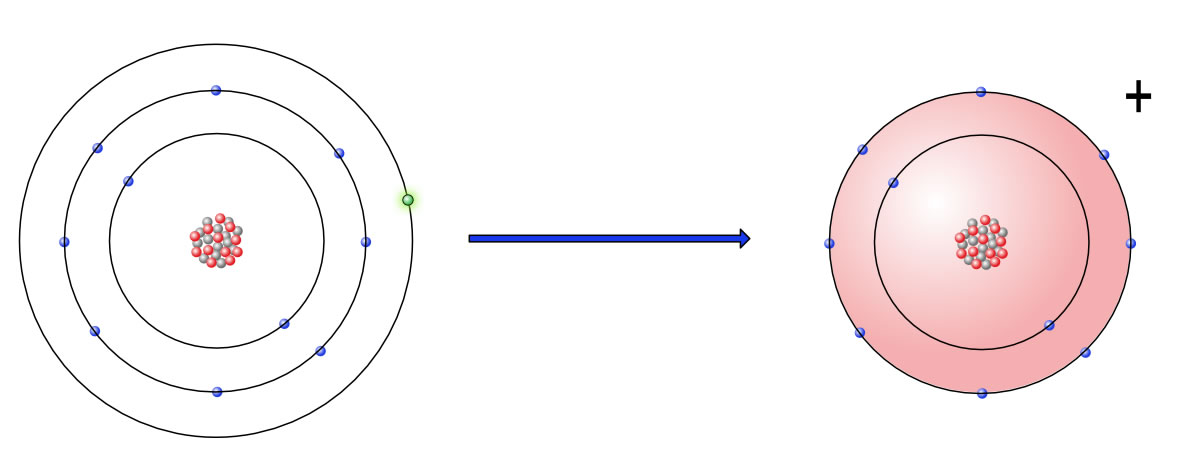
Ein Natrium-Atom gibt ein Elektron ab und erlangt so die gleiche Elektronenkonfiguration wie das Edelgas Neon
Hier haben wir also unseren Elektronen-Donator("Donator" = "Spender"), der bereitwillig ein Elektron abgibt.
Die Reaktion zwischen Natrium und Chlor
Fassen wir noch einmal zusammen:
- Das Chlor-Atom hat sieben Außenelektronen. Durch Aufnahme eines zusätzlichen Elektrons würde das Chlor-Atom den Edelgaszustand des Argons annehmen. Das Problem ist aber: woher soll dieses Elektron kommen?
- Das Natrium-Atom hat nur ein Außenelektron. Wenn es dieses abgibt, kommt es in den Edelgaszustand des Neons. Das Problem ist aber: wer soll dem Natrium dieses überschüssige Elektron abnehmen?
Im Grund haben wir jetzt den Versuch von der letzten Seite - Reaktion von Natrium mit Chlor - vollständig erklärt. Natrium-Atome und Chlor-Atome wollen das selbe: In den Edelgaszustand zu gelangen. Die Natrium-Atome geben dazu das einzige Außenelektron ab, und die Chlor-Atome nehmen dieses auf.
Auf der nächsten Seite machen wir weiter mit diesem spannenden Thema und fragen uns, wie es eigentlich zur Bildung von festen Kochsalzkristallen kommt.
Seitenanfang -
Versuch -
Erste Deutung -
Ionenbindung -
Energieaspekte -
Schmelzpunkte -
Kristallstrukturen