Die Bildung von NaCl noch näher betrachtet
Den Versuch "Reaktion von Natrium mit Chlor" haben wir auf den letzten Seiten ausführlich besprochen, dabei haben wir auch das Konzept der Ionenbindunge kennen gelernt. Natrium-Atome geben je ein Außenelektron ab, Chlorid-Atome nehmen dieses Elektron in ihre Außenschale auf, es entstehen positive Natrium-Ionen und negative Chlorid-Ionen, die sich gegenseitig anziehen und einen festen NaCl-Kristall bilden.
Auf dieser Spezialseite wollen wir die einzelnen Reaktionsschritte noch etwas näher betrachten als auf den letzten Seiten. Vor allem wollen wir uns mit Energiebetrachtungen beschäftigen. Wenn ein Natrium-Atom sein Außenelektron abgibt, tut es das, weil der Edelgaszustand energetisch günstiger ist. Das heißt, die Reaktion
$Na\to Na^{+} + e^{-} $
ist exotherm, das Endprodukt hat eine niedrigere "innere Energie" als der Ausgangsstoff. Analog ist es bei der Reaktion
$Cl + e^{-}\to Cl^{-} $
Auch diese Reaktion ist exotherm, weil das Chlorid-Ion eine Edelgaskonfiguration hat und somit energetisch günstiger ist als das Chlorid-Atom.
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Die Ionisierung des Natriums
Sublimation des festen Natriums
Als Ausgangsstoff bei dem Versuch hatten wir festes Natrium eingesetzt. Mit dem Brenner haben wir das Reagenzglas erhitzt und das Natrium zum Schmelzen gebracht. Ein Teil des Natriums ist allerdings auch in den Gaszustand übergegangen:
$Na_{(s)}\to Na_{(g)} \ \ \ \Delta H = 109 kJ/mol$
Diese Reaktion, die sogenannte Sublimierung des Natriums, ist endotherm und kostet 109 kJ/mol an Sublimationsenergie.
Warum ist diese Reaktion endotherm? Na klar, zwischen den Natrium-Atomen des festen Natriums herrschen recht starke Anziehungskräfte. Beim Schmelzen und erst recht beim Verdampfen müssen diese Anziehungskräfte überwunden werden. Eben dafür wird die Sublimationsenergie benötigt.
Ionisierung des sublimierten Natriums
Der nächste Schritt sollte eigentlich exotherm sein. Die Natrium-Atome geben ihre Außenelektronen ab und gelangen dadurch in den energetisch günstigeren Edelgaszustand:
$Na_{(g)}\to Na^{+}_{(g)} + e^{-} \ \ \ \Delta H = 502 kJ/mol$
Was ist das denn? Die Reaktion ist nicht nur nicht exotherm, sondern endotherm, und nicht nur ein bisschen endotherm, sondern sogar ziemlich stark endotherm. Wie kann das denn sein? Wurde auf den vorherigen Seiten nicht immer behauptet, der Edelgaszustand sei "energetisch günstiger" als der normale Zustand? Irgendwie ist diese Behauptung etwas voreilig gewesen. Aber warten wir es ab, wir sind ja noch lange nicht am Ende der Betrachtungen. Als Nächstes wenden wir und dem Chlor zu.
Die Ionisierung des Chlors
Das Chlor liegt bei dem Versuch bereits im gasförmigen Zustand vor, eine Sublimierung wie beim Natrium ist also nicht erforderlich. Aber es gibt ein anderes Problem. Gasförmiges Chlor, so wie wir es kennen, enthält als kleinste Teilchen keine Chlor-Atome, sondern Chlor-Moleküle. Ein Chlor-Molekül ist immer aus zwei Chlor-Atomen zusammengesetzt, daher schreibt man es auch als Cl2. Der erste Schritt bei der Ionisierung von Chlor ist also die Spaltung von Chlor-Molekülen in Chlor-Atome.
Dissoziation des Chlors
$Cl_{2(g)} \to 2 \ \ Cl_{(g)}\ \ \ \Delta H = 242 kJ/mol$
Jetzt haben wir schon wieder eine endotherme Reaktion! Wieso läuft dann der Versuch überhaupt exotherm ab? Wir haben doch gesehen, dass Natrium und Chlor heftig reagieren, aber die ersten drei Teilschritte sind alle endotherm.
Dass die Dissoziation (= Spaltung) des Chlor-Moleküls endotherm ist, kann nicht verwundern. Es muss ja eine chemische Bindung gespalten werden, nämlich die Bindung zwischen den beiden Chlor-Atomen. Und die Spaltung einer Bindung kostet immer ziemlich viel Energie.
Elektronenaufnahme des Chlors
Der nächste Schritt ist die Aufnahme eines Elektrons durch die Chlor-Atome. Chlor-Atome gehen dadurch in den Edelgaszustand über. Man würde jetzt wieder erwarten, dass dieser Vorgang exotherm ist, weil der Edelgaszustand ja "energetisch günstiger" ist. Allerdings haben wir beim Natrium gerade erlebt, dass das nicht der Fall ist, im Gegenteil, die Ionisierung des Natriums war ja sogar ziemlich endotherm. Betrachten wir also die Reaktion näher:
$Cl_{(g)} + e^{-} \to Cl_{(g)}^{-} \ \ \ \Delta H = -363 kJ/mol$
Na endlich mal eine exotherme Reaktion! So wie eigentlich erwartet.
Kurze Rückbesinnung
Ist es wirklich so unerwartet, dass die Ionisierung des Natriums endotherm verläuft? Wenn wir uns an das erinnern, was wir beim Thema Schalenmodell gelernt haben, erscheint das gar nicht mehr so abwegig. Wenn wir einem Atom ein Elektron entreißen wollen, kostet das immer Energie. Das Elektron wird vom positiven Atomkern angezogen, und diese Anziehungskraft muss überwunden werden. Diese Energie hatten wir als Ionisierungsenergie kennen gelernt.
Natrium-Atome würden also freiwillig kein Außenelektron abgeben, obwohl sie ja den Edelgaszustand dadurch erreichen könnten. Aber neben dem Erreichen des Edelgaszustandes gibt es in der Chemie viele andere Faktoren, die den Verlauf chemischer Reaktionen beeinflussen. Das werden wir gleich sehen.
Zwischenbilanz
Fassen wir die bisher besprochenen Schritte einmal zu einer Zwischenbilanz zusammen.
Die Sublimierung von Natrium kostet +109 kJ/mol.
Die Ionisierung von sublimiertem Natrium kostet +502 kJ/mol.
Die Spaltung eines Chlor-Moleküls kostet +242 kJ/mol, allerdings benötigen wir für die Reaktion nur ein halbes Chlor-Molekül, da ja nur ein Chlor-Atom pro Natrium-Atom benötigt wird. Also können wir von den +242 kJ/mol nur die Hälfte rechnen:+ 121 kJ/mol.
Die Elektronenaufnahme des Chlors bringt einen Energiegewinn von -363 kJ/mol.
Addieren wir die Beträge zusammen, so kommen wir auf +369 kJ/mol, die vier Schritte sind also zusammen gesehen ziemlich endotherm. Aber der Versuch IST doch exotherm, wo kommt dann die viele Reaktionsenergie her, die wir "gesehen" haben?
Die Bildung des NaCl-Kristalls
Wir sind ja noch nicht ganz am Ende mit unseren Betrachtungen. Bisher haben wir Natrium- und Chlor-Atome in positive bzw. negative Ionen verwandelt, die allerdings noch in der Gasphase vorliegen. Der letzte Schritt ist die Bildung des festen Natriumchlorids, es bildet sich ein regelmäßig aufgebautes Ionengitter.
Jedes Natrium-Ion zieht dabei sechs Chlorid-Ionen an. Wenn die Spaltung einer Bindung viel Energie kostet, wie wird ja schon gesehen haben, dann muss die Bildung einer neuen Bindung entsprechend viel Energie freisetzen. Und jedes Natrium-Ion bildet sechs neue Bindungen zu Chlorid-Ionen aus. Gleichzeitig entstehen sechs weitere neue Bindungen, wenn sich jedes Chlorid-Ion mit sechs Natrium-Ionen umgibt.
$Na^{+}_{(g)} + Cl_{(g)}^{-} \to NaCl_{(s)} \ \ \ \ \Delta H = -780 kJ/mol$
Da haben wir es! Bei der Bildung des Kristallgitters wird so viel Gitterenergie frei, dass die Gesamtreaktion locker exotherm sein kann.
Wir haben in den ersten vier Schritten 369 kJ/mol in die Reaktion hineingesteckt, bekommen aber bei der Gitterbildung 780 kJ/mol heraus. Insgesamt werden also bei der Reaktion -411 kJ/mol frei. Wir können daher schreiben:
$Na_{(s)} + \frac{1}{2}Cl_{2(g)} \to NaCl_{(s)} \ \ \ \ \Delta H = --411 kJ/mol$
Zusammenfassung
Fassen wir jetzt alle Reaktionsschritte noch einmal graphisch in einem Diagramm zusammen:
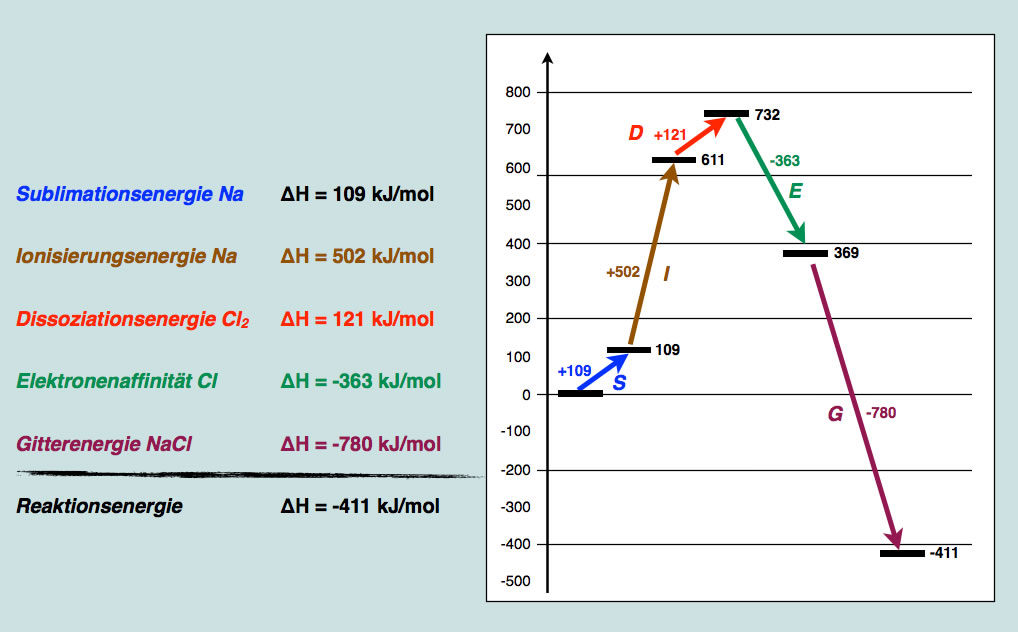
Energieaspekte bei der Reaktion zwischen Natrium und Chlor
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz. Autor: Ulrich HelmichHier sind die einzelnen Schritte noch einmal zu sehen. Die "innere Energie" der beiden Ausgangsstoffe Na(s) und Cl2(g) wurden willkürlich auf den Wert 0 gesetzt. Durch die Sublimation des Natriums steigt diese Energie auf +109 kJ/mol, durch die Ionisierung des Natriums auf 611 kJ/mol und durch die Dissoziation des Chlors auf 732 kJ/mol. Die Aufnahme eines Elektrons durch Chlor ist exotherm, da hierbei 363 kJ/mol frei werden, sinkt die "innere Energie" auf 369 kJ/mol. Den größten Beitrag schließlich liefert die Bildung des Kristallgitters. Die Gitterenergie des NaCl beträgt -780 kJ/mol, und die "innere Energie" der beteiligten Stoffe sinkt auf einen Wert von -411 kJ/mol.
Bei der gesamten Reaktion zwischen festem Natrium und gasförmigem Chlor werden also 411 kJ/mol freigesetzt, damit ist die Reaktion stark exotherm.
Seitenanfang -
Versuch -
Erste Deutung -
Ionenbindung -
Energieaspekte -
Schmelzpunkte -
Kristallstrukturen