Beispiel Natriumchlorid
Das Zustandekommen einer Ionenbindung hatten wir schon auf der vorherigen Seite kurz angerissen. Schauen wir uns die Ionenbindung am Schulbuch-Beispiel Natriumchlorid noch einmal näher an. Diesmal benutzen wir dazu das Kugelwolkenmodell:
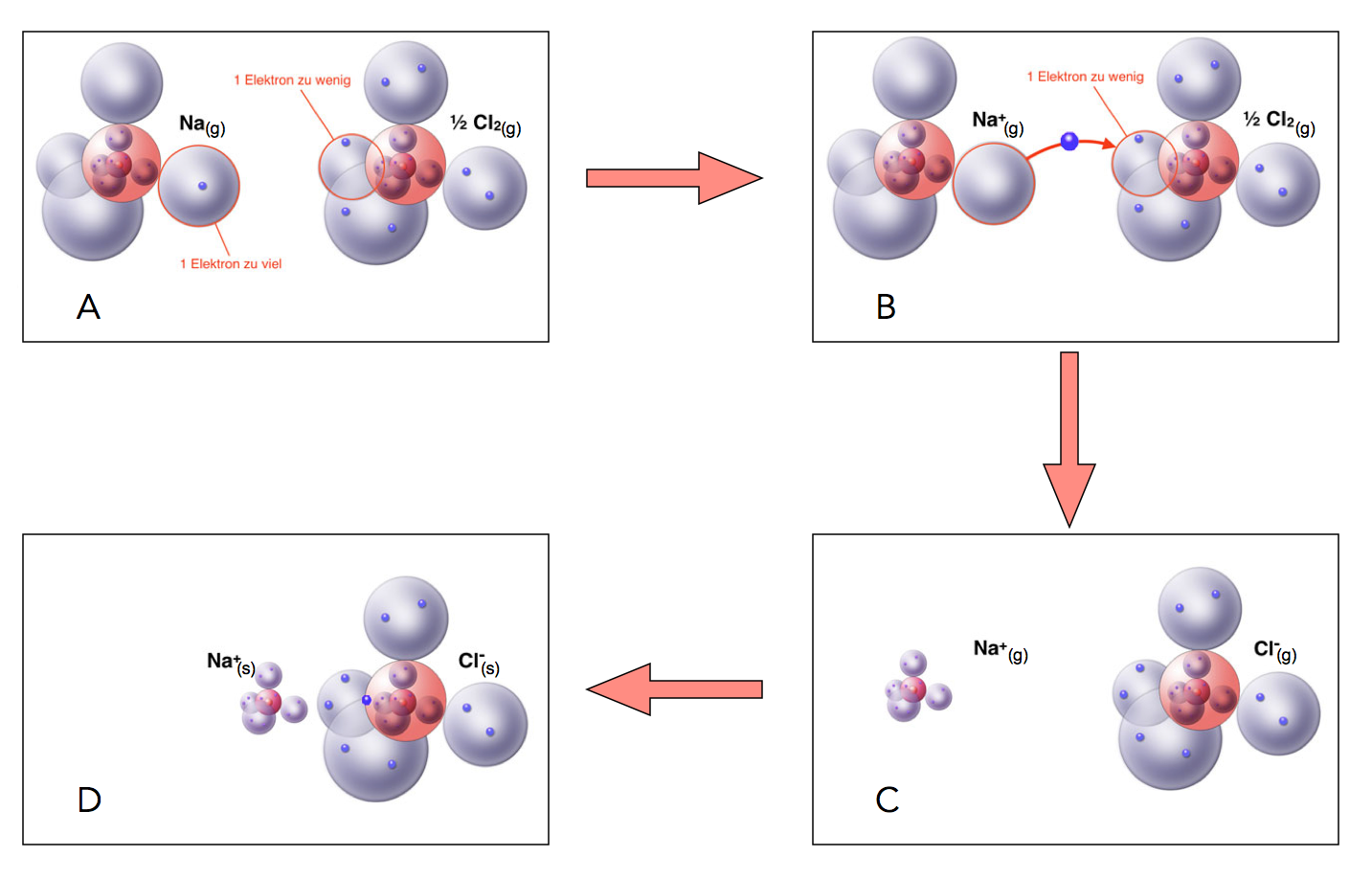
Natrium hat ein Elektron zu viel, Chlor eins zu wenig
Autor: Ulrich Helmich, Lizenz: Public domain
A) Das Natrium-Atom Na(g) hat ein Elektron zu viel, das Chlor-Atom Cl(g) ein Elektron zu wenig.
B) Elektronenübertragung vom Natrium-Atom zu Chlor-Atom.
C) Beide Atome haben den Edelgaszustand erreicht. Das Natrium ist jetzt positiv geladen, das Chlor negativ.
D) Die Natrium-Kationen und die Chlorid-Anionen ziehen sich gegenseitig stark an = Ionenbindung.
Als Zwischenprodukt der Reaktion zwischen Natrium und Chlor entstehen zunächst die gasförmigen Ionen (C), die sich dann zum festen Natriumchlorid-Kristall vereinigen (D). Die elektrostatische chemische Bindung zwischen den entgegengesetzt geladenen Ionen bezeichnet man auch einfach als Ionenbindung. Die Ionenbindung ist eine sehr starke intramolekulare chemische Bindung, vergleichbar mit der Elektronenpaarbindung oder der Metallbindung und wesentlich stärker als etwa die intermolekularen van-der-Waals-Kräfte.
Die Ionenbindung
Eine Ionenbindung zwischen zwei Atomen kommt zustande, wenn ein Atom A nur wenige Elektronen abgeben muss, um den nächsten Edelgaszustand zu erreichen, und wenn ein anderes Atom B nur wenige Elektronen aufnehmen muss, um dasselbe zu erreichen.
In diesem Falle wirkt A als Elektronen-Donator und gibt seine Elektronen an B ab, das als Elektronen-Akzeptor wirkt. Dabei entstehen positive A-Kationen und negative B-Anionen, die sich gegenseitig anziehen.
Energiebetrachtungen bei der NaCl-Bildung
Wir wollen die Bildung von Kochsalz aus den Elementen Natrium und Chlor in die einzelnen Reaktionsschritte zerlegen und für jeden einzelnen Schritt den Energieumsatz betrachten. Überlegen wir zunächst, wie die beiden Ausgangsstoffe vorliegen. Das Natrium liegt als Feststoff vor, das Chlor als Gas.
Sublimation des Na(s)
Damit festes Natrium mit Chlor reagieren kann, muss es zunächst einmal sublimiert (verdampft) werden. Die dazu benötigte Energie wird als Sublimationsenergie bezeichnet. Die Sublimation ist eine endotherme Reaktion, die Reaktionsenthalpie hierfür beträgt +107 kJ/mol. Die Reaktion ist endotherm, weil die Anziehungskräfte zwischen den Natrium-Atomen Na(s) überwunden werden müssen.
Ionisierung des Na(g)
Die durch die Sublimation entstandenen gasförmigen Natrium-Atome Na(g) müssen dann ihr Außenelektron abgeben. Diesen Vorgang bezeichnet man als Ionisierung. Auch dieser Vorgang ist endotherm, da ja die Anziehungskräfte zwischen dem Außenelektron und dem "inneren Atom" (= Atomkern + innere Elektronen) überwunden werden müssen. Die Ionisierungsenergie beträgt hier +502 kJ/mol.
Dissoziation von Cl2
Das Chlor liegt bereits in gasförmigem Zustand vor, daher ist eine Sublimation nicht notwendig. Allerdings bestehen Chlor-Moleküle aus zwei Chlor-Atomen: Cl2(g). Diese beiden Atome müssen voneinander getrennt werden, eine solche Trennung bezeichnet man als Dissoziation. Dazu müssen die starken Anziehungskräfte, die zwischen den beiden Atomen herrschen, überwunden werden. Die Bindungsdissoziationsenergie beträgt +242 kJ für ein Chlor-Molekül. Da wir nur ein halbes Chlor-Molekül benötigen, rechnen wir auch nur +121 kJ für die Bildung einer NaCl-Einheit an.
Wir haben bisher genau 107 + 502 + 121 = 730 kJ/mol an Energie in die Reaktion "hineingesteckt". Wir wissen aber aus Erfahrung, dass die Reaktion von Natrium und Chlor zu festem Natriumchlorid ziemlich exotherm ist. Also werden die restlichen Reaktionsschritte wohl sehr viel Energie liefern müssen, auf jeden Fall deutlich mehr als die bisherigen 730 kJ/mol.
Ionisierung von Cl(g)
Die gasförmigen Chlor-Atome Cl(g) müssen ein Elektron aufnehmen, um ihre Außenschale zu vervollständigen. Wenn das Elektron in die Elektronenhülle eintritt, entstehen neue Anziehungskräfte, denn das neue Elektron wird ja vom Atomkern angezogen. Daher ist dieser Schritt exotherm. Die dabei freigesetzte Energie wird als Elektronenaffinität bezeichnet, und die beträgt für ein Chlor-Atom -355 kJ/mol. Das Minuszeichen zeigt uns, dass die Energie freigesetzt wird; der Teilschritt ist exotherm.
Damit haben wir einen Teil der 730 kJ/mol, die wir anfangs in die Reaktion "hineinstecken" mussten, zurück gewonnen. Die Bilanz beläuft sich aber immer noch auf +375 kJ/mol, das heißt, die Gesamtreaktion ist immer noch nicht exotherm, sondern endotherm. Also muss wohl noch ein Schritt kommen, der mindestens 375 kJ/mol freisetzt, wahrscheinlich aber noch mehr, denn wie wir wissen, ist die Gesamtreaktion ziemlich exotherm und nicht nur ein bisschen.
Bildung des Kristallgitters
Die gasförmigen Na+(g)-Ionen ziehen viele Cl-(g)-Ionen an und umgekehrt. Es bildet sich ein Ionengitter. Und bei diesem Schritt wird in der Tat sehr viel Energie pro Mol freigesetzt, nämlich 788 kJ. Die Gitterenergie, so heißt dieser Energiebetrag, beläuft sich also auf -788 kJ/mol.
Wenn wir diesen Betrag von der bisherigen Zwischensumme (+375 kJ/mol) abziehen, so kommen wir auf ein Endergebnis von -413 kJ/mol. Dies ist dann die Reaktionsenthalpie der Gesamtreaktion, bei der aus festem Natrium und gasförmigem Chlor das feste NaCl entsteht.
Energiediagramm
Malen wir uns das Ganze einmal in Form eines Energiediagramms auf:
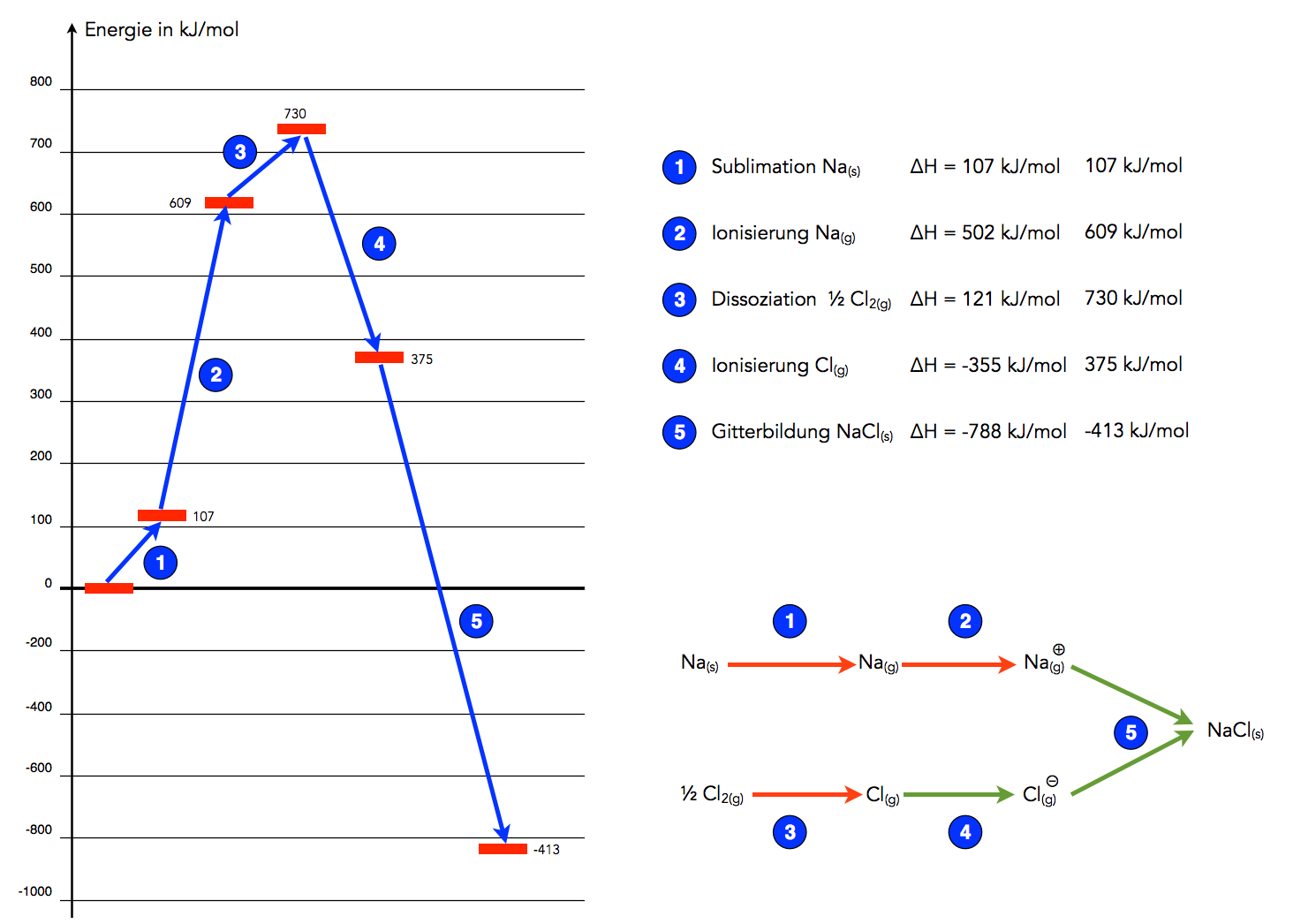
Energiediagramm der Bildung von Natriumchlorid
Autor: Ulrich Helmich, Lizenz: Public domain
Das Ganze sieht jetzt doch sehr übersichtlich aus. Links sehen wir das Energiediagramm, rechts oben sind die einzelnen Schritte noch einmal aufgelistet, und rechts unten sehen wir eine Art Reaktionsschema. Die roten Pfeile stehen für endotherme Schritte, die grünen für exotherme Schritte.
Anwendung: Schmelztemperaturen von Salzen

Die Schmelztemperaturen verschiedener Salze
Autor: Ulrich Helmich, Lizenz: Public domain
Betrachten wir nun die neue Abbildung. Sie zeigt die Schmelztemperaturen verschiedener Salze. Links haben wir die Natriumhalogenide NaF, NaCl, NaBr und NaI, weiter rechts einige Erdalkalioxide, nämlich MgO, CaO, SrO und BaO.
Welche Zusammenhänge kann man in diesem Diagramm entdecken?
Zunächst einmal kann man sagen, dass die Schmelzpunkte der Natriumhalogenide grundsätzlich viel niedriger sind als die der Erdalkalioxide. Die Natriumhalogenide schmelzen in Bereichen um 750 ºC, während die Schmelzpunkte der Erdalkalioxide im Bereich über 2000 ºC liegen.
Weiterhin fällt auf, dass innerhalb der Natriumhalogenide die Schmelzpunkte abnehmen, je "tiefer" das Halogen im Periodensystem steht. Natriumfluorid hat einen relativ hohen Schmelzpunkt (993 ºC), während das Natriumiodid bereits bei 661 ºC schmilzt.
Das Gleiche kann man bei den Erdalkalioxiden feststellen. Das MgO hat einen sehr hohen Schmelzpunkt von 2800 ºC, das BaO schmilzt schon bei "nur" 1920 ºC.
Wie kann man die niedrigen Schmelzpunkte der Natriumhalogenide erklären?
Dazu muss man sich klarmachen, von welchen Faktoren der Schmelzpunkt eines Salzes eigentlich abhängt. Beim Schmelzen müssen ja die Anziehungskräfte, die innerhalb des Kristallgitters herrschen, überwunden werden. Die Kraft, mit der sich zwei entgegengesetzt geladene Ionen wie Na+ und Cl- anziehen, hängt im Wesentlichen von zwei Faktoren ab:
- Abstand zwischen den beiden Ionen
- Ladung der beiden Ionen
Je größer der Abstand zwischen den beiden Ionen, desto geringer die Anziehungskraft. Die Anziehungskraft nimmt dabei mit dem Quadrat des Abstandes ab: Doppelter Abstand = ein Viertel Anziehungskraft, dreifacher Abstand = ein Neuntel Anziehungskraft und so weiter.
Umgekehrt nimmt die Anziehungskraft mit der Ladung der Ionen linear zu. Doppelte Ladung = doppelte Anziehungskraft, vierfache Ladung = vierfache Anziehungskraft.
Diese hier genannten Zusammenhänge kann man mit der einfachen Formel
$F = k \cdot\frac{q_{1} \cdot q_{2}}{r^{2}}$
ausdrücken.
Falls der Browser die Formel nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Wenden wir diese Erkenntnisse nun auf die Schmelzpunkte der Salze an. Die Alkalihalogenide haben recht geringe Schmelzpunkte, weil ihre Ionen nur einfach positiv bzw. negativ geladen sind. Die Erdalkalioxide haben viel höhere Schmelzpunkte, denn ihre Ionen sind zweifach positiv bzw. zweifach negativ geladen. Die Anziehungskräfte sollten also ca. viermal so groß sein wie bei den Alkalihalogeniden.
Warum sinken nun die Schmelzpunkte der Halogenide bzw. Oxide, wenn man im Periodensystem von oben nach unten geht?
Hier spielt der Faktor "Abstand zwischen den Ionen" eine wichtige Rolle. Der Radius von Chlorid-Ionen ist größer als der von Fluorid-Ionen. Bromid-Ionen sind noch größer als Chlorid-Ionen, und Iodid-Ionen sind noch deutlich größer als Bromid-Ionen. Die Abstände zwischen den Ionen werden also vom NaF zum NaI immer größer, entsprechend sinken die Anziehungskräfte und damit auch die Schmelzpunkte.
Ähnliches kann man bei den Erdalkalioxiden beobachten, nur verändert sich hier nicht die Größe der Anionen, sondern die Größe der Kationen. Magnesium-Ionen sind sehr klein, Barium-Ionen sehr groß, darum hat BaO einen niedrigeren Schmelzpunkt als MgO.
Ionenbindung für Biologen
In der Biologie spielen Ionenbindungen eine wichtige Rolle, vor allem, wenn es um die Tertiärstruktur von Proteinen geht. In Proteinen kommen Aminosäuren mit positiv geladenen Seitenketten und Aminosäuren mit negativ geladenen Seitenketten vor. Diese unterschiedlich geladenen Seitenketten können sich gegenseitig anziehen und damit die Tertiärstruktur des Proteins stabilisieren.
Diese Ionenbindungen in biologischen Systemen werden oft zu den schwachen chemischen Bindungen gezählt, obwohl wir doch gerade gesehen haben, dass Ionenbindungen ziemlich starke chemische Bindungen sind, vergleichbar vielleicht mit kovalenten Bindungen.
Biologische Systeme liegen aber immer in einer wässrigen Lösung vor - sei es das Cytoplasma, das Plasma irgendeines Organells oder das extrazelluläre Medium. Wasser-Moleküle sind Dipole, und Dipole setzen sich an positiv oder negativ geladene Seitenketten von Aminosäuren. Sie schirmen dann die Ladungen ab und verringern so die Anziehungskraft zwischen einer positiv und einer negativ geladenen Seitenkette erheblich. Daher werden die Ionenbindungen in Proteinen und anderen Molekülen in der Biologie als "schwache chemische Bindungen" bezeichnet, vergleichbar etwa mit Wasserstoffbrücken-Bindungen.
Seitenanfang -
Weiter mit der
Elektronenpaarbindung ...