8.1 Rekapitulation Schulwissen
Die Radikalische Addition haben Sie im Schulunterricht wahrscheinlich kennen gelernt, als Sie über Kunststoffe und ihre Herstellung sprachen. Polyethylen (Polyethen) wird beispielsweise aus Ethen über eine radikalische Addition hergestellt.
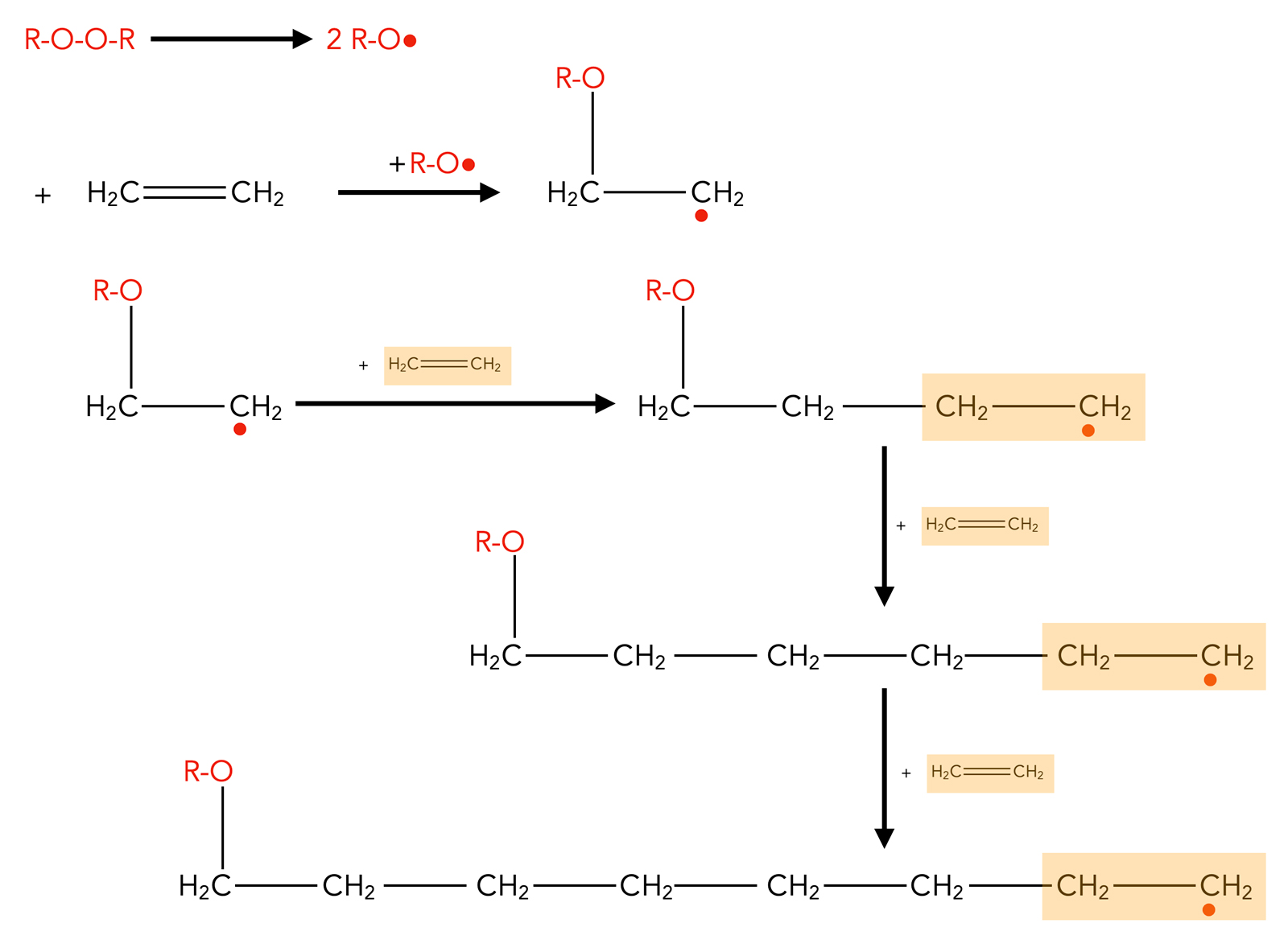
Die ersten Schritte der Synthese von Polyethen
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Der erste Reaktionsschritt besteht in der Bereitstellung eines Kettenstarters. Das ist normalerweise eine organische Verbindung, die sehr leicht in zwei Radikale zerfällt. Peroxide R-O-O-R werden hierfür gern eingesetzt, das sind Verbindungen mit zwei benachbarten O-Atomen in der Mitte. Die O-O-Einfachbindung kann relativ leicht homolytisch gespalten werden, und es entstehen zwei Radikale R-O• und •O-R, die dann als Starter eingesetzt werden können.
Im zweiten Reaktionsschritt setzt sich eins dieser Starter-Radikale an die Doppelbindung eines Ethen-Moleküls. Die Doppelbindung "klappt" auf, eines der beiden C-Atome verbindet sich mit dem Starter-Radikal, und das andere C-Atom wird selbst zum Radikal. Es ist ein Alkyl-Radikal entstanden.
Im dritten Reaktionsschritt reagiert dieses Alkyl-Radikal mit einem weiteren Ethen-Molekül. Auch hier öffnet sich die C=C-Doppelbindung, und es entsteht ein Butyl-Radikal.
Und so geht das mehrere Tausend Male weiter, am Ende hat man ein riesiges Molekül aus Tausenden Ethen-Einheiten, das Polyethan, oft auch als Polyethylen bezeichnet.
Andere Kunststoffe werden auf ähnliche Weise hergestellt. Statt Ethen verwendet man dann Derivate des Ethens, bei denen ein oder zwei H-Atome des Ethens durch Alkylgruppen oder Fremdatome wie Chlor ausgetauscht worden sind.
Am bekanntesten dürfen Vinylchlorid sein (ein H-Atom des Ethens wird durch ein Cl-Atom ersetzt) und Styrol (ein H-Atom des Ethens wird durch einen Benzolring ersetzt). Polymerisieren diese Monomere, erhält man die bekannten Kunststoffe Polyvinylchlorid (PVC) bzw. Polystyrol.
8.2 Studienvorbereitung
Normalerweise verläuft die Hydrobromierung von Alkenen nach einem Markownikow-Mechanismus. Das Proton setzt sich so an die C=C-Doppelbindung, dass ein möglichst stabiles Carbenium-Ion entsteht. An das positive C-Atom setzt sich dann im zweiten Schritt das Bromid-Ion.
Als man HBr-Additionen entdeckte, bei denen sogenannte Anti-Markownikow-Produkte entstehen, wusste man zuerst nicht, welcher Mechanismus dazu führt. Dann kam man aber auf die Idee, dass sich HBr nicht über einen ionischen, sondern über einen radikalischen Mechanismus addiert.
8.2.1 Der radikalische Additions-Mechanismus
Zunächst wird das HBr-Molekül homolytisch in ein H•- und ein •Br-Radikal gespalten. Das •Br-Radikal setzt sich dann an die C=C-Doppelbindung, und es entsteht ein Alkyl-Radikal mit einem einfach besetzten pz-Orbital am anderen C-Atom der Doppelbindung:
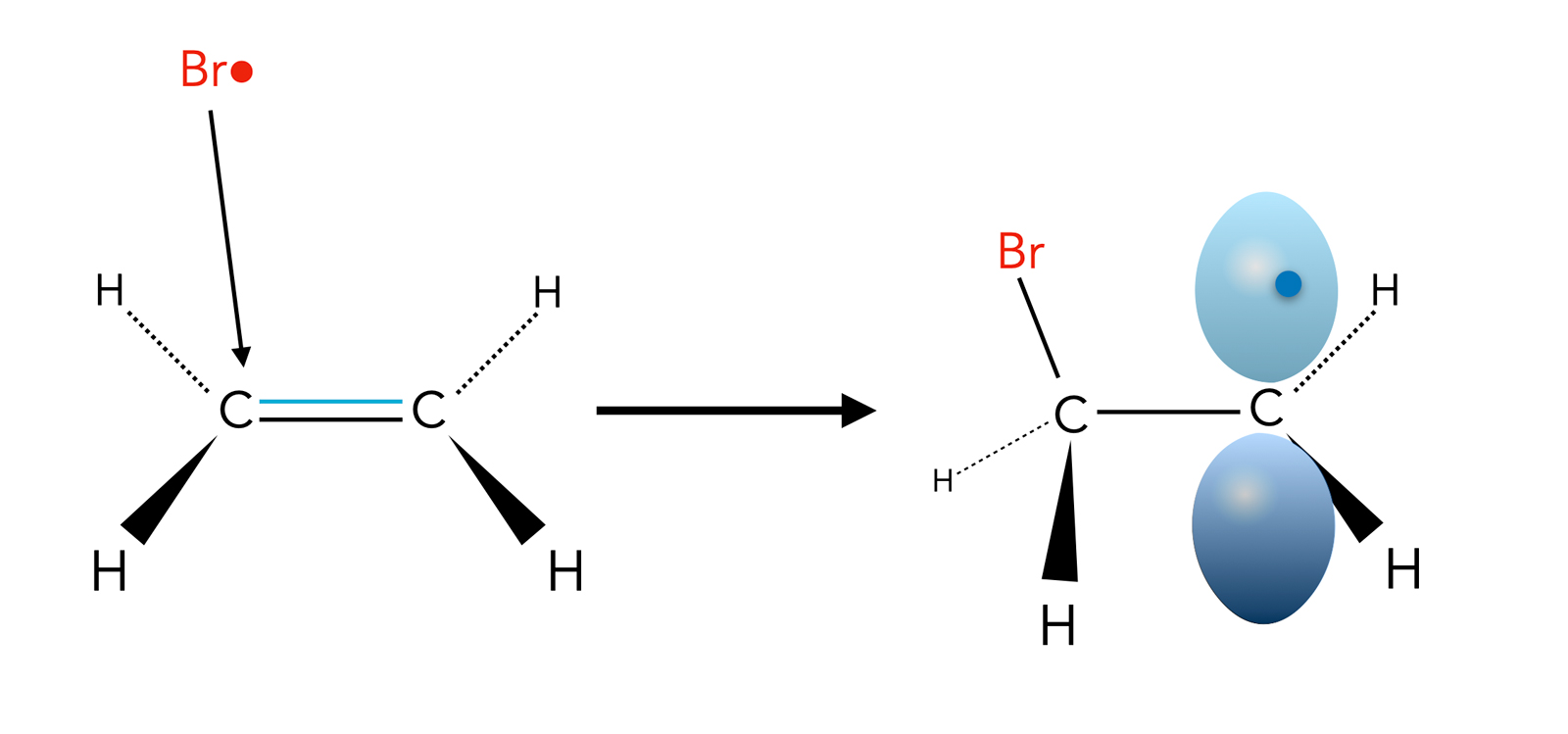
Ein Brom-Radikal setzt sich an die C=C-Doppelbindung
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Im zweiten Kettenfortpflanzungsschritt der radikalischen Addition abstrahiert das Alkyl-Radikal ein H-Atom aus einem HBr-Molekül:
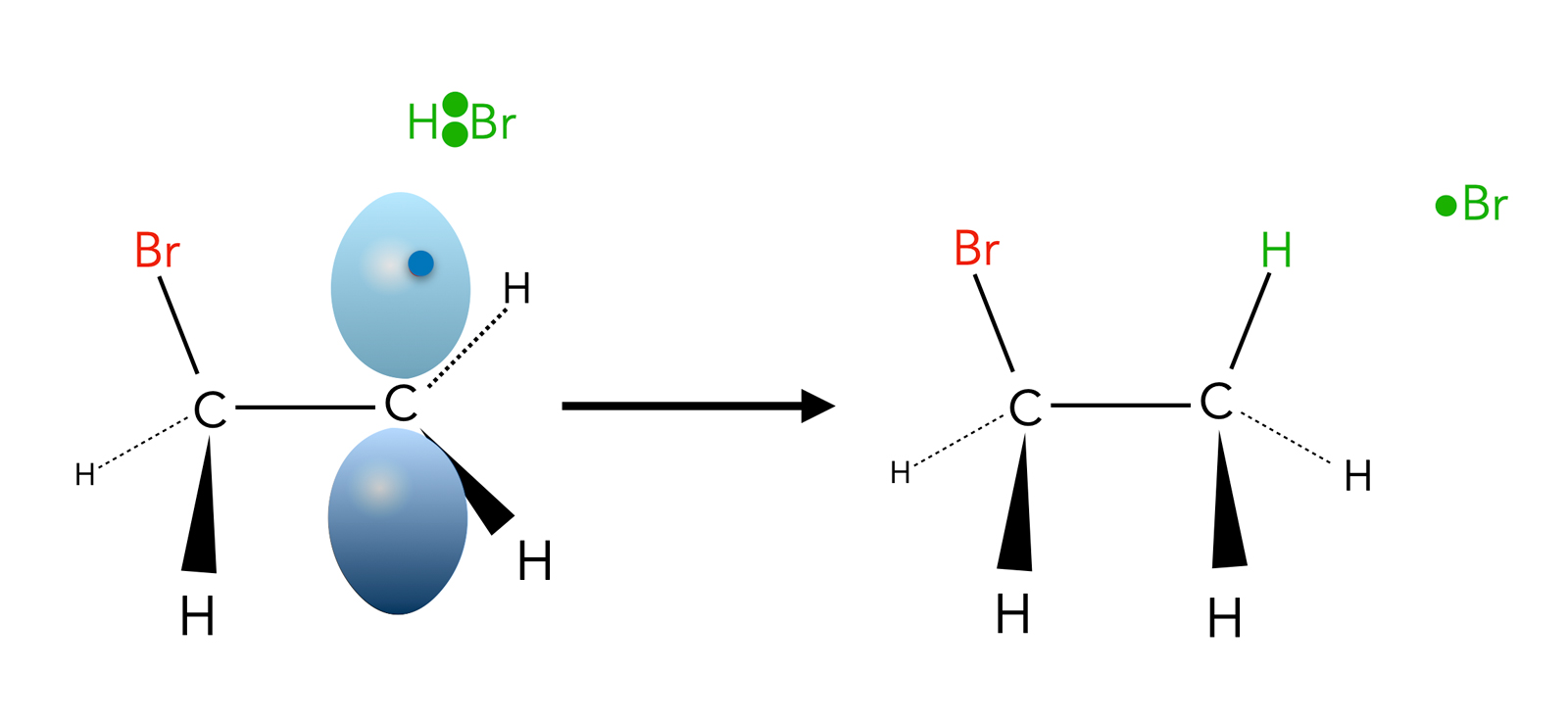
Das Alkyl-Radikal spaltet ein H-Atom vom HBr-Molekül ab
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Es bildet sich das Reaktionsprodukt Brom-ethan. Übrig bleibt ein neues Brom-Radikal, das dann den nächsten Kettenfortpflanzungsschritt startet.
Wie bei der radikalischen Substitution kommt die jeweilige Reaktionskette zum Stopp, wenn zwei Radikale zusammenstoßen und sich zu einem Molekül vereinigen, oder wenn einer der beiden Ausgangsstoffe aufgebraucht ist.
8.2.2 Radikalischer und elektrophiler Mechanismus im Vergleich
Wieso läuft die radikalische Addition nun nach einem Anti-Markownikow-Mechanismus ab? Schauen wir uns dazu einmal die elektrophile und die radikalische Hydrobromierung von Propen an.
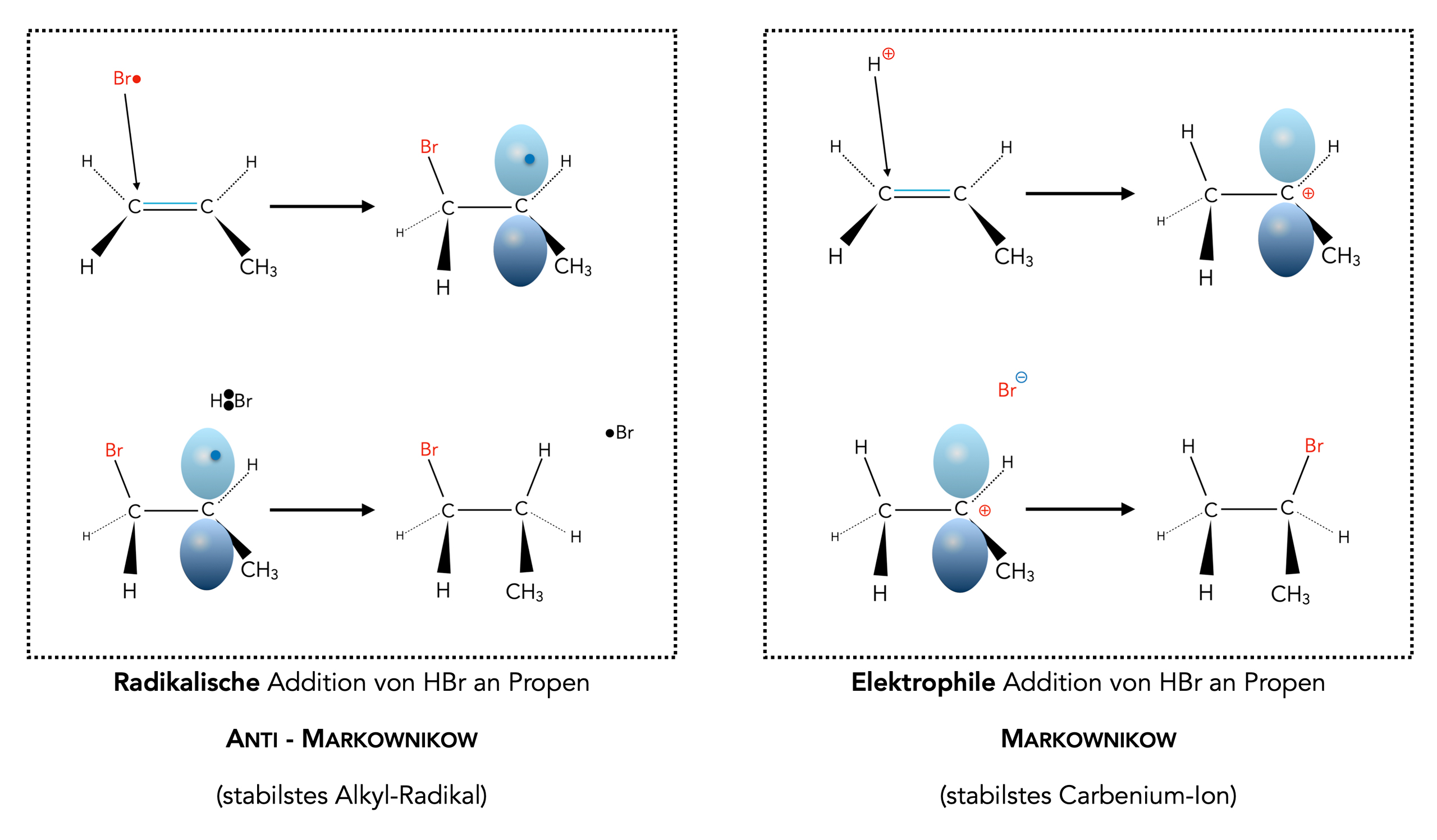
Radikalische und elektrophile HBr-Addition an Propen im Vergleich
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Bei der radikalischen Addition von HBr an Propen entsteht im ersten Kettenfortpflanzungsschritt das stabilste Alkyl-Radikal, nämlich das sekundäre Propyl-Radikal. Als Endprodukt erhält man dann das 1-Brom-propan.
Bei der elektrophilen Addition von HBr an Propen entsteht im ersten Reaktionsschritt das stabilste Carbenium-Ion, nämlich das sekundäre Propyl-Kation. Als Endprodukt erhält man dann das 2-Brom-propan.
Ich habe die beiden letzten Absätze absichtlich möglichst gleichlautend formuliert, damit Sie die Parallelen zwischen den beiden Reaktionen besser erkennen. Man hätte auch verallgemeinernd formulieren können:
Im ersten Reaktionsschritt setzt sich das angreifende Teilchen (Br•, H+) so an die C=C-Doppelbindung, das ein möglichst stabiles Zwischenprodukt (Radikal, Carbenium-Ion) entsteht. Das im zweiten Schritt angreifende Teilchen setzt sich dann an das andere C-Atom der Doppelbindung.
8.2.3 Steuerung der Hydrobromierung
Durch die Reaktionsbedingungen kann man nun beeinflussen, nach welchem der beiden möglichen Mechanismen die Hydrobromierung abläuft. Die radikalische Hydrobromierung setzt die Bildung von Brom-Radikalen voraus (Kettenstart-Reaktion). Dummerweise zerfällt ein HBr-Molekül aber gar nicht so leicht homolytisch in ein Brom-Radikal und ein Wasserstoff-Radikal. Da muss man nachhelfen:
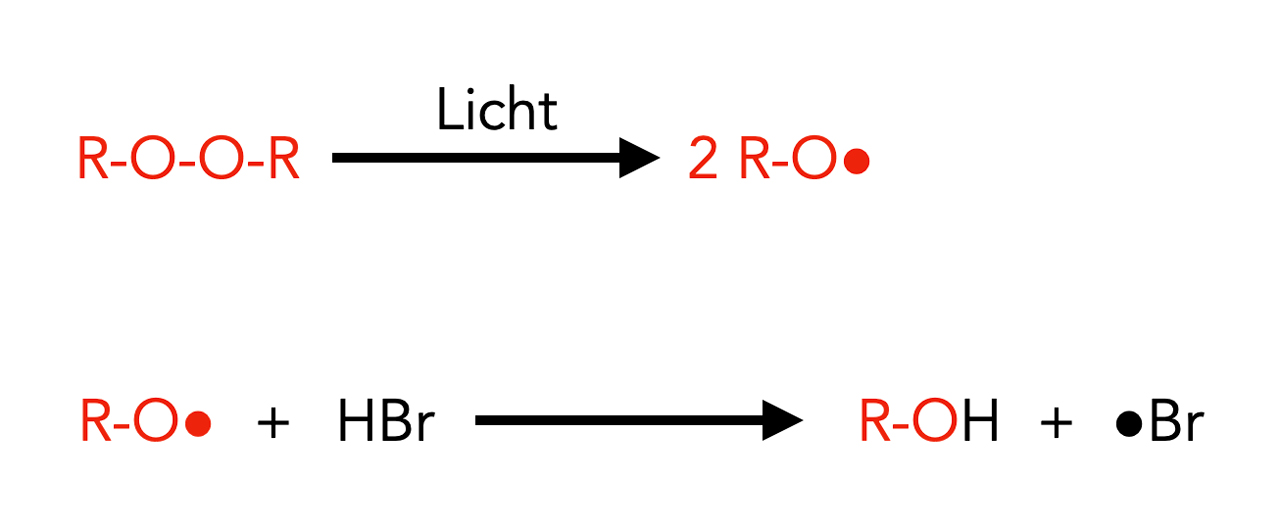
Kettenstart bei der radikalischen Hydrobromierung
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Ähnlich wie bei der Herstellung von Polyethen wird ein Peroxid als Kettenstarter eingesetzt. Das Peroxid-Molekül zerfällt unter Lichteinfall in zwei R-O•-Radikale, die dann mit den HBr-Molekülen reagieren. Die R-O•-Radikale abstrahieren den Wasserstoff aus dem HBr, es entsteht R-OH, also ein Alkohol, und übrig bleibt ein Brom-Radikal •Br. Dieses reagiert dann mit dem Alken wie oben beschrieben.
Befinden sich in dem Lösemittel, in dem die Reaktion abläuft, keine Peroxide und wird das Gemisch auch nicht belichtet, kann keine radikalische Addition ablaufen. Eine elektrophile Addition kann dagegen im Prinzip stattfinden, weil diese ja weder Peroxide noch Licht benötigt, um in Gang zu kommen.
Durch den Einsatz polarer Lösemittel kann man die Chance auf eine elektrophile Addition noch weiter steigern, denn die polaren Teilchen des Lösemittels stabilisieren die ionischen Zwischenstufen, die bei der Reaktion auftreten.
Übungsaufgabe:
Bestimmen Sie das Reaktionsprodukt, das sich bei folgender Reaktion bildet:
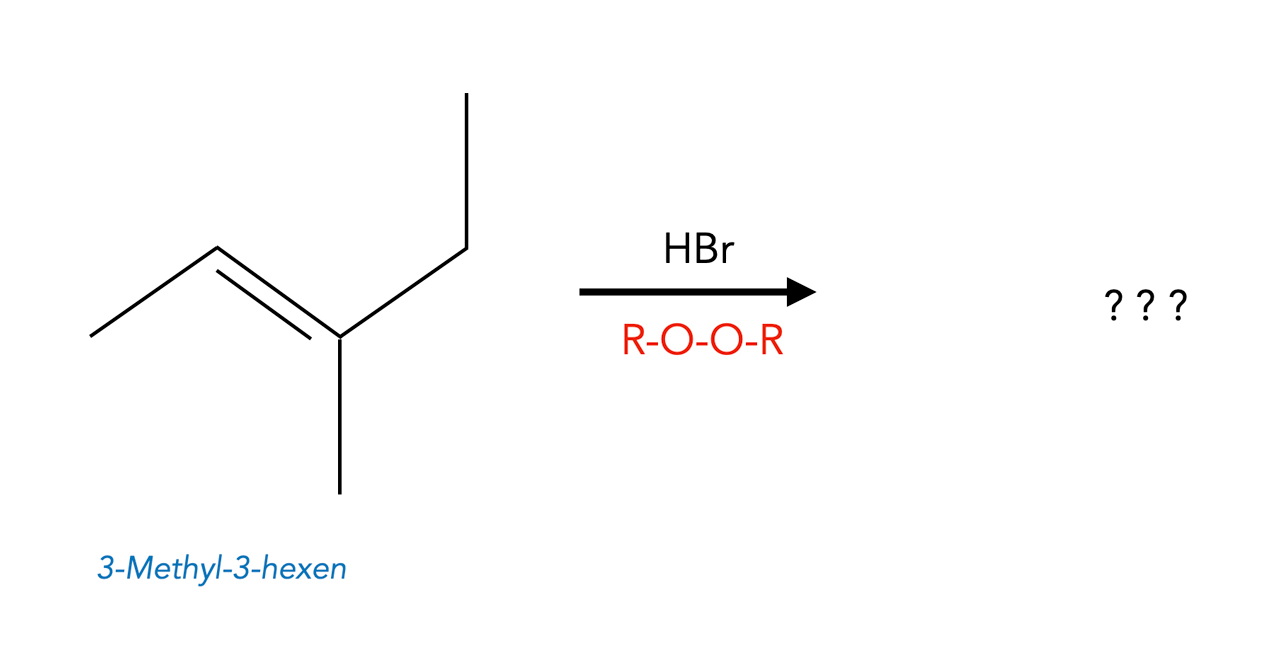
Lösungsvorschlag:
Die Anwesenheit eines Peroxids lässt vermuten, dass eine radikalische Hydrobromierung abläuft. Ein Brom-Radikal setzt sich also so an das 3-Methyl-3-hexen, dass ein möglichst stabiles Alkyl-Radikal gebildet wird:
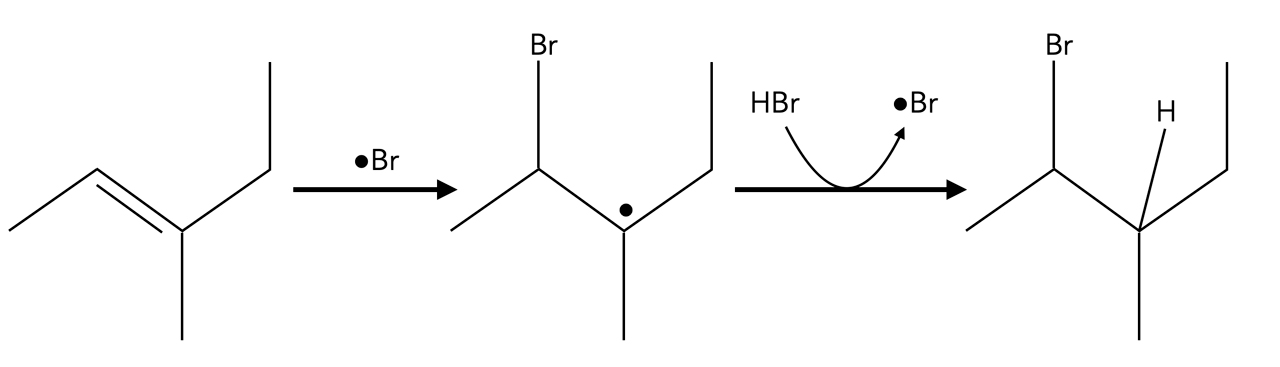
Es entsteht ein tertiäres Alkyl-Radikal, und das Reaktionsprodukt 2-Brom-3-methyl-hexan ist das Anti-Markownikow-Produkt.
8.2.4 Weitere radikalische Additionstypen
Aus energetischen Gründen kann die radikalische Addition von HCl oder HI nicht stattfinden, die Reaktionen wären endotherm. Aber folgende weitere Reaktionen sind nach dem radikalischen Mechanismus möglich:
Addition von Tetrachlorkohlenstoff
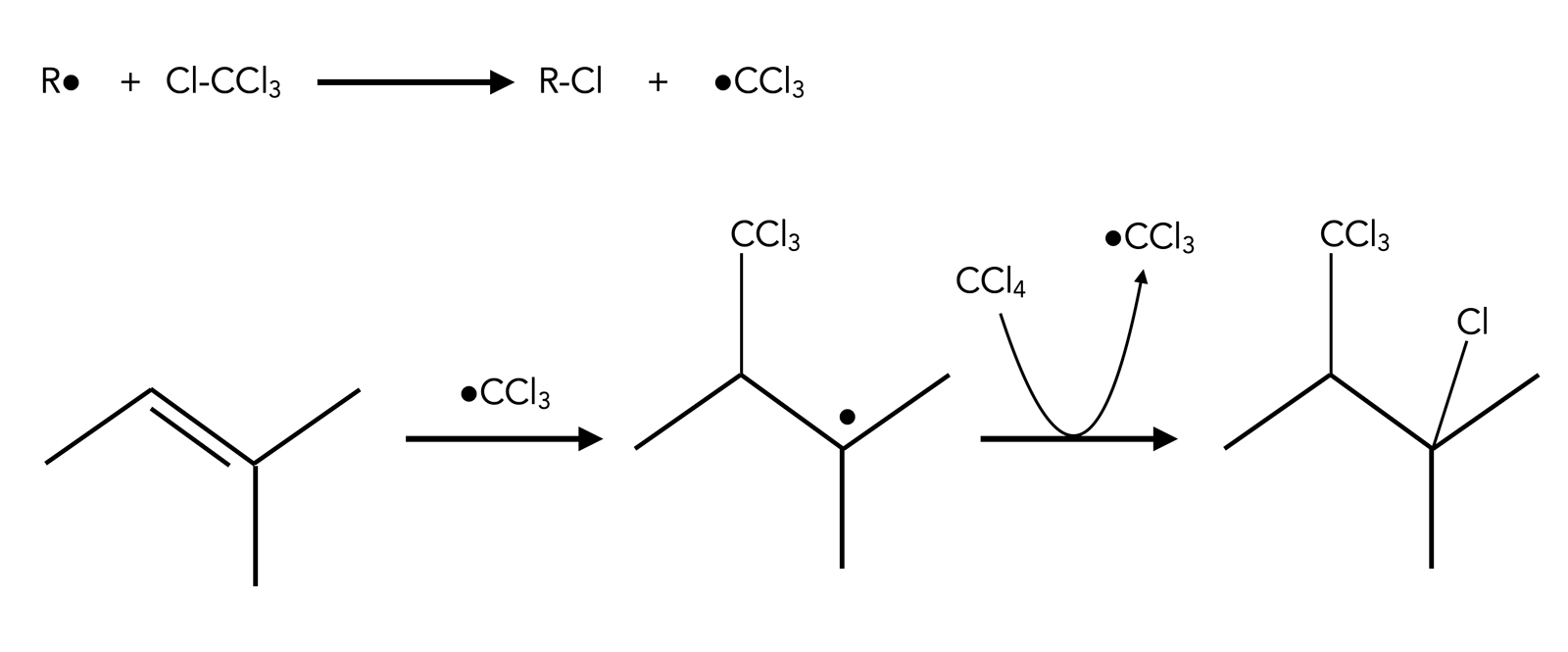
Radikalische Addition von CCl4
Autor: Ulrich Helmich 2023, Lizenz: ---
Die Addition von CCl4 verläuft radikalisch und liefert ein Anti-Markownikow-Produkt. Das Interessante an dieser Reaktion: Es wird ein neues C-Atom in das Molekül eingeführt.
Addition von Schwefelwasserstoff
Die Addition von H2S erfolgt ebenfalls nach einem radikalischen Mechanismus:
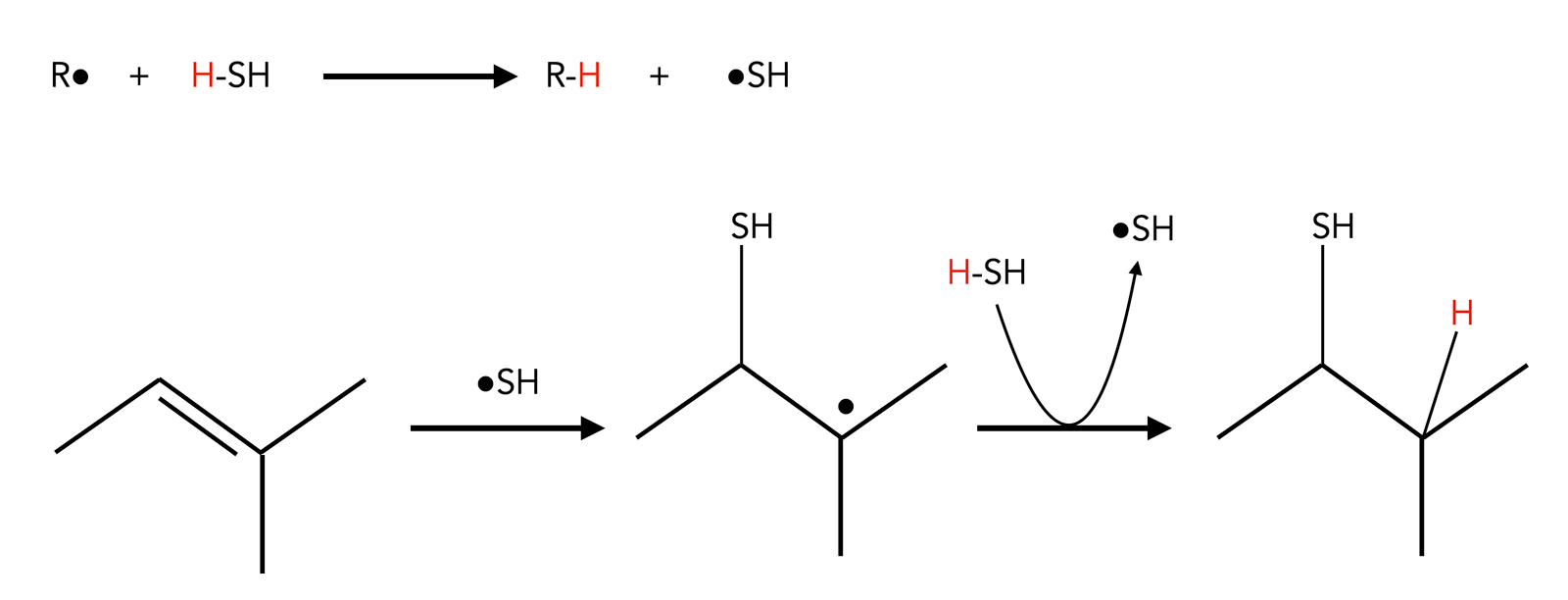
Radikalische Addition von CCl4
Autor: Ulrich Helmich 2023, Lizenz: ---
Ein Radikalstarter abstrahiert ein H-Atom aus einem H2S-Molekül, und das •SH-Radikal greift dann die C=C-Doppelbindung an. Es bildet sich ein stabiles Alkyl-Radikal, das dann wieder ein H-Atom aus einem neuen H2S-Molekül abstrahiert. Es entsteht ein Thiol als Anti-Markownikow-Produkt.
8.3 Was sagt die Fachliteratur?
In den meisten Lehrbüchern wird die Radikalische Addition nicht als eigener Reaktionsmechanismus aufgeführt, zumindest gibt es meistens kein eigenes Kapitel dafür. Häufig der radikalische Mechanismus thematisiert, um die Bildung von Anti-Markownikow-Produkten zu erklären.
Die Existenz von Markownikow- und Anti-Markownikow-Reaktionen hat aber zur Folge, dass es in den meisten Büchern jede Menge Aufgaben zur Addition an Alkene gibt, und die Studenten müssen dann immer entscheiden, nach welchem Mechanismus die jeweiligen Reaktionsprodukte entstanden sind. Oft sind diese Aufgaben dann noch mit stereochemischen Aspekten angereichert, denn oft entstehen bei diesen Additionen Paare von Stereoisomeren, die dann bestimmt werden müssen.
8.4 Übungen
Die Lösungen dieser Aufgaben und der Aufgaben der Kapitel 1 und 2 (Alkane, Cycloalkane) können Sie gegen eine Kostenbeteiligung von 5 Euro über Paypal als PDF-Datei von mir erhalten (einfach auf den Spenden-Button klicken und als Verwendungszweck "Lösungen Organik 1-3" angeben).
Aufgabe 8.1
Die Synthese von Polyethen, Polystyrol, Polyvinylchlorid und anderer Kunststoffe erfolgt oft über eine radikalische Addition. Recherchieren Sie mindestens zwei verschiedene Peroxide, die sich als Kettenstarter eignen.
Aufgabe 8.2
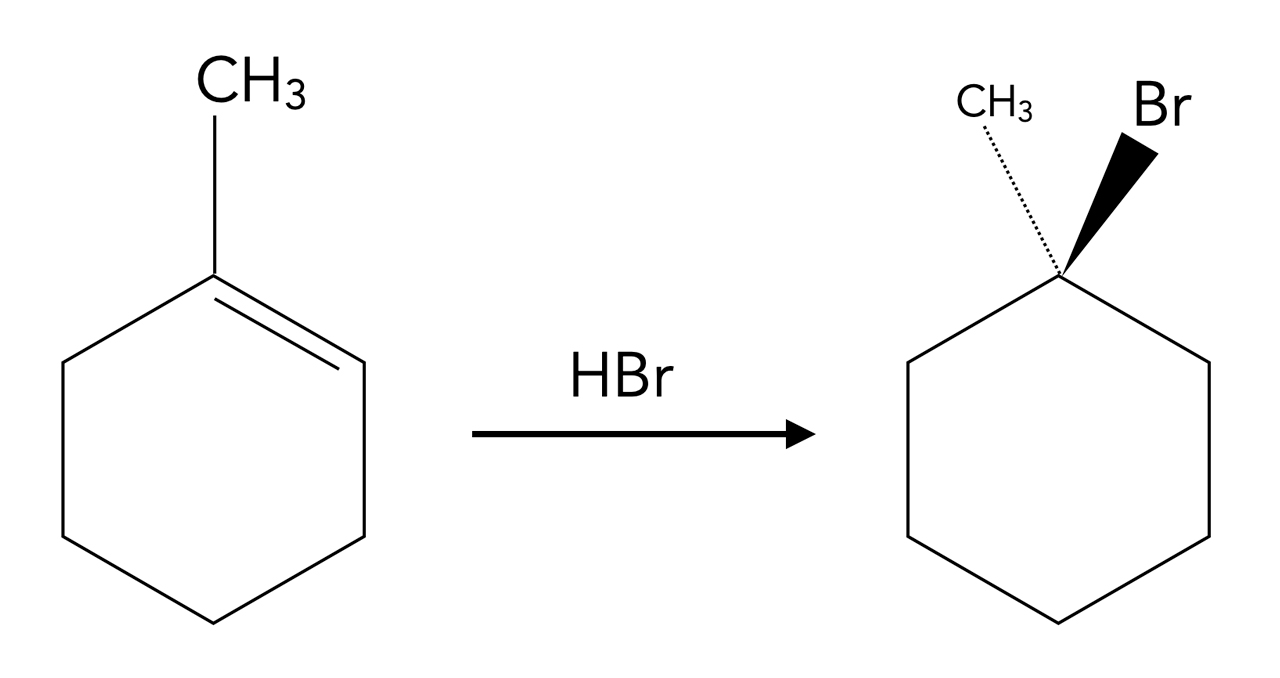
Die Verbindung 1-Brom-1-methyl-cyclohexan soll aus 1-Methyl-cyclohexen und Bromwasserstoff hergestellt werden.
Ermitteln Sie, ob dies eher mit einer radikalische oder einer elektrophile Addition von HBr gelingt.
Aufgabe 8.3
Bei der radikalischen Hydrobromierung reagiert der Kettenstarter mit einem HBr-Molekül unter Abstraktion des H-Atoms, so dass ein Brom-Radikal übrig bleibt.
Alternativ könnte der Kettenstarter aber auch ein Brom-Atom abstrahieren, so dass ein H-Radikal entsteht.
Begründen Sie mit Hilfe von Energiebetrachtungen, wieso diese Alternative unwahrscheinlicher ist als die Abstraktion eines H-Atoms.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
Seitenanfang -
Das war die letzte Seite im Abschnitt über Alkene.