4.1 Rekapitulation Schulwissen
Im Unterricht der gymnasialen Oberstufe haben Sie bestimmt ein zwei wichtige Darstellungsmethoden für Alkene kennengelernt:
- Dehydrierung von Alkanen (Eliminierung von H2)
- Dehydratisierung von Alkoholen (Eliminierung von H2O)
Vielleicht haben Sie in einem Demonstrations-Experiment (oder sogar als Schülerversuch) einen Alkohol wie Ethanol dehydratisiert und das entstehende Ethen mit einem Reagenzglas aufgefangen. In den meisten Schulbüchern wird dieser Versuch jedenfalls besprochen.
4.2 Studienvorbereitung
4.2.1 Dehydrierung von Alkanen
Dieses Verfahren spielt bei der industriellen Synthese von Alkenen eine große Rolle. Alkane können problemlos aus dem Erdgas oder dem Erdöl gewonnen werden, aus dem Erdöl i.d.R. durch fraktionierte Destillation. Durch Cracken können längere Alkane in kurzkettige Alkane und Alkene gespalten werden.
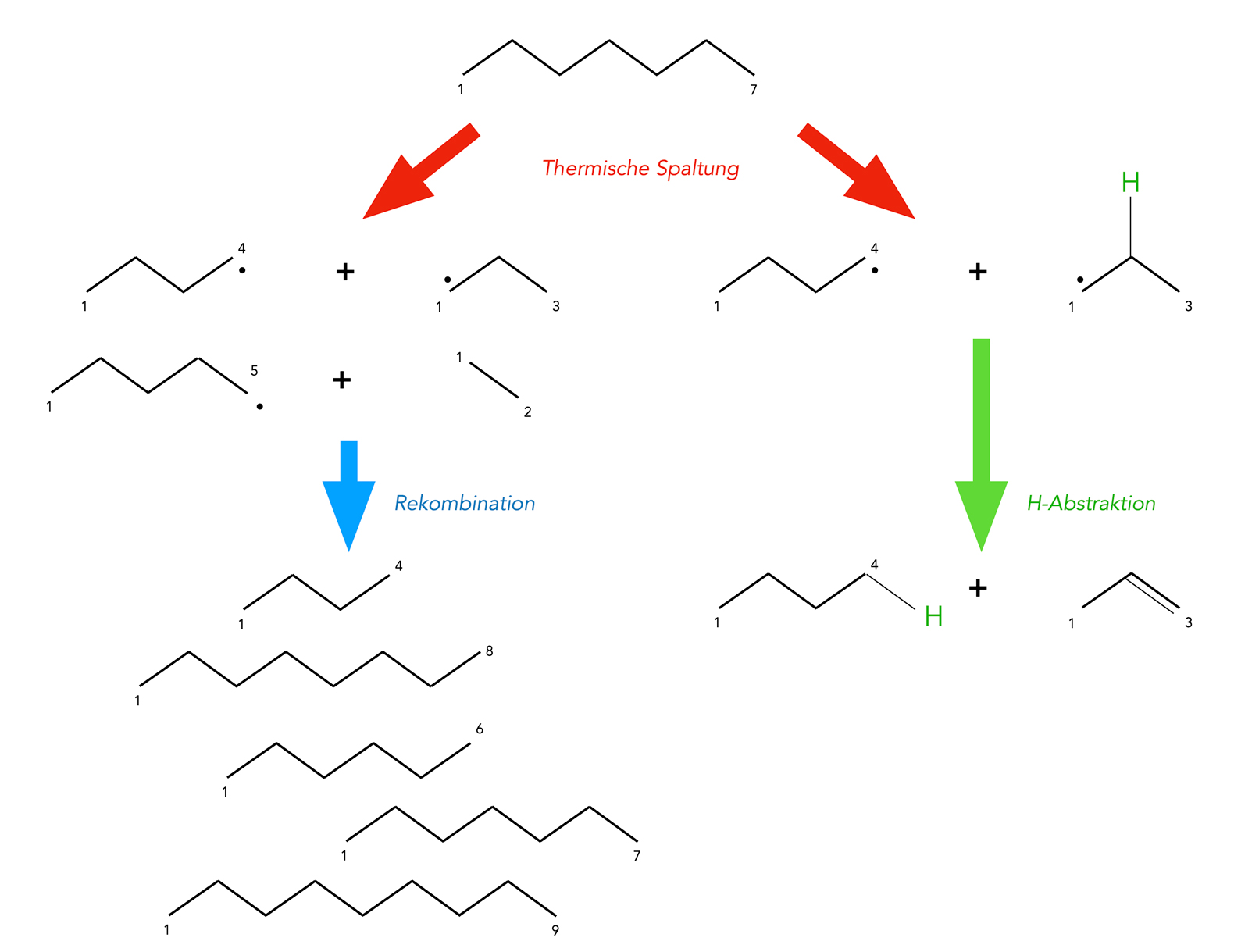
Thermische Spaltung von Alkanen, Rekombination und H-Abstraktion
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Die Abbildung zeigt zunächst die thermische Spaltung von Alkanen - hier Heptan. Bei dieser Pyrolyse werden Alkane unter Einwirkung eines Katalysators (Zeolith) erhitzt, dabei bilden sich kürzere Alkylradikale. Solche Alkylradikale haben zwei Möglichkeiten, miteinander zu reagieren.
Rekombination
Zunächst einmal können sich aus den radikalischen Bruchstücken durch Rekombination neue Alkane bilden. Diese können kürzer sein als das ursprüngliche Alkan, aber auch länger. Im Grunde ist dieser Reaktionsweg eine Sackgasse, die nicht unbedingt zu kürzeren Alkanen führt. Es sei denn, man verhindert diese Rekombination durch technische Eingriffe.
Wasserstoff-Abstraktion
Bei diesem Reaktionsweg wird ein H-Atom aus einem dieser Alkyl-Radikale homolytisch abgespalten und dann auf ein anderes Radikal übertragen. So entstehen ein Alkan und ein Alken.
4.2.2 Dehydratisierung von Alkoholen
Alkohole können leicht dehydratisiert werden, wobei sich dann Alkene bilden. Entzieht man beispielsweise Ethanol eine OH-Gruppe und ein H-Atom (also ein Wasser-Molekül = Dehydratisierung), dann bildet sich Ethen. Die Reaktion kann in einem einfachen Schulversuch durchgeführt werden. Dazu wird allerdings konz. Schwefelsäure als Katalysator benötigt.
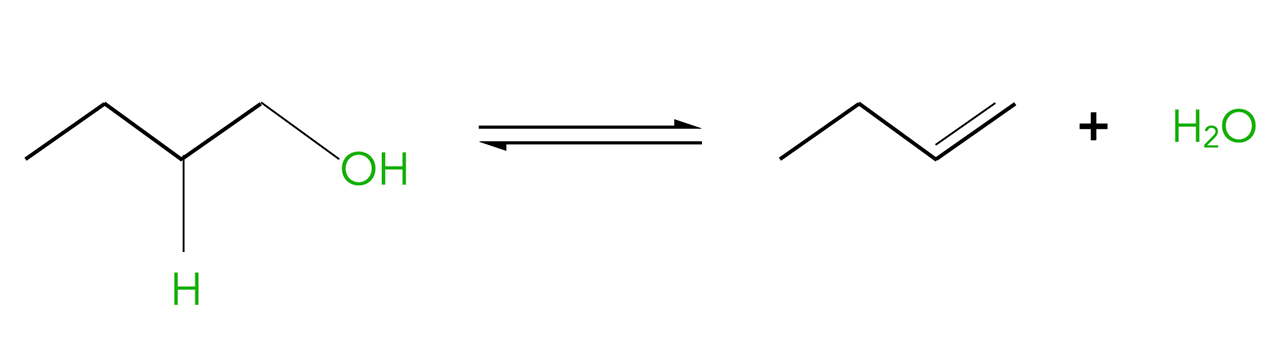
Dehydratisierung von Butan-1-ol
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Die OH-Gruppe wird zunächst protoniert und dann als H2O abgespalten. Das entstehende Carbenium-Ion spaltet dann ein Proton ab, wodurch sich der Katalysator regeneriert.
Eine industriell bedeutsame Dehydratisierung ist die Synthese von 1,3-Butadien aus 1,4-Butandiol:
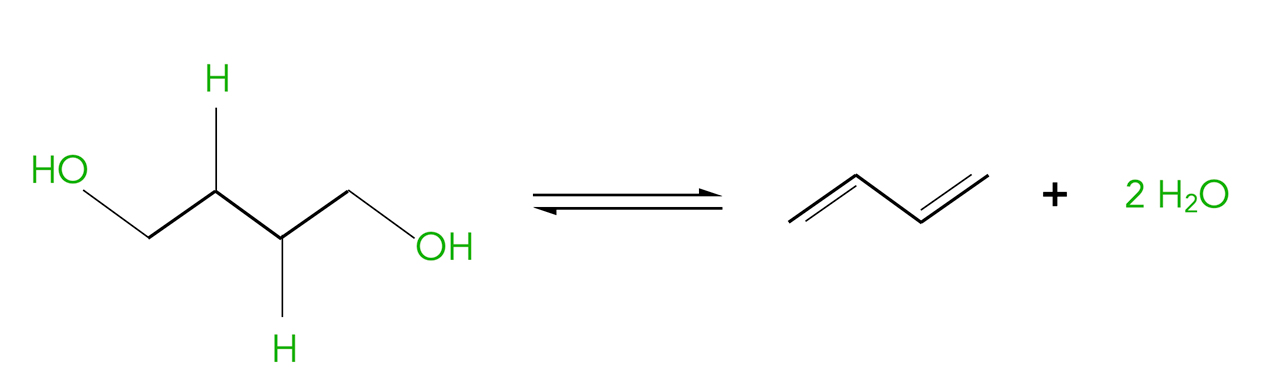
Synthese von 1,3-Butadien aus 1,4-Butandiol
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Die Dehydratisierung von Alkoholen ist neben der Dehydrohalogenierung von Halogenalkanen die wichtigste Methode zur präparativen Darstellung von Alkenen [4].
4.2.3 Dehydrohalogenierung von Halogenalkanen
Ähnlich wie die Dehydratisierung von Alkoholen läuft die Eliminierung von Halogenwasserstoff aus Halogenalkanen ab. Aus Chlorethan beispielsweise kann man durch Abspaltung von HCl Ethen herstellen. Während die Abspaltung von Wasser (Dehydratisierung, siehe oben) eine saure Katalyse erfordert, verläuft die Abspaltung einer Säure wie HCl oder HBr unter basischer Katalyse. Das ist ja auch irgendwie logisch. Der entscheidende Schritt bei dieser Eliminierung ist die Abspaltung eines Protons aus dem Halogenalkan. Das gelingt nur, wenn eine starke Base anwesend ist, die bereit ist, das Proton aufzunehmen. Gleichzeitig mit der Abspaltung des Protons wird das Halogenid-Ion abgespalten.
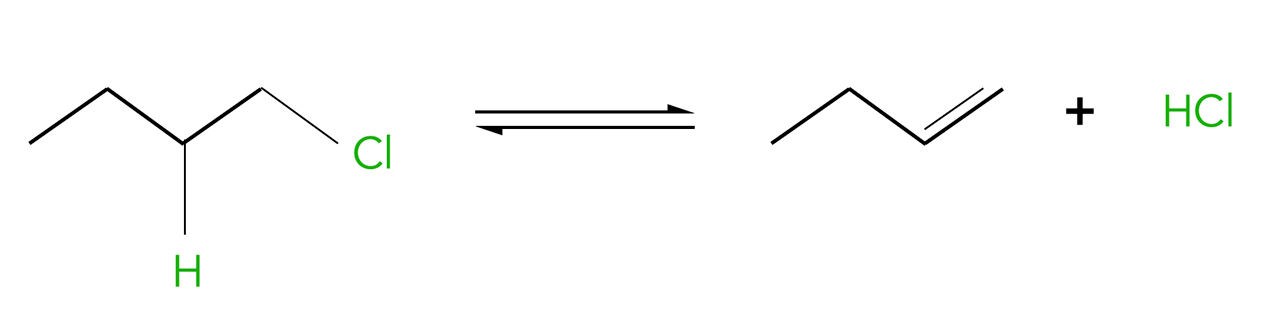
Abspaltung von HCl aus Chlorbutan
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Kurzer Exkurs: E1- und E2-Eliminierungen
Aus dem Schulunterricht kennen Sie bestimmt die SN1- und SN2-Substitutionen. Die SN1-Substitution verläuft in zwei Schritten, als Zwischenprodukt wird ein Carbenium-Ion gebildet. Dieser erste Schritt verläuft nach einer monomolekularen Kinetik, die Reaktionsgeschwindigkeit ist also nur von der Konzentration des organischen Substrats abhängig. Bei der SN2-Reaktion erfolgt die Substitution dagegen in einem Schritt nach einem bimolekularen Mechanismus. Die Reaktionsgeschwindigkeit der Umsetzung ist von der Konzentration des organischen Substrats und von der Konzentration des Nucleophils abhängig.
Auf die gleiche Weise kann man auch die Eliminierungsreaktionen in eine E1- und eine E2-Reaktion unterteilen. Bei der E1-Reaktion wird zunächst ein negatives Ion abgespalten, so dass sich ein Carbenium-Ion bildet. Bei der Dehydratisierung von Alkoholen wird beispielsweise die OH-Gruppe abgespalten. Da das nicht so einfach geht, wird zunächst ein Proton angelagert; die OH2+-Gruppe lässt sich dann wesentlich leichter abtrennen. Dieser Reaktionsschritt ist geschwindigkeitsbestimmend und verläuft monomolekular. Im zweiten Schritt wird dann ein positives Ion abgespalten, bei der Dehydratisierung von Alkoholen also ein Proton.
Einzelheiten siehe Abschnitt Eliminierung auf dieser Homepage.
4.2.4 Dehalogenierung von vicinalen Dihalogenalkanen
Aus sogenannten vicinalen Dihalogeniden kann mit Hilfe des unedlen Metalls Zink leicht ein Halogen-Molekül abgespalten werden. Vicinale Dihalogenide sind Dihalogenalkane, bei denen die beiden Halogen-Atome an benachbarten Kohlenstoff-Atomen sitzen. Auch diese Reaktion ist eine Eliminierung.
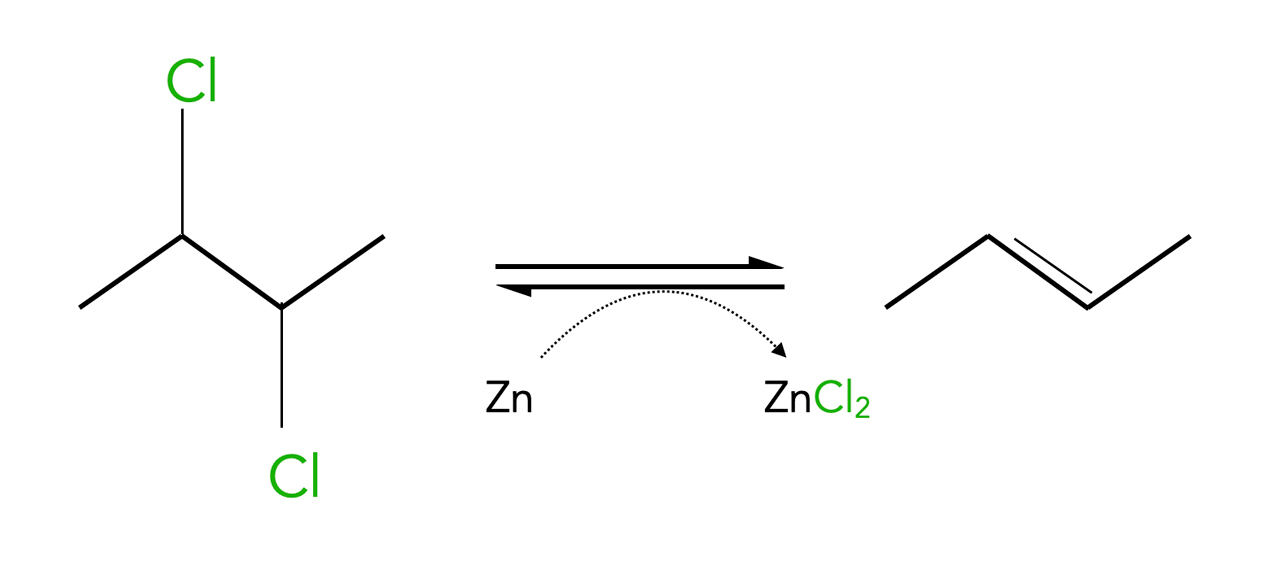
Eliminierung von Chlor mit Hilfe von Zink
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
4.2.6 Reduktion von Alkinen
Dieses Verfahren soll nur der Vollständigkeit halber erwähnt werden. Versetzt man ein Alkin mit Wasserstoff, so kann sich mit Hilfe von Katalysatoren das entsprechende Alken bilden. Wenn man nicht aufpasst, hat man natürlich gleich das entsprechende Alkan.
4.2.7 Reduktion von Aldehyden und Ketonen
Auch dieses Verfahren soll nur der Vollständigkeit halber erwähnt werden. Aldehyde und Ketone können mit geeigneten Reagenzien und unter Einwirkung von Katalysatoren zu Alkenen reduziert werden. Bekannte Syntheseverfahren sind hier die Wittig-Reaktion, die Peterson-Reaktion und die Shapiro-Reaktion, auf die ich hier aber nicht eingehe, sondern stattdessen auf die entsprechenden Wikipedia-Artikel verweise. Oder warten Sie einfach ab, bis Sie in der Organik-Vorlesung sitzen.
4.2.8 Zusammenfassung: Darstellung von Alkenen
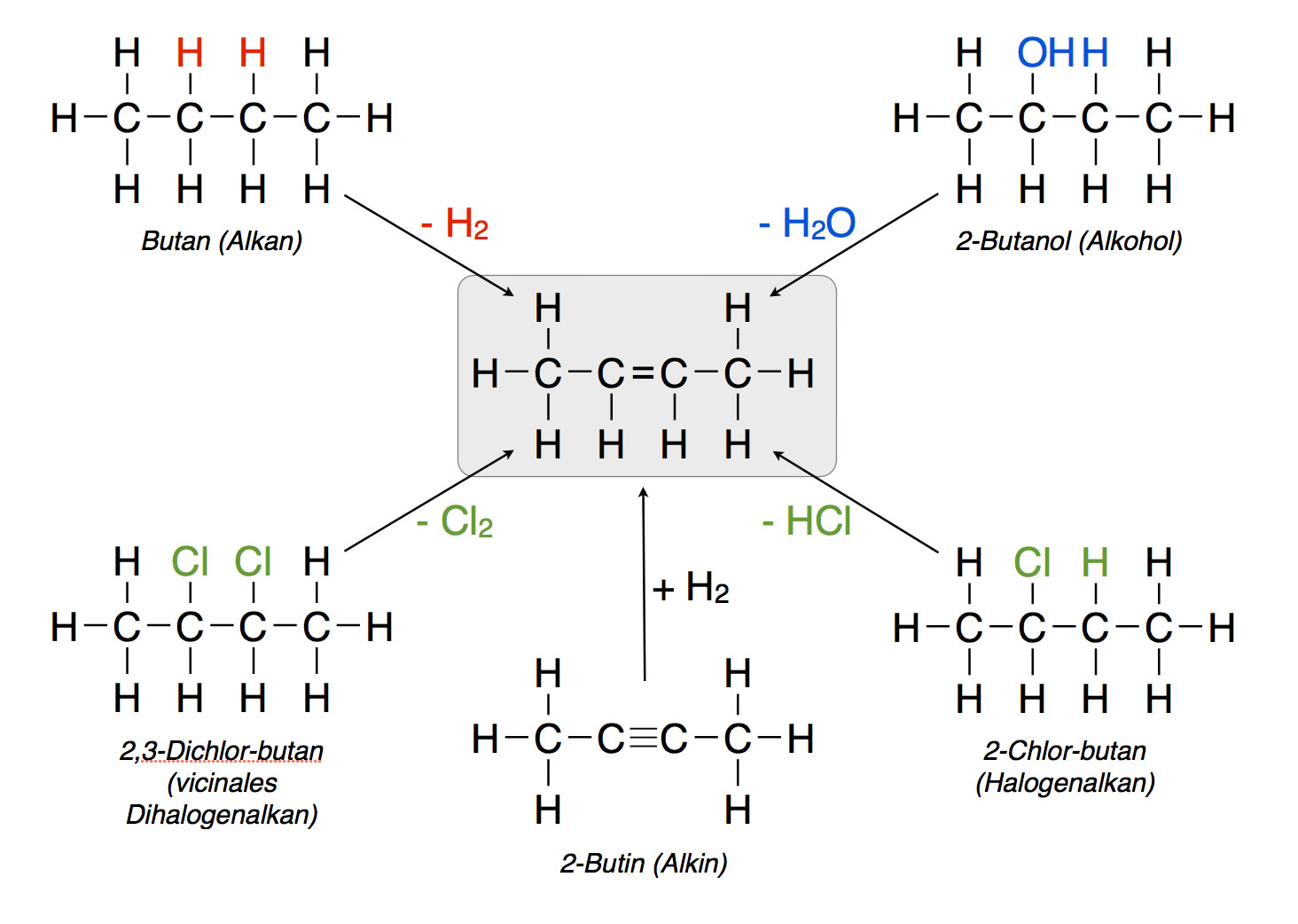
Darstellung der Alkene am Beispiel 2-Buten
Autor: Ulrich Helmich 2020, Lizenz: Lizenz: CC BY-NC-SA 4.0
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.