Wenn Ihnen die folgende Seite zu lang oder komplex erscheint, gehen Sie doch einfach auf diese Seite, die für Schüler(innen) der gymnasialen Oberstufe bestimmt sind. Hier konzentrieren wir uns auf das Wesentliche und verzichten auf komplexere Darstellungen. Fürs Chemie-Abitur sollte das auf jeden Fall reichen. Wenn Sie allerdings vorhaben, Chemie, Biologie oder Medizin zu studieren oder bereits studieren, sollten Sie auf dieser Seite hier bleiben...
Bildung von Hydraten: saure Katalyse
Die Addition von Wasser an Aldehyde oder Ketone ist die einfachste Form der Nucleophilen Addition an die C=O-Doppelbindung.
Die nicht-säurekatalysierte Addition
Nehmen wir doch einfach mal an, dass sich ein Wasser-Molekül direkt an das positiv polarisierte Carbonyl-C-Atom setzt:
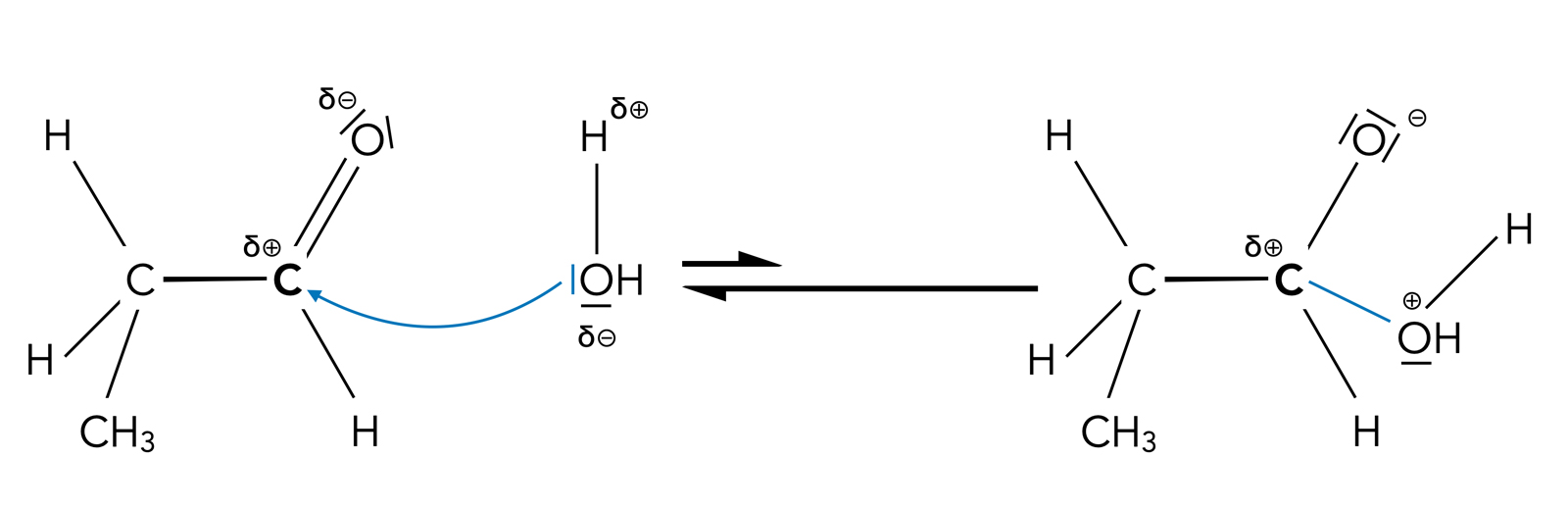
Direkter Angriff des Nucleophils H2O
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Theoretisch ist ein solcher nucleophiler Angriff möglich, in der Praxis tritt er aber so gut wie nicht auf; das Gleichgewicht dieser Reaktion liegt weit auf der linken Seite. Das liegt daran, dass erstens Wasser ein recht schwaches Nucleophil ist (nicht-ionisch!), und dass zweitens das Carbony-C-Atom auch nicht besonders elektrophil ist.
Die säurekatalysierte Addition
In einem sauren Medium dagegen läuft die nucleophile Addition von Wasser an eine Carbonylgruppe sehr viel schneller ab:
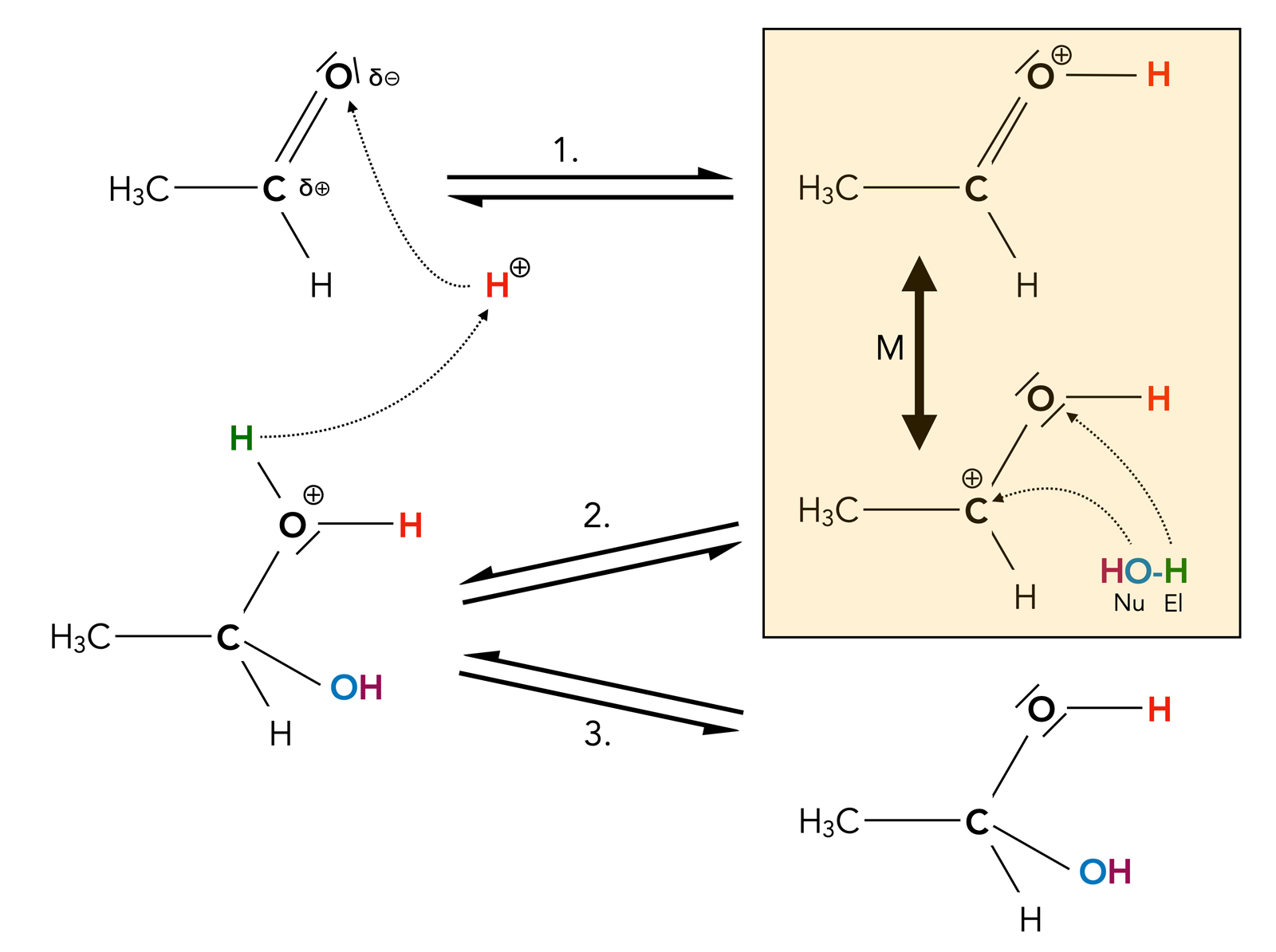
Mechanismus der Addition von Wasser unter saurer Katalyse
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die hier eingezeichneten gestrichelten Pfeile sind keine Elektronenpaar-Verschiebungs-Pfeile, sondern mehr Atom-Verschiebungs-Pfeile. Sie deuten also an, "wohin" das jeweilige Atom sich bewegt.
Schritt 1
Ein Proton H+ lagert sich an das negativ polarisierte Sauerstoff-Atom der C=O-Bindung an.
Mesomerie
Das entstandene Zwischenprodukt wird durch Mesomerie stabilisiert. In der einen Grenzformel befindet sich die vom Proton mitgebrachte positive Ladung am Sauerstoff-Atom, das immer noch mit einer Doppelbindung mit dem C-Atom verbunden ist. In der zweiten Grenzformel liegt ein Carbenium-Ion vor, die positive Ladung befindet sich also am Carbonyl-C-Atom. Diese zweite Grenzstruktur ist dafür verantworlich, dass das Carbonyl-C-Atom jetzt deutlich stärker positiv polarisiert ist als ohne vorherige Bindung eines Protons.
Schritt 2
Erst jetzt wird das Wasser-Molekül addiert. Die negative OH-Gruppe des Wasser-Moleküls setzt sich als Nucleophil an das Carbonyl-C-Atom, und das übrig gebliebene Proton setzt sich als Elektrophil an das O-Atom des Aldehyds oder Ketons. Dieses Zwischenprodukt ist wegen der positiv geladenen OH2+-Gruppe am Carbonyl-C-Atom noch instabil. Diese OH2+-Gruppe kann sehr leicht wieder als Wasser abgespalten werden, und dann sind wir wieder beim vorherigen Zwischenprodukt.
Schritt 3
Durch Abgabe eines Protons wird aus der OH2+-Gruppe eine "normale" und stabile OH-Gruppe. Das abgegebene Proton kann das nächste Molekül der Carbonylverbindunjg protonieren, das deutet der Atom-Verschiebungs-Pfeil ja auch an.
Katalyse
Am Anfang bei Schritt 1 wurde ein Proton eingesetzt, am Ende von Schritt 3 wird ein anderes Proton wieder abgegeben. In der Gesamtgleichung taucht dieses Proton also nicht auf, und daher ist es korrekt, von einer sauren Katalyse zu sprechen.
Warum liegt hier eine Katalyse vor?
Erstens läuft die Reaktion nur dann ab, wenn Protonen im Medium vorhanden sind.
Zweitens taucht das Proton in der Reaktionsgleichung nicht auf:
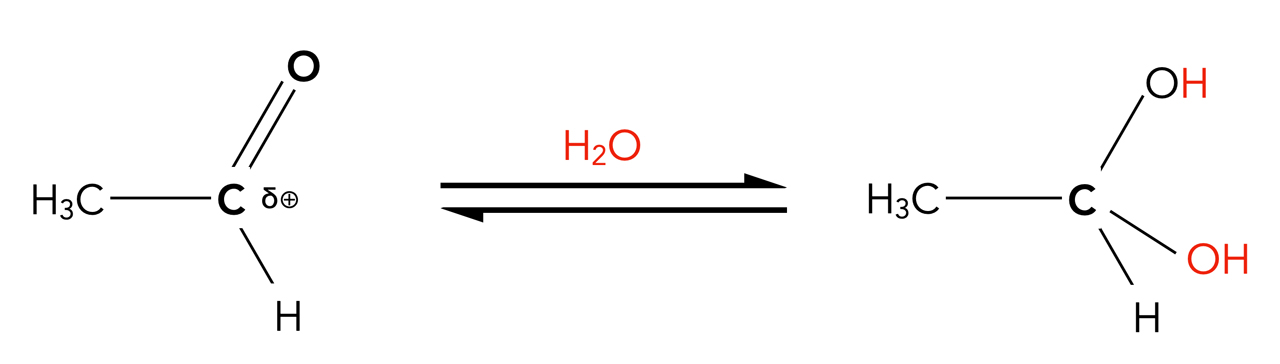
Die Gesamtreaktion der H2O-Addition an Acetaldehyd bei saurer Katalyse
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bildung von Hydraten: basische Katalyse
Die Addition von Wasser läuft in einem neutralen Medium so gut wie nicht ab, in einem leicht sauren dagegen sehr gut. Normale Menschen würden nun denken, dass die Reaktion in einem alkalischen Medium wie Natronlauge noch schlechter abläuft als in einem neutralen Medium. Denn wo viele Protonen gut sind, werden extrem wenige Protonen doch wohl schlecht sein.
Das Gegenteil ist der Fall! Die Addition von Wasser an Aldehyde oder Ketone kann auch unter basischer Katalyse stattfinden. Es ist richtig, dass in einam alkalischen Medium noch weniger Protonen vorhanden sind als in einem neutralen. Aber dafür sind ja jetzt jede Menge Hydroxid-Ionen präsent, die ebenfalls als Katalysator wirken können, wie das folgende Bild zeigt:
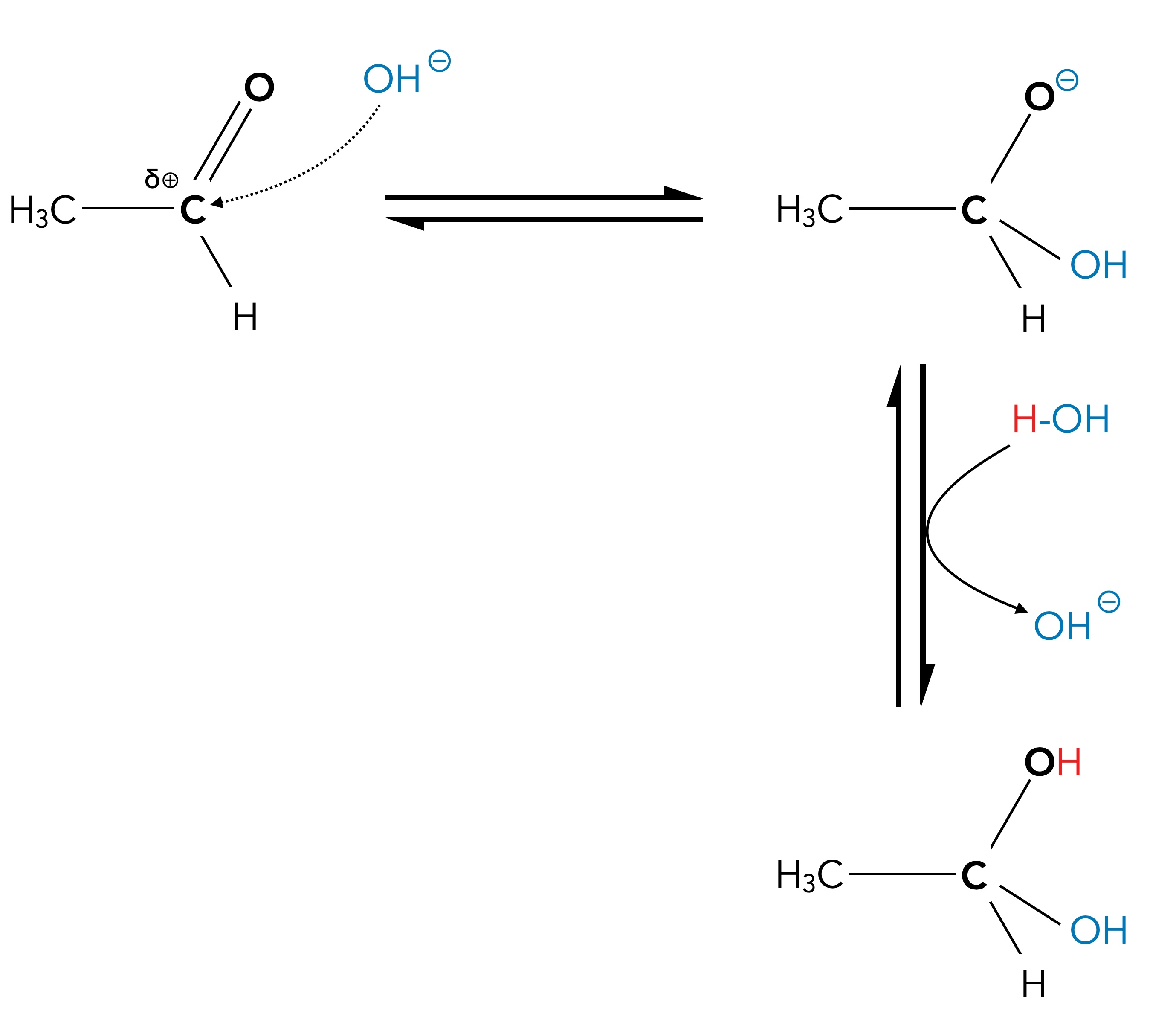
Grundschema der Addition von Wasser unter basischer Katalyse
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Im ersten Schritt lagert sich ein Hydroxid-Ion als starkes ionisches Nucleophil an das leicht positiv polarisierte C-Atom der C=O-Bindung an. Die mitgebrachte negative Ladung wird von dem elektronegativen O-Atom der C=O-Bindung übernommen. Das anionische Zwischenprodukt lagert dann im zweiten Schritt ein Proton als Elektrophil an, und fertig ist die Sache. Die Gesamtgleichung der Reaktion ist die selbe wie bei der sauren Katalyse, aber der Reaktionsmechanismus ist wesentlich einfacher.
Warum liegt hier eine Katalyse vor?
Erstens läuft die Reaktion nur dann ab, wenn Hydroxid-Ionen im Medium vorhanden sind.
Zweitens tauchen die Hydroxid-Ionen in der Reaktionsgleichung nicht auf:

Die Gesamtreaktion der H2O-Addition an Acetaldehyd bei basischer Katalyse.
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hydrate
Unbeständige Verbindungen
Die Reaktionsprodukte, die bei der Addition von Wasser an ein Aldehyd oder Keton entstehen, werden als Hydrate bezeichnet. Normalerweise sind solche Hydrate unbeständige Verbindungen, das chemische Gleichgewicht der Hydratbildung liegt stark auf der Eduktseite.
Chemische Gleichgewicht können aber durch einen Überschuss an Edukten auf die Produktseite verschoben werden (Prinzip des kleinsten Zwangs!). Und so ist es zum Beispiel nicht verwunderlich, dass der einfachste Aldehyd, das Methanal (auch als Formaldehyd bekannt), in einer wässrigen Lösung zu 100% als Hydrat vorliegt. Sobald man das Wasser jedoch durch Erhitzen oder auf andere Weise entfernt, bilden sich die Methanal-Moleküle zurück.
Beim nächst einfachen Aldehyd, dem Ethanal (auch als Acetaldehyd bekannt) liegen in einer wässrigen Lösung nur noch 58% der Moleküle als Hydrat vor. Reines Ethanal-Hydrat kann man aber unter normalen Bedingungen nicht isolieren. Sobald man das Wasser entfernt, bilden sich die Ethanal-Moleküle zurück.
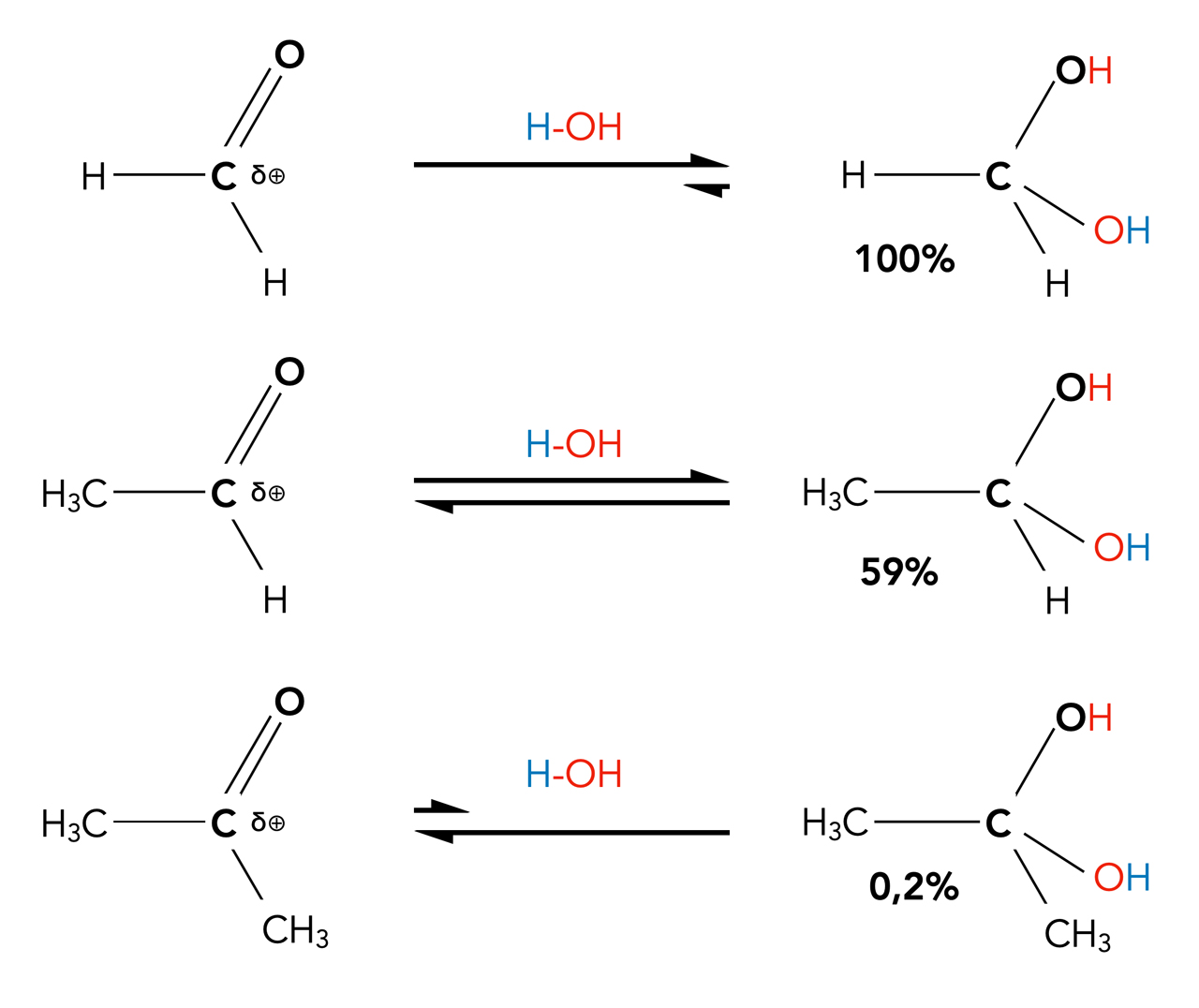
Lage des Gleichgewichts bei der Wasser-Addition bei Formaldehyd, Acetaldehyd und Aceton
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aufgabe
Die Gleichgewichtslage der Reaktion hängt offensichtlich von dem eingesetzten Aldehyd bzw. Keton ab.
Finden Sie eine Begründung für die unterschiedlichen Gleichgewichtslagen bei der Hydratisierung von Methanal, Ethanal und Aceton.
Lösungsvorschlag:
Ein Aldehyd oder Keton reagiert bei der Hydratisierung um so besser, je positiver polarisiert das Carbonyl-C-Atom ist. Beim Aceton wird die geringe Elektronendichte des C-Atoms durch die +I-Effekte von zwei Methylgruppen stark erhöht. Das C-Atom des Acetons ist am wenigsten positiv geladen, daher kann ein schwaches Nucleophil wie Wasser so gut wie nicht angreifen. Beim Methanal dagegen wird das positiv polarisierte C-Atom durch keinen +I-Effekt abgeschwächt. Die Reaktion verläuft hier vollständig.
Stabile Hydrate
Es gibt aber auch ein paar stabile Hydrate. In der Literatur wird immer wieder Chloralhydrat genannt, das erste synthetisch hergestellte Schlafmittel.
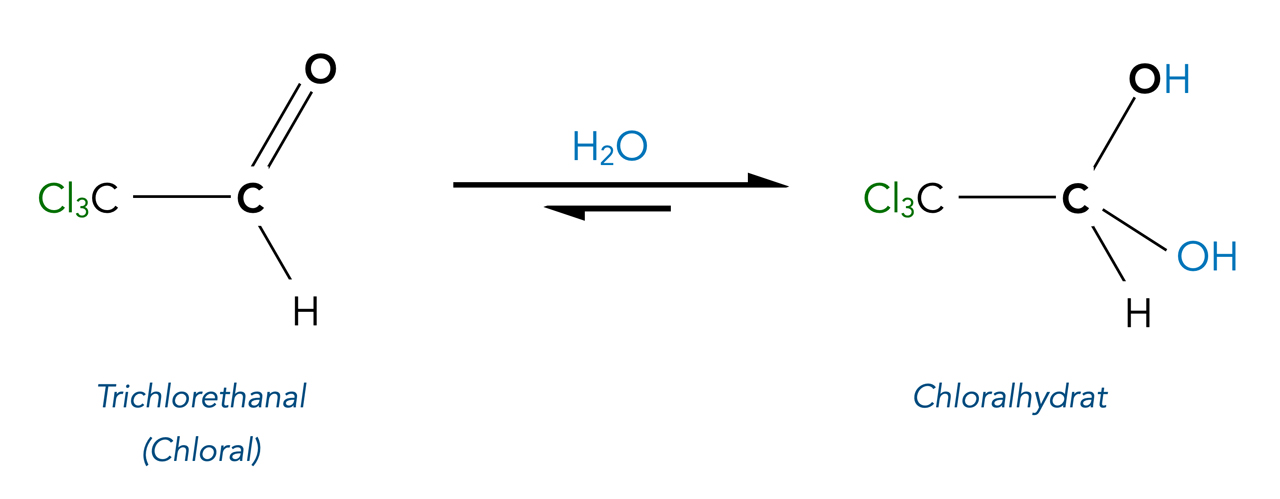
Bildung von Chloralhydrat
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Ein zweites bekanntes stabiles Hydrat ist Ninhydrin oder Triketoindanhydrat:
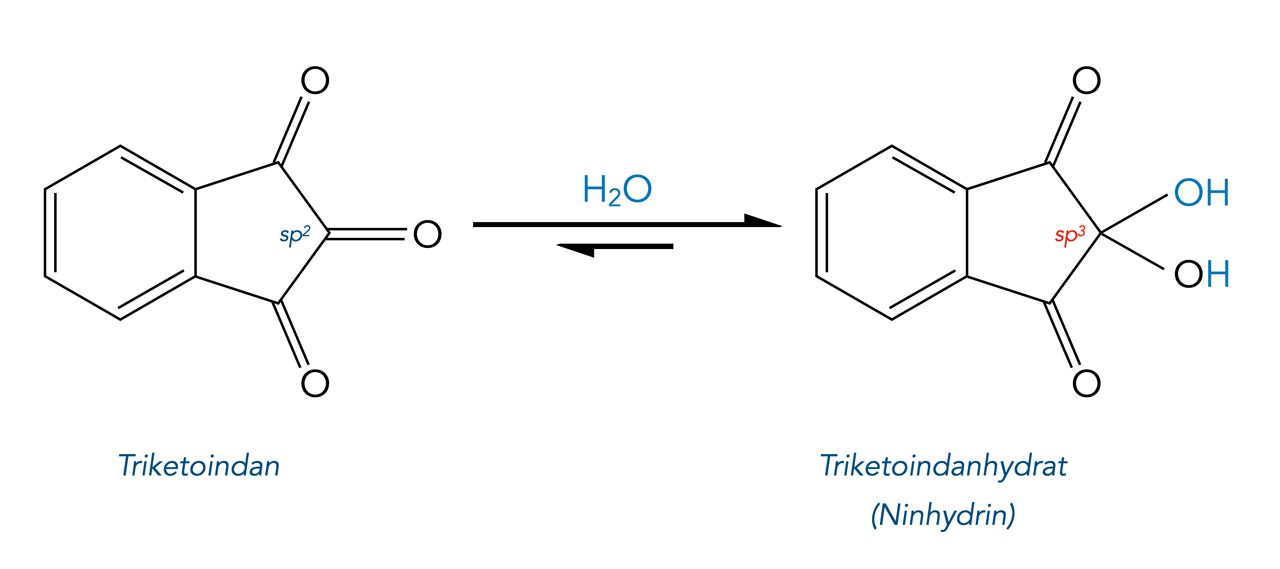
Bildung von Chloralhydrat
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wieso ausgerechnet dieses Hydrat besonders stabil ist, verwundert etwas.
Aufgabe
Finden Sie eine Begründung für die hohe Stabilität von Chloralhydrat und Ninhydrin.
Lösungsvorschlag:
Beim Chloralhydrat spielen die starken -I-Effekte der drei Chlor-Atome eine wichtige Rolle. Der dreifache -I-Effekt verringert nicht nur die Elektronendichte an dem C-Atom, das mit den drei Cl-Atomen verbunden ist, sondern der Effekt wirkt sich auch auf das Carbonyl-C-Atom aus. Die ohnehin schon vorhandene positive Polarisierung durch das Carbonyl-O-Atom wird so erheblich verstärkt, und auch schwache Nucleophile können das C-Atom gut angreifen.
Beim Ninhydrin könnten die beiden an den benachbarten C-Atomen sitzenden Sauerstoff-Atome einen ähnlichen negativen induktiven Effekt ausüben, so dass die Elektronendichte an dem mittleren Carbonyl-C-Atom verringert wird.
Allerdings wird der aromatische Charakter des Moleküls bei der Addition von Wasser teils aufgehoben, da eine Umhybridisierung des einen C-Atoms von sp2 nach sp3 stattfindet. Dieses Phänomen sollte die Reaktion eigentlich erschweren.
Seitenanfang -
Weiter mit der Addition von Alkoholen...