Zweiprotonige Säuren lassen sich ebenfalls mit einer Lauge titrieren. In diesem Versuch wollen wir die Titrationskurve der Reaktion einer schwachen zweiprotonigen Säure mit NaOH erstellen.
Versuch 13
Titration einer zweiprotonigen mittelstarken Säure
Durchführung:
Titrieren Sie 50 ml Oxalsäure der Konzentration 0,1 mol/l mit Natronlauge der Konzentration c(NaOH) = 0,1 mol/l. Lassen Sie die Natronlauge in Portionen von je 5 ml zufließen und notieren Sie anschließend das Volumen der verbrauchten Natronlauge sowie den pH-Wert (pH-Messgerät).
Stellen Sie die Wertpaare V(NaOH) / pH-Wert anschließend durch eine Kurve dar.
Beobachtungen:
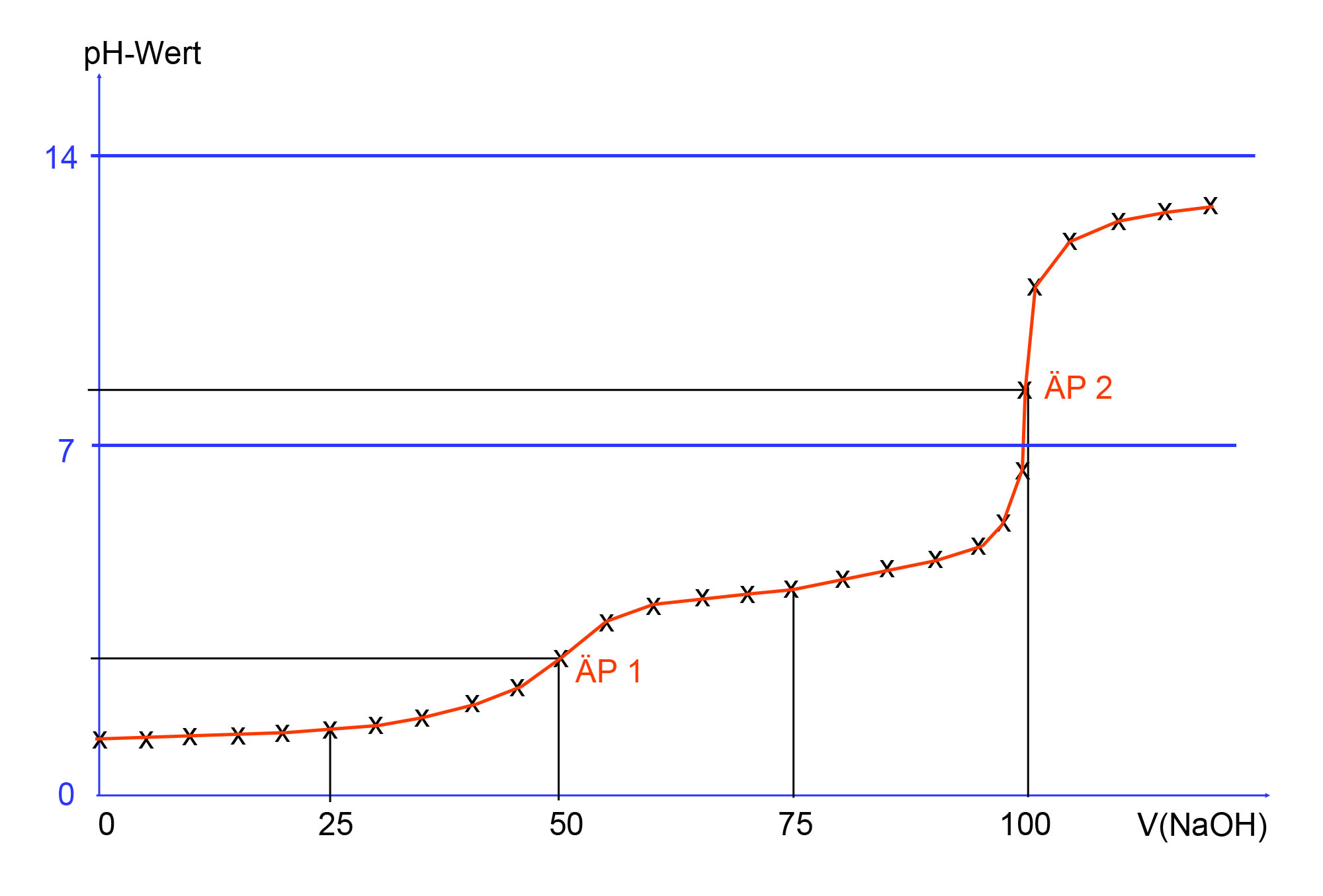
Zunächst nimmt der pH-Wert der Lösung so gut wie nicht zu, er bleibt bei ca. 2, dem pH-Wert der reinen 0,1-molaren Säure.
Nach ca. 25 ml NaOH-Zugabe steigt der pH-Wert deutlich an, die Zunahme flacht dann aber wieder ab. Erst bei ca. 90 ml NaOH-Zugabe steigt der pH-Wert wieder an, diesmal sehr steil, um nach Überschreitung des Äquivalenzpunktes dann wieder abzuflachen. Es wird ein Sättigungswert von 13 erreicht.
Erklärung der Versuchsergebnisse
Genau wie bei der Titration einer einprotonigen schwachen Säure gibt es auch hier ein kleines didaktisches Problem. Den Verlauf der Kurve vor dem Äquivalenzpunkt ÄP 2 kann man nur vernünftig erklären, wenn man sich mit dem Thema "Pufferlösungen" näher auseinander gesetzt hat. Dieses Thema wird aber erst im nächsten Kapitel angesprochen.
Auffällig ist, dass es bei der Titrationskurve zwei Äquivalenzpunkte gibt. Die Oxalsäure ist zweiprotonig. Man kann sich nun leicht vorstellen, dass die Oxalsäure-Moleküle am ersten Äquivalenzpunkt ihr erstes Proton abgegeben haben, und am zweiten Äquivalenzpunkt ihr zweites. Ganz so einfach ist dies allerdings nicht, da es sich um eine schwache Säure handelt, und die Gleichgewichte beider Protolysen weit auf der linken Seite liegen. Mit anderen Worten: Am ÄP 1 wird es weiterhin Oxalsäure-Moleküle geben, die noch beide Protonen besitzen, während einige wenige Moleküle auch schon beide Protonen verloren haben.
Eine richtige "Erklärung" der Versuchsergebnisse ist dies nicht; dazu müssten wir uns erst einmal über Pufferlösungen unterhalten haben.
Bei der dreiprotonigen Phosphorsäure kann man übrigens auch nur zwei Äquivalenzpunkte in der Titrationskurve erkennen. Der dritte Äquivalenzpunkt bei pH=12,3 und ist kaum noch zu erkennen. Auch der zweite Äquivalenzpunkt der Phosphorsäure ist nur schwer zu erkennen; man muss schon sehr sorgfältig experimentieren, um ihn überhaupt zu sehen.