Zielgruppe dieser Seite sind Schüler(innen) der Sekundarstufe II im Chemie-Grundkurs oder Leistungskurs.
Struktur
Alkane sind die einfachsten Kohlenwasserstoffe, da sie nur C-C- und C-H-Einfachbindungen besitzen. Sie sind wichtige Bestandteile des Erdöls und des Erdgases.
Aufgrund ihrer geradlinigen oder verzweigten Kettenstruktur und des Fehlens von funktionellen Gruppen weisen Alkane im Vergleich zu anderen organischen Verbindungen wie Alkoholen oder Aldehyden eine vergleichsweise geringe Reaktivität auf. Daher werden sie oft auch als Paraffine bezeichnet (lat. parum affinis = wenig reaktionsfähig).
Schauen wir uns doch einmal die Strukturformeln von ein paar dieser Alkane an:
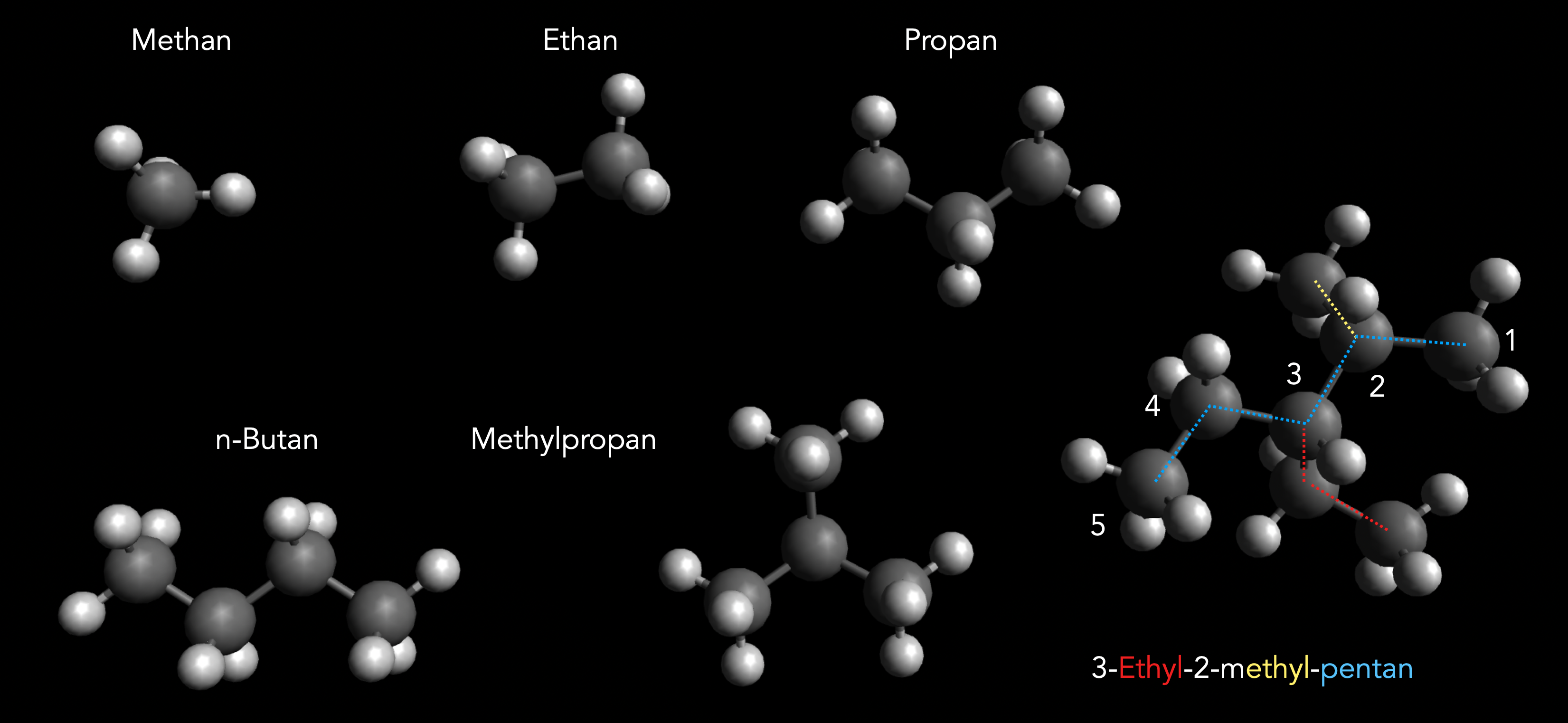
In der oberen Reihe sehen wir computergenerierte Molekülmodelle der drei einfachsten Alkane: Methan, Ethan und Propan.
In der unteren Reihe finden wir ganz links das vierte Alkan der homologen Reihe, das n-Butan. Warum schreibt man hier den Buchstaben 'n' vor den Namen des Alkans? Ganz einfach, weil es ein zweites Butan mit der Summenformel C4H10 gibt, nämlich das Methylpropan.
Das n-Butan und das Methylbutan haben die gleiche Summenformel C4H10, aber eine unterschiedliche Strukturformel. Solche nah verwandten Verbindungen bezeichnet man in der Chemie als Isomere.
Isomere = Verbindungen mit gleicher Summenformel, aber unterschiedlicher Strukturformel.
Das Alkan ganz rechts ist etwas komplizierter aufgebaut: An einer Pentankette (fünf C-Atome) hängen eine Methylgruppe an Position 2 und eine Ethylgruppe an Position drei. Dieses verzweigte Alkan wird daher als 3-Ethyl-2-methyl-pentan bezeichnet. Achten Sie darauf, dass man die Seitenketten alphabetisch ordnet, wenn man den Namen des Alkans bildet.
Merke
Alkane sind die einfachsten Kohlenwasserstoffe, sie haben nur C-C- und C-H-Einfachbindungen. Ab Butan C4H10 existieren von jedem Alkan mehrere Isomere. Das sind Verbindungen mit der gleichen Summenformel aber unterschiedlichen Strukturformeln. Alkane kommen im Erdöl und im Erdgas vor und zeichnen sich durch eine sehr geringe Reaktivität aus.
Nomenklatur der Alkane
Den Namen des 3-Ethyl-2-methyl-pentans haben wir ja bereits hergeleitet. Allgemein sucht man immer als Erstes die längste durchgehende Kohlenstoffkette in dem Alkan, das man benennen will. Wenn diese Kette aus fünf C-Atomen besteht, dann ist "pentan" der Name des Grundgerüstes. Besteht die Kette aus sieben C-Atomen, heißt das Grundgerüst "heptan" und so weiter. Wenn das Alkan nicht verzweigt ist, ist man eigentlich schon fertig. Man übernimmt dann den Namen des Grundgerüstes, schreibt den ersten Buchstaben aber groß:
- Methan
- Ethan
- Propan
- Butan
- Pentan
- Hexan
- Heptan
- Octan
- Nonan
- Decan
- Undecan
- Dodecan
Das sind die Namen der ersten 12 Alkane. Diese Namen sollten Sie sich sehr gut merken, egal ob Sie gerade in einem Chemiekurs der Oberstufe sitzen, eine Vorlesung "Chemie für Mediziner" besuchen oder sogar Erst- oder Zweitsemester in einem richtigen Chemie-Studium sind.
Wenn das Alkan verzweigt ist, benennt man als Nächstes die Seitenketten und sortiert sie alphabetisch. Die einfachste Seitenkette ist die Methylgruppe. Eine Seitenkette mit zwei C-Atomen wird als Ethylgruppe bezeichnet und so weiter.
Die dritte Aktion ist die korrekte Nummerierung der Seitenketten. Dabei ist darauf zu achten, dass die alphabetisch erste Seitenkette die kleinste Ziffer bekommt. Wenn Ihnen diese Ziffer zu groß erscheint, fangen Sie einfach an der anderen Seite der Hauptkette an zu zählen.
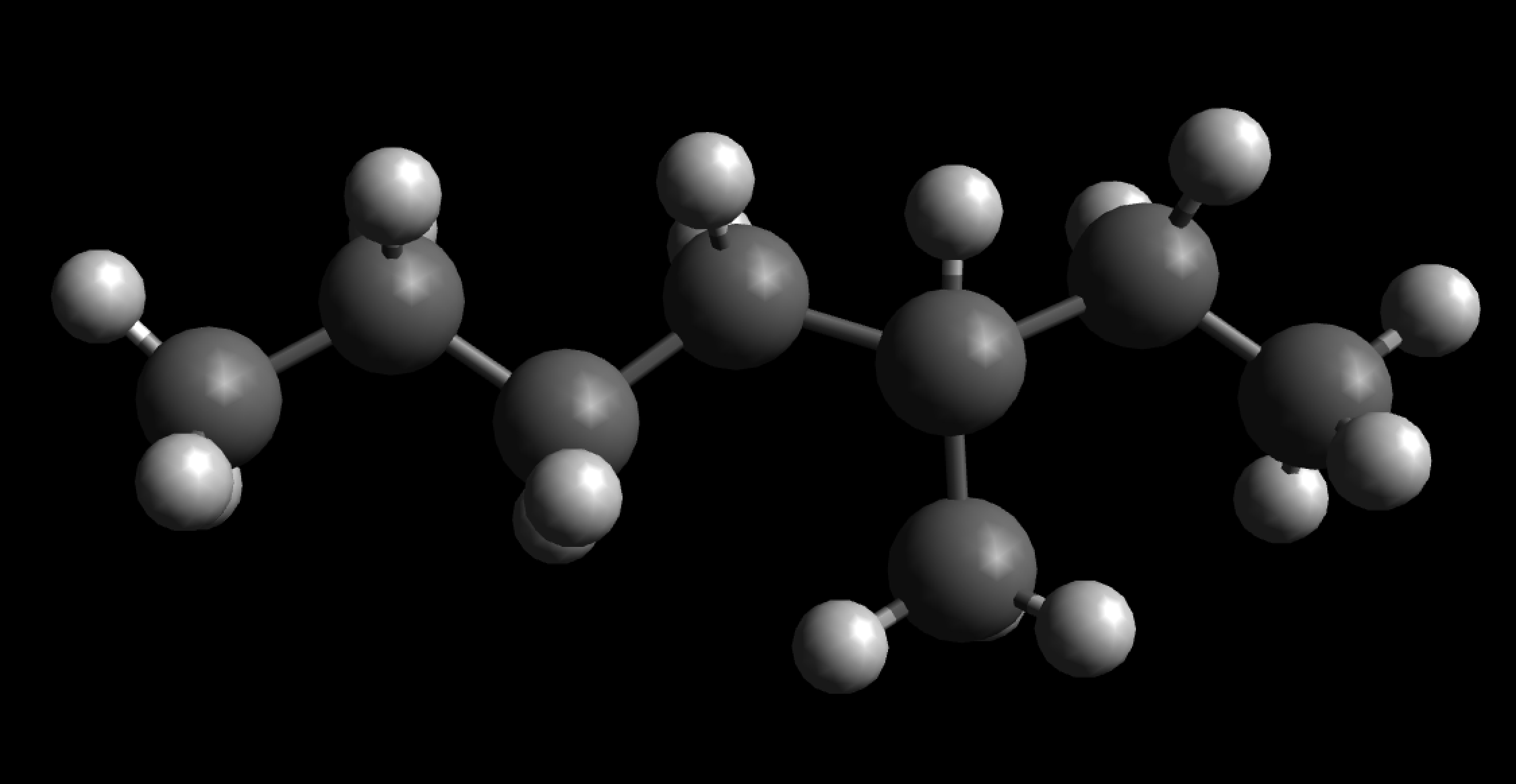
3-Methylheptan
Autor: Ulrich Helmich 12/2023, Lizenz: siehe Seitenende
Hier sehen wir eine Heptan-Kette mit einer Methylgruppe als Seitenkette. Dieses Alkan heißt nicht etwa 5-Methylheptan, sondern 3-Methylheptan. In diesem Fall fängt man nämlich auf der rechten Seite mit dem Zählen der C-Atome an.
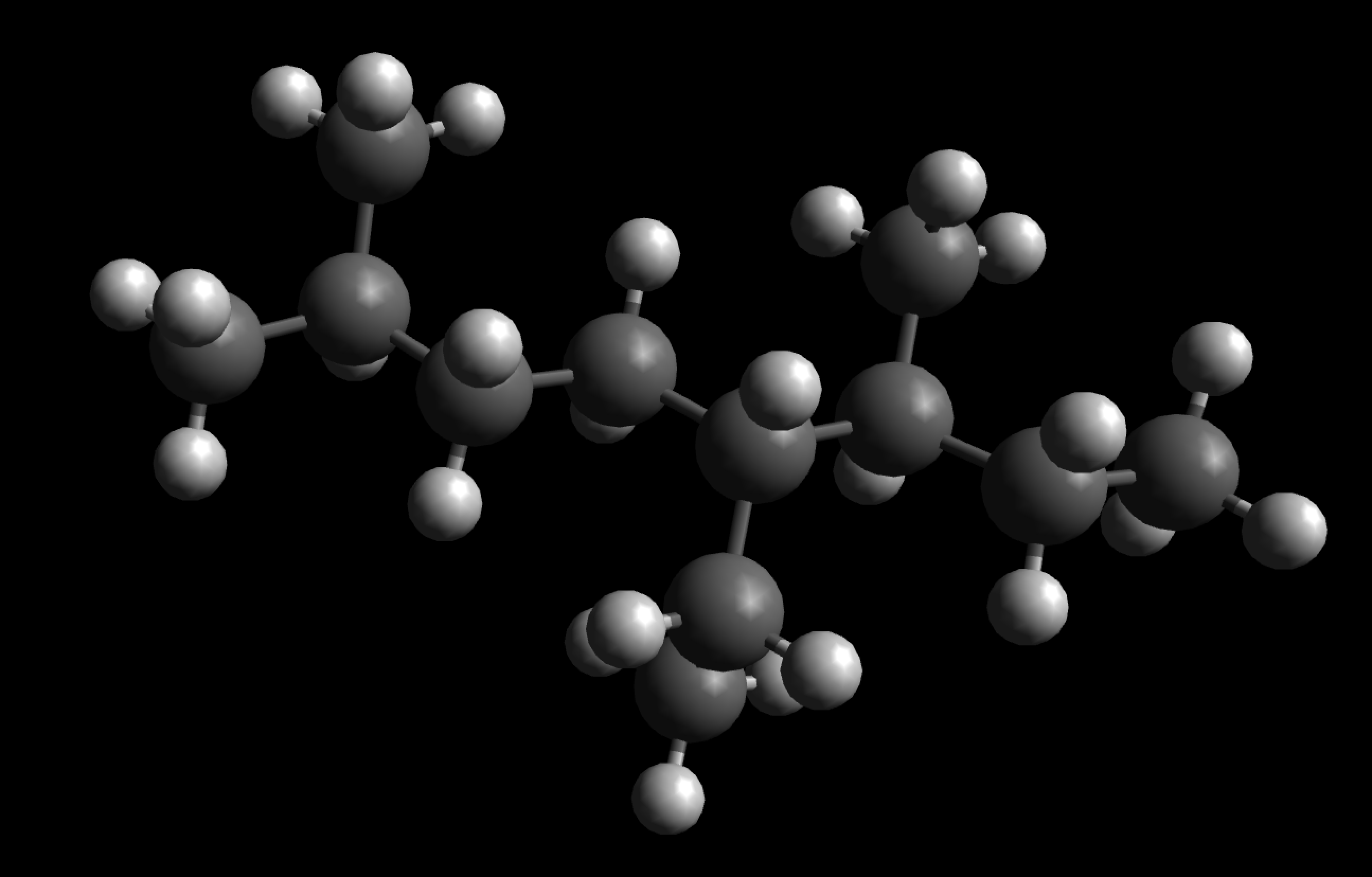
4-Ethyl-3,7-dimethyl-octan
Autor: Ulrich Helmich 12/2023, Lizenz: siehe Seitenende
Dieses "Monster" von Alkan wird als 4-Ethyl-3,7-dimethyl-octan bezeichnet. Die beiden Methylgruppen werden dabei als "dimethyl" zusammengefasst. Wie Sie an diesem Beispiel sehen können, wird "dimethyl" hinter "ethyl" eingeordnet, denn die Vorsilbe "di" für zwei gleiche Gruppen wird bei der alphabetischen Sortierung nicht berücksichtigt. Bei drei gleichen Gruppen verwendet man die Vorsilbe "tri", bei vier gleichen Gruppierungen "tetra".
Merke
Als erstes wird das Grundgerüst eines Alkans bestimmt: Man sucht die längste durchgehende Kohlenstoffkette. Dann werden die Seitenketten identifiziert, alphabetisch sortiert und nummeriert, so dass die alphabetisch erste Seitenkette eine möglichst niedrige Ziffer bekommt. Mehrfach vorkommende Seitenketten werden mit den Vorsilben "Di", "Tri" oder "Tetra" zusammengefasst.
Physikalische Eigenschaften der Alkane
Wegen der nur sehr schwach polaren C-H- und der völlig unpolaren C-C-Bindungen in einem Alkan-Molekül sind die Alkane unpolare Stoffe, die Moleküle der Alkane besitzen kein Dipol-Moment und werden nur durch sehr schwache intermolekulare Kräfte zusammengehalten, die oft fälschlicherweise als van-der-Waals-Kräfte bezeichnet werden. Richtiger ist es, von London-Kräften zu sprechen, die zusammen mit zwei weiteren schwachen Kräften zu den van-der-Waals-Wechselwirkungen gehören.
Da sich die Moleküle in einem festen oder flüssigen Alkan so gut wie kaum anziehen, sind die Schmelztemperaturen und Siedetemperaturen sehr niedrig. Auch die Dichten der flüssigen Alkane sind recht gering. Gibt man Hexan oder Heptan in einen Standzylinder mit Wasser, so schwimmt das Alkan immer oben und mischt sich auch nicht mit dem Wasser. Die Wasserlöslichkeit der Alkane ist also auch nur sehr niedrig. Das liegt daran, dass ein Alkan-Molekül überhaupt keine Wasserstoffbrücken-Bindungen mit Wasser-Molekülen bilden kann.
Merke
Alkane haben wegen ihrer nahezu unpolaren Bindungen nur sehr niedrige Schmelztemperaturen, Siedetemperaturen und Dichten. Die Wasserlöslichkeit ist extrem gering, weil die Alkan-Moleküle keine H-Brücken mit Wasser-Molekülen bilden können.
Chemische Eigenschaften der Alkane
Wie schon gesagt, sind die Alkane recht reaktionsträge. Das liegt daran, das die C-H-Bindungen in den Alkanen recht stabil sind, die Energie zur Spaltung einer solchen Bindung ist sehr hoch. C-C-Einfachbindungen lassen sich zwar etwas leichter spalten, aber die vielen H-Atome im Alkan schirmen die C-C-Einfachbindungen gegen angreifende Moleküle, Radikale oder Ionen ziemlich stark ab.
Zwei Arten von Reaktionen sind jedoch recht wichtig, nämlich die Oxidation und die Halogenierung.
Oxidation
Mit Luftsauerstoff reagieren die Alkane zu Kohlendioxid und Wasser. Am Beispiel von Heptan, einem Bestandteil von Brennstoffen wie Benzin, soll das einmal erarbeitet werden.
Die Summenformel von Heptan ist C7H16. Bei der Verbrennung sollten also sieben Moleküle CO2 entstehen, dafür werden sieben Sauerstoff-Moleküle O2 benötigt. Die 16 Wasserstoff-Moleküle des Heptans reagieren zu acht Wasser-Molekülen. Zur Bildung des Wassers werden vier Sauerstoff-Moleküle O2 benötigt.
Mit diesen Vorüberlegungen kommt man dann schnell zur Reaktionsgleichung
C7H16 + 11 O2 → 7 CO2 + 8 H2O
Bei der Oxidation von Alkanen mit Luftsauerstoff wird sehr viel Energie freigesetzt, daher eignen sich Alkane hervorragend als Brennstoffe für Heizungen (Erdgas, Erdöl) und Verkehrsmittel (Flugzeuge, Autos etc.). Auch zur Stromerzeugung werden Alkane in Form von Erdgas eingesetzt (Gaskraftwerke).
Halogenierung
Eine andere sehr wichtige Reaktion der Alkane ist die Umsetzung mit einem Halogen. Vor allem Chlor wird in der Industrie häufig eingesetzt, weil es leicht zu gewinnen ist (aus Kochsalz NaCl) und weil es daher auch relativ billig ist. Außerdem ist Chlor eine recht reaktive Substanz, die schnell bei niedrigen Temperaturen mit Alkanen reagiert.
Fluor ist zwar noch reaktiver, eignet sich aber für Synthesen weniger als Chlor, eben wegen dieser hohen Reaktivität. Fluor ist nämlich so reaktiv, dass es unkontrolliert mit dem Alkan zu allen möglichen Fluor-Alkanen reagiert.
Die Chlorierung dagegen lässt sich viel besser steuern, so dass man höhere Anteile der eigentlich gewünschten Endprodukte erhält und nicht alle möglichen Nebenprodukte wie bei der Fluorierung. Außerdem ist Fluor sehr gefährlich und lässt sich sehr schlecht handhaben. Durch die Chlorierung von Alkanen gewinnt man in der Industrie sehr viele wertvolle Rohstoffe für andere Reaktionen, zum Beispiel Chlorethan.
Im Schulunterricht wird oft die Bromierung von Hexan oder Heptan durchgeführt. Dazu gibt man etwas Hexan oder Heptan in einen Erlenmeyerkolben und fügt vorsichtig ein paar Tropfen flüssiges Brom hinzu. Dann stellt man den Erlenmeyerkolben auf einen Tageslichtprojektor und beobachtet. Nach ein paar Minuten hat sich die ursprünglich braune Lösung völlig entfärbt, es ist Bromhexan und Bromwasserstoff entstanden:
C6H14 + Br2 → C6H13Br + HBr
Merke
Alkane sind wichtige Brennstoffe, mit dem Luftsauerstoff reagieren sie zu Kohlendioxid und Wasser und setzen dabei sehr viel Energie frei. Außerdem reagieren Alkane heftig mit Chlor und sehr heftig und unkontrolliert mit Fluor. Auch mit Brom reagieren Alkane, allerdings so gemäßigt, dass man die Reaktion auch in der Schule einsetzen kann. In der Industrie werden Alkane hauptsächlich chloriert, und man gewinnt so viele wertvolle Rohstoffe für weitere Reaktionen.
Weiterführende Seiten
Wenn Sie sich stärker für das Thema "Alkane" interessieren, finden Sie auf dieser Homepage viele weiterführende Seiten.
Das ist die Titelseite zum Thema "Alkane" für Schüler(innen) in Leistungskursen, aber auch schon für Studienanfänger(innen) in dem Fach Biologie und anderen verwandten Naturwissenschaften.
Studienanfänger(innen) der Fächer Chemie und Pharmazie sollten sich diese Seiten anschauen, die noch etwas anspruchsvoller gestaltet sind als die oben erwähnten Nebenfach-Seiten.
Speziell für Studienanfänger(innen) des Fachs Medizin sind diese Seiten erstellt worden, die sich an dem aktuellen "IMPP-Gegenstandskatalog (IMPP-GK-1) für den schriftlichen Teil des Ersten Abschnitts der Ärztlichen Prüfung" beziehen.