Struktur
Die Cycloalkane sind Kohlenwasserstoffe wie Alkane, die aber ringförmig geschlossen sind und daher die allgemeine Summenformel CnH2n besitzen, im Gegensatz zu den offenkettigen Alkanen mit der allgemeinen Summenformel CnH2n+1.
Schauen wir uns gleich mal ein paar dieser Cycloalkane im Bild an:

Die Cycloalkane von Cyclopropan bis Cycloheptan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Zunächst betrachten wir das Cyclopentan C5H10 in drei verschiedenen Darstellungen: Einmal als Kugel-Stab-Modell, dann als Strukturformel und schließlich als einfache Skelettformel. In der Reihe darunter sehen wir das einfachste Cycloalkan, nämlich Cyclopropan, gefolgt vom Cyclobutan, dem Cyclohexan und dem Cycloheptan. Vor kurzem hat man das längste Cycloalkan der Welt hergestellt, nämlich C288H576 [2].
Nomenklatur der Cycloalkane
Zu diesem Thema finden Sie eine eigene Seite in dieser Abteilung.
Physikalische Eigenschaften
Im Grunde ähneln die physikalischen Eigenschaften (Siedepunkt, Schmelzpunkt, Dichte, Wasserlöslichkeit etc.) denen der entsprechenden offenkettigen (aliphatischen) Alkane.
Auf dieser Seite finden Sie nähere Informationen zu den physikalischen Eigenschaften der Alkane.
Ganz exakt allerdings gleichen sich die physikalischen Eigenschaften von beispielsweise Pentan und Cyclopentan nicht. Vergleichen wir einmal die Schmelzpunkte von drei Alkanen und den entsprechenden Cycloalkanen.
Propan: -187,7 ºC / Cyclopropan: -127,62 ºC
Butan: -138,3 ºC / Cyclobutan: -90,73 ºC
Pentan: -130 ºC / Cyclopentan: -94 ºC
Wir sehen, die Schmelzpunkte der Cycloalkane liegen erheblich höher als die der entsprechenden Alkane. Um das zu verstehen, stellt man sich am besten ein tiefgefrorenes Alkan im festen Zustand vor, bei einer Temperatur von -200 ºC. Um Butan zu schmelzen, müssen wir jetzt erhitzen, bis die Temperatur auf -138,3 ºC gestiegen ist, um die Anziehungskräfte zwischen den Butan-Molekülen zu überwinden. Das Cyclobutan müssen wir viel stärker erhitzen, nämlich auf -90,73 ºC. Offensichtlich sind die schwachen chemischen Bindungen zwischen den Cyclobutan-Molekülen stärker als die zwischen den Butan-Molekülen. Die Ursache für die stärkeren London-Kräfte zwischen den Cyclobutan-Molekülen ist die ringförmige Struktur derselben.
Wenn Sie einmal versuchen, ein Cyclobutan-Molekül selbst zu bauen, dann merken Sie, wie starr und fest ein solches Modell ist. Ein Butan-Modell ist dagegen viel "wackeliger", die CH3- und CH2-Gruppen lassen sich um die C-C-Einfachbindungen sehr leicht drehen, so dass ein Butan-Molekül viele verschiedene Konformationen annehmen kann. Beim Cyclobutan ist dies nicht möglich, es gibt nur eine "vernünftige" energiearme Konformation, und das ist das regelmäßige Viereck. Solche regelmäßig geformten Moleküle haben eine deutlich größere Kontaktfläche als unregelmäßig geformte, und das erklärt die höheren London-Kräfte zwischen den Molekülen und somit die höheren Schmelzpunkt, Siedepunkte und Dichten der Cycloalkane.
Ringspannung
Kommen wir jetzt zu einem Thema, das ganz neu ist; bei den offenkettigen Alkanen gab es das Phänomen der Ringspannung überhaupt nicht.
Haben Sie schon einmal versucht, mit einem Molekülbaukasten ein Cyclopropan-Molekül zu bauen? Ist Ihnen das unfertige Modell dabei auch schon mal regelrecht aus den Händen gesprungen, weil sich die eine C-C-Einfachbindung, die Sie gerade fertig gebracht haben, wieder aufgesprungen ist? Dann haben Sie gemerkt, wie viel Energie in einem solchen engen Ring aus C-Atomen gespeichert ist. Diese Energie bezeichnet man als Ringspannung.
Zustandekommen der Ringspannung
Zunächst einmal kann man sich auf rein mathematischem Wege klar machen, wie die Ringspannung zustande kommt. Im Cyclopropan sind alle C-Atome tetraedrisch aufgebaut (für Experten: sp3-hybridisiert). Die Bindungswinkel eines solchen C-Atoms entsprechen dem Tetraederwinkel von 109,5º. In einem gleichseitigen Dreieck haben die Winkel aber einen Wert von 60º.

Überlappung der Orbitale im Cyclopropan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Hier sehen wir links ein tetraedrisches C-Atom, zwei der Kugelwolken bzw. sp3-Hybridorbitale sind eingezeichnet. Rechts sehen wir das Cyclopropan-Molekül in der Aufsicht. Die Kugelwolken bzw. Orbitale der drei C-Atome überlappen sich nur sehr schwach. Damit überhaupt eine "vernünftige" Bindung zustande kommt, "verbiegen" sich die Orbitale der C-Atome so, dass sie Winkel von 104º bilden [2]. Dann ist die Überlappung etwas stärker als in dem Bild rechts gezeigt, und die Bindung zwischen den C-Atomen ist etwas stabiler.
Experimentell konnte man die geringere Orbital-Überlappung durch Messung der Bindungsdissoziationsenergien für die C-C-Einfachbindung nachweisen. In Alkanen wie Ethan oder Propan beträgt diese Energie 377 kJ/mol, im Cyclopropan hat man jedoch nur 272 kJ/mol gemessen[2], also deutlich weniger.
Die Verbrennungsenthalpien der Cycloalkane
Betrachten wir einmal die Verbrennungsenthalpien offenkettiger Alkane; die Daten kommen aus und wurden gerundet [2]:
- Propan: -2220 kJ/mol
- Butan: -2876 kJ/mol
- Pentan: -3536 kJ/mol
- Hexan: -4195 kJ/mol
Die vier Alkane unterscheiden sich jeweils durch eine Methylengruppe (-CH2-). Wir können also leicht ausrechnen, wie stark sich die Verbrennungsenthalpie ΔHoVerbr jeweils ändert.
- Vom Propan zum Butan um -656 kJ/mol
- Vom Butan zum Pentan um -660 kJ/mol
- Vom Pentan zum Hexan um -659 kJ/mol
Im Durchschnitt sind das also rund -658 kJ/mol pro Methylengruppe. Heptan müsste dann eine Verbrennungsenthalpie von 7 x 658 = -4606 kJ/mol haben.
Cycloalkane bestehen ausschließlich aus Methylengruppen, es gibt keine CH3-Gruppen, welche die Berechnung der Verbrennungsenthalpie schwieriger machen. Legen wir jetzt für jede Methylengruppe einen Wert von 658 kJ/mol zu Grunde, dann müsste Cyclopropan eine Verbrennungsenthalpie von 3 x 658 = 1974 kJ/mol haben. Entsprechend berechnen wir für die anderen drei Cycloalkane Werte von 2632, 3290 und 3948 kJ/mol.
Schauen wir uns jetzt die experimentell ermittelten Verbrennungsenthalpien der entsprechenden Cycloalkane an:
- Cyclopropan: -2091 kJ/mol
- Cyclobutan: -2744 kJ/mol
- Cyclopentan: -3320 kJ/mol
- Cyclohexan: -3952 kJ/mol
Die Abweichungen der gemessenen von den berechneten Werten stellen wir einmal graphisch dar:

Theoretische (rot) und gemessene (blau) Verbrennungsenthalpien der ersten vier Cycloalkane
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Es fällt auf, dass die Differenz zwischen den berechneten und den tatsächlich gemessenen Verbrennungsenthalpien vom Cyclopropan zum Cyclohexan immer geringer wird.
Was wird auch immer geringer, wenn Sie Molekülmodelle von Cyclopropan, -butan, -pentan- und -hexan bauen? Die Ringspannung! Offensichtlich ist die ermittelte Differenz auf die Ringspannung der Cycloalkane zurückzuführen.
Die Ringspannung wird von drei Kräften bestimmt
Bindungswinkelspannung
Der erste Faktor, der die Ringspannung beeinflusst, ist die sogenannte Bindungswinkelspannung. Das ist "die Energie, die benötigt wird, um die tetraedrischen Kohlenstoffatome so weit zu verzerren, dass der Ringschluss möglich ist" [2]. Andere Autoren sprechen von einer Winkeldeformation oder Baeyer-Spannung.
Besonders stark wirkt dieser Faktor beim Cyclopropan, wie wir bereits im vorherigen Abschnitt gesehen haben. Nochmal zur Wiederholung: Ein gleichseitiges Dreieck hat Winkel von 60 Grad, ein tetraedrisches C-Atom dagegen bildet Bindungswinkel von 109,5 Grad aus. Im Cyclopropan findet man experimentell einen Orbitalwinkel von 104 Grad, mehr kann sich das C-Atom aber nicht "verbiegen". Die sp3-Hybridorbitale überlappen also nur sehr schwach, geringste Einflüsse von außen "sprengen" die schwachen C-C-Bindungen (siehe Abbildung 2).
Konformative Spannung
Der zweite Faktor, der sich auf die Ringspannung auswirkt, ist die konformative Spannung, die auch als Pitzer-Spannung. bezeichnet wird. Betrachten Sie einmal das Ethan-Molekül, das ja in vielen Konformationen vorkommen kann, von denen zwei sogar einen eigenen Namen haben:
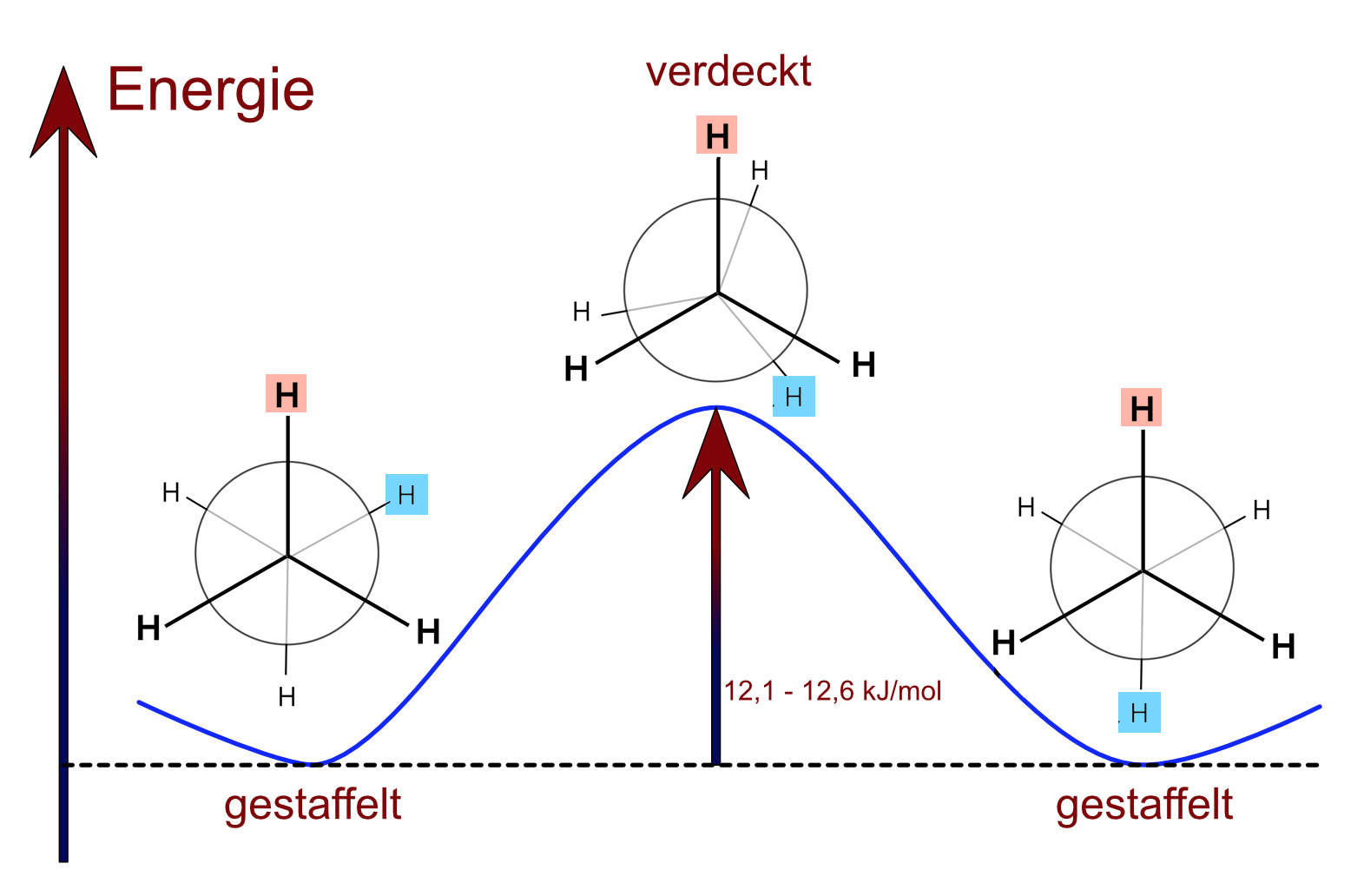
Die gestaffelte und die verdeckte Konformation des Ethan-Moleküls
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Die verdeckte Konformation hat eine etwas höhere Energie als die gestaffelte, weil sich die Bindungselektronen der C-H-Bindungen näher kommen und sich daher eher abstoßen als in der gestaffelten Konformation.
Wenn wir uns nun ein Cyclopropan-Molekül zusammenbauen:

Das Cyclopropan-Molekül
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Man sieht sofort, dass die H-Atome in einer verdeckten Konformation vorliegen, die Bindungselektronen der C-H-Bindungen kommen sich also sehr nahe, was zu einer gewissen Abstoßung führt.
Für Cyclopropan hat die Baeyer-Spannung einen Anteil von 78 kJ/mol und die Pitzer-Spannung einen Anteil von 38 kJ/mol an der Ringspannung von 116 kJ/mol.
Bei größeren Ringen gibt es noch einen dritten Faktor, der die Ringspannung beeinflusst.
Transannulare Wechselwirkung

Ein Cycloalkan mit 12 C-Atomen
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Hier sehen wir ein großes Cycloalkan, ein Cyclododecan mit 12 C-Atomen. Die weißen Pfeile deuten an, dass sich hier die Elektronenwolken nicht-benachbarter, relativ weit entfernter H-Atome "in die Quere" kommen. Solche Wechselwirkungen, die nur bei großen Ringen vorkommen, bezeichnet man als transannulare Wechselwirkung oder Prelog-Spannung.
Bei großen Ringen spielen die beiden anderen Faktoren so gut wie keine Rolle mehr, große Ringe ähneln im Prinzip langen Ketten, deren Enden sich zusammengeschlossen haben. Eine verdeckte Konformation kann hier durch relativ freies Drehen um die C-C-Achsen leicht vermieden werden, so dass eie Pitzer-Spannung (konformative Spannung) recht klein ist. Ebenso tritt kaum eine Baeyer-Spannung (Winkeldeformation) auf, die Bindungswinkel betragen 109,5 Grad oder sind zumindest nicht weit davon entfernt.
Zwei Cycloalkane werden auf meiner Homepage besonders ausführlich besprochen, nämlich Cyclopentan und Cyclohexan. Wenn Sie sich dafür interessieren, besuchen Sie doch bitte die entsprechenden Lexikonseiten.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.