Benzolstruktur
Die meisten aromatischen Verbindungen, die im Chemieunterricht behandelt werden, haben eine Gemeinsamkeit - den Benzolring. Dieser besteht aus sechs Kohlenstoff- und sechs Wasserstoff-Atomen und enthält drei C=C-Doppelbindungen.
Eigentlich müsste der Benzolring völlig schief sein
Eine C-C-Einfachbindung hat eine Länge von genau 154 pm und eine C=C-Doppelbindung eine Länge von 134 pm. Ein Benzol-Molekül müsste also so aussehen:
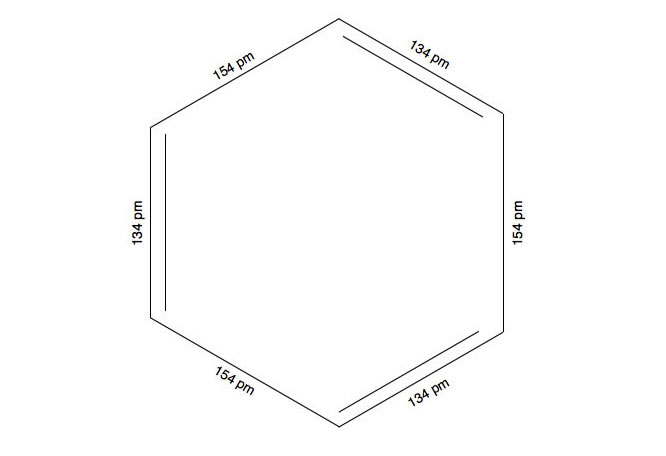
Ein völlig schiefer Benzolring
Analysen des Benzol-Moleküls haben aber ergeben, dass alle sechs C-C-Bindungen eine einheitliche Länge von 139 pm besitzen. Das Benzol-Molekül sieht also in Wirklichkeit so aus:
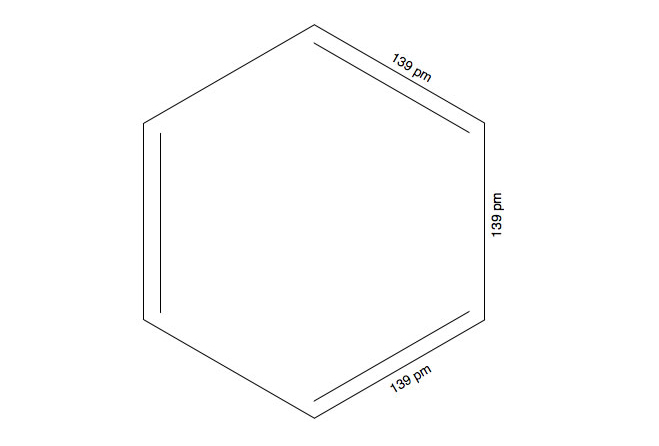
Das tatsächliche Aussehen des Benzolrings
Der aufmerksamen Betrachterin wird jetzt etwas auffallen: Die C-C-Einfachbindungen sind im Benzol-Molekül genau so lang wie die C=C-Doppelbindungen. Und diese einheitliche Bindungslänge von 139 pm liegt genau zwischen der Länge einer C-C-Einfachbindung (154 pm) und der Länge einer C=C-Doppelbindung (134 pm).
Da stellt sich doch die Frage, was sind das für komische Bindungen im Benzol-Molekül? Handelt es sich überhaupt um richtige C-C-Einfachbindungen und C=C-Doppelbindungen? Mit unserem Kugelwolkenmodell, das sich bisher in der gesamten Oberstufenchemie gut bewährt hat, kann man diese Tatsache leider nicht erklären.
Gut, dieses Problem können wir hier noch nicht lösen, wir kommen später dazu. Beschäftigen wir uns zunächst mit eher praktischen Aspekten wie zum Beispiel den Eigenschaften von Benzol.
Eigenschaften von Benzol
Benzol ist die einfachste aromatische Verbindung überhaupt. Leider ist die Verwendung von Benzol in der Schule verboten, weil der Stoff höchst gefährlich ist. Er steht in Verdacht, Krebs zu erzeugen[1] und andere gesundheitliche Schäden hervorzurufen.
Gefährlich für den menschlichen Körper ist Benzol vor allem dessen, weil es ein hervorragendes Lösemittel für Lipide ist[3]. Alle Zellmembranen bestehen aus Lipiden (Lipid-Doppelschicht, Biologie-Unterricht EF!).
Als Ersatzstoff für Benzol wird Toluol C6H5-CH3 verwendet, das ähnliche Eigenschaften hat wie Benzol - aber auch nicht ganz ungefährlich ist. Trotzdem darf Toluol bereits in der Sekundarstufe I eingesetzt werden, denn die offizielle Tätigkeitsbeschränkung betrifft nur Schüler bis zur Jahrgangsstufe 4[2].
Geschichte
Michael Faraday isolierte im Jahre 1825 eine neue, bisher unbekannte Verbindung, als er mit Walölen experimentierte. In den Londoner Straßenlaternen wurde damals Walöl verbrannt, und bei dieser Verbrennung bildeten sich flüssige Rückstände. Aus diesen flüssigen Rückständen isolierte Faraday dann das Benzol, das er aber als "Pheno" bezeichnete. Der Name "Benzol" wurde dann 1834 von Justus von Liebig eingeführt. Ebenfalls 1834 fand Eilhard Mitscherlich die Summenformel C6H6 heraus.[3].
Strukturaufklärung
Die Aufklärung der Benzolstruktur dauerte recht lange und verlief ziemlich kontrovers. Dieses Thema ist aber für den Chemie-Unterricht höchst interessant, weil man hier exemplarisch darlegen kann, wie Chemiker systematisch vorgehen, wenn sie die Struktur eines unbekannten Stoffes aufklären wollen. Dieses Thema habe ich daher auf den nächsten Webseiten ausführlich dargestellt.
Weitere Einzelheiten
Ich kann hier nicht sämtliche Einzelheiten zum Thema "Benzol" auflisten, das hat die Wikipedia bereits viel besser gemacht. Wer sich also wirklich für das Vorkommen, die Herstellung, die Eigenschaften, die Verwendung etc. von Benzol interessiert, sollte sich diesen langen Artikel mal anschauen. Eine deutlich kürzere und schülergerechtere Darstellung findet sich auf der Seite von Thomas Seilnacht, die ich nur empfehlen kann.
Quellen:
- Umweltbundesamt, Artikel "Benzol", abgerufen am 30. August 2019
- Gefahrstoffverordnung auf www.Sichere-Schule.de, abgerufen am 30. August 2019
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
Weiter mit der Aufklärung der Benzolstruktur...