Addition von H2O an Alkene
Im Wasser kommen stets auch ein paar Protonen vor (Autoprotolyse!), allerdings an Wasser-Moleküle gebunden in Form von Oxonium-Ionen H3O+. Diese Oxonium-Ionen können das gebundene Proton auch jederzeit wieder abgeben, zum Beispiel an andere Wasser-Moleküle oder an organische Moleküle, die sich in der wässrigen Lösung befinden, wie beispielsweise gelöste Alkene. Es entstehen dann Carbenium-Ionen, die dann wieder von Nucleophilen angegriffen werden können. Ein bekanntes Nucleophil ist das Hydroxid-Ion OH-, das ja auch im Wasser vorkommt (wieder Autoprotolyse!). Lagert sich ein solches Hydroxid-Ion an ein Carbenium-Ion an, entsteht ein Alkohol-Molekül:
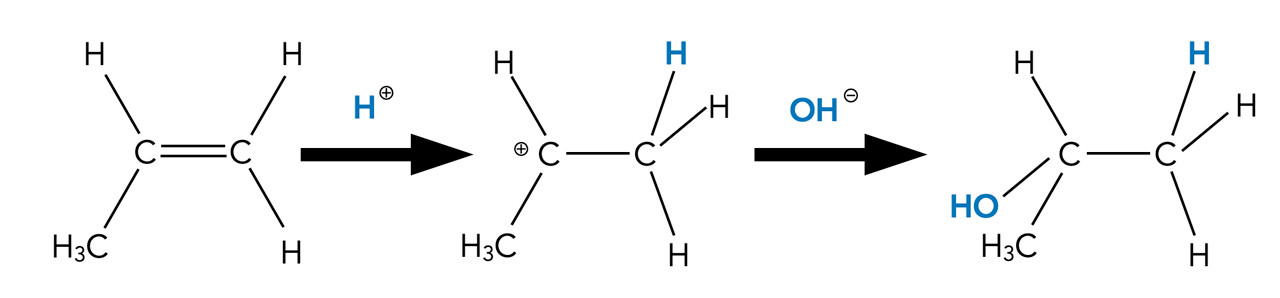
Hydratisierung von Propen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Allerdings läuft diese Reaktion sehr langsam ab. Wesentlich schneller geht es zur Sache, wenn man die Lösung ansäuert, zum Beispiel mit verd. Schwefelsäure. Die Reaktionsschritte sehen dann so aus:
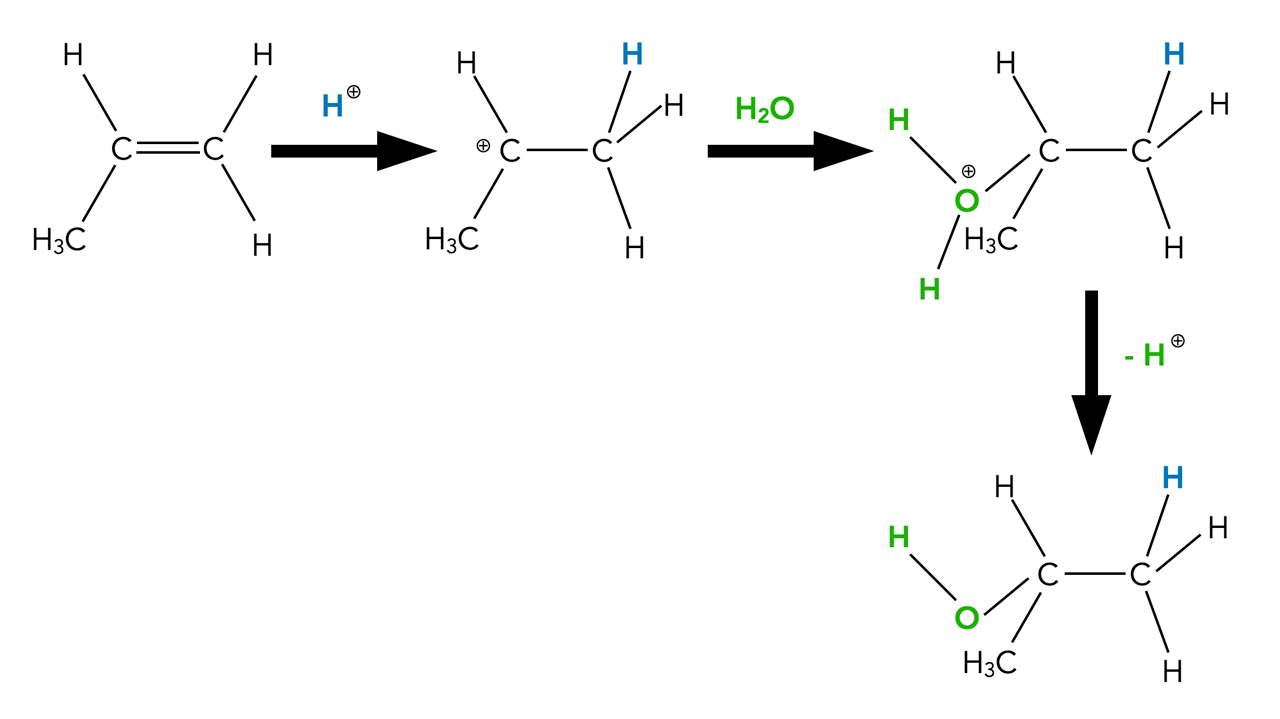
Säurekatalysierte Hydratisierung von Propen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das aus der Säure stammende Proton lagert sich an das Alken an und bildet ein Carbenium-Ion. Als Nucleophil greift jetzt kein Hydroxid-Ion an, sondern das neutrale Nucleophil H2O. Es entsteht ein instabiles Zwischenprodukt mit einer -OH2+-Gruppe. Diese Gruppe (vergleichbar mit dem Oxonium-Ion) gibt nun ein Proton ab, und dann haben wir wieder einen Alkohol als Endprodukt.
Im ersten Schritt der Reaktionskette wurde ein Proton hinzugefügt, im letzten Schritt wurde eines abgegeben. In der Gesamtgleichung tauchen diese Protonen daher nicht auf, und rein formal handelt es sich um eine saure Katalyse. Die Protonen nehmen zwar an der Reaktion teil, tauchen aber nicht in der Gesamtgleichung auf.
Die H2O-Addition ist reversibel
Eine beliebte Methode zur Synthese von Alkenen ist die Dehydratisierung eines Alkohols. Dies ist nicht nur formal eine Umkehrreaktion der Hydratisierung, sondern tatsächlich sind alle Einzelschritte der säurekatalysierten Hydratisierung reversible Gleichgewichtsreaktionen. Wir müssen also die Abbildung 1 etwas genauer zeichnen:
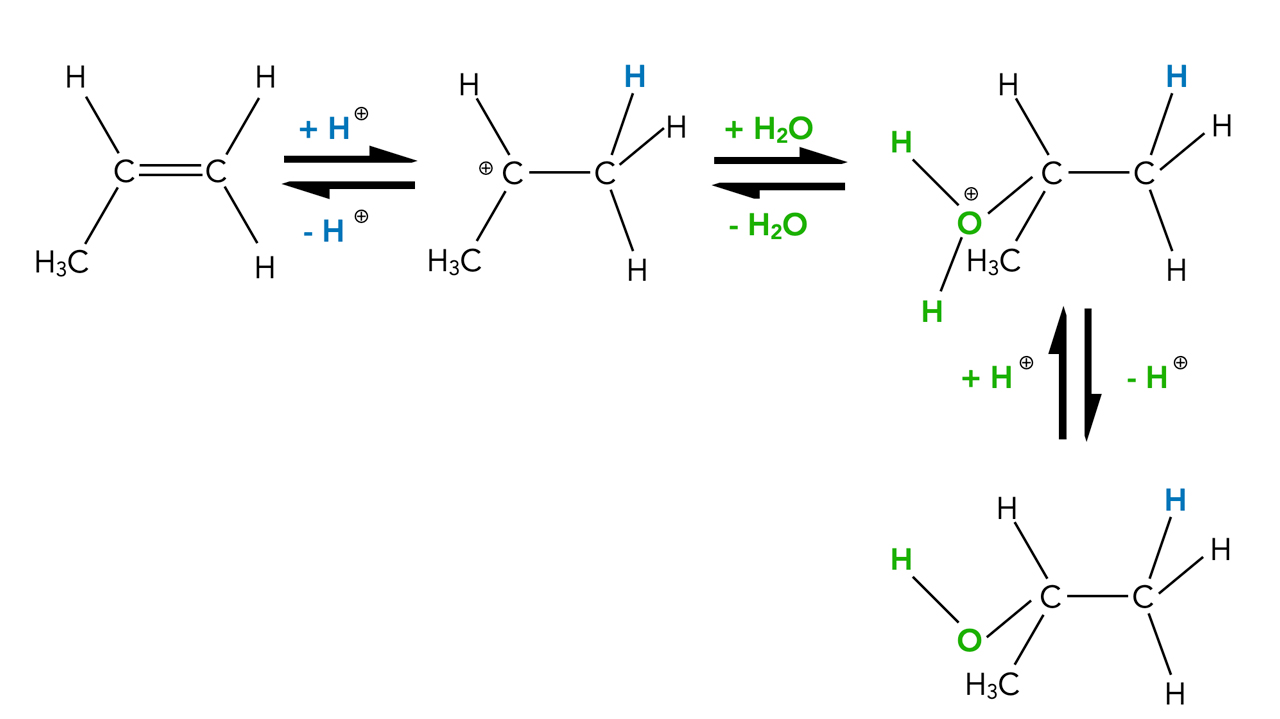
Säurekatalysierte Hydratisierung von Propen bzw. Dehydratisierung von Propan-2-ol
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Formal handelt es sich bei der Umkehrreaktion um eine Eliminierungsreaktion, genauer gesagt, um eine E1-Eliminierung.
Auf dieser Seite erfahren Sie weitere Einzelheiten zu diesem Reaktionstyp.
Das chemische Gleichgewicht dieser Reaktion lässt sich durch die Reaktionsbedingungen beeinflussen. Bei niedrigen Temperaturen und einem hohen Überschuss an Wasser wird das Gleichgewicht auf die Seite des Alkohols verschoben. Durch hohe Temperaturen und Verwendung konzentrierter Säure verschiebt sich das Gleichgewicht dagegen auf die Seite des Alkens.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.