Aldolkondensationen sind ein wichtiger Reaktionstyp der organischen Chemie und der Biochemie, und wenn man das Grundprinzip der nucleophilen Addition verstanden hat, sollte man auch mit diesem durchaus komplexen Reaktionstyp keine großen Probleme haben.
Im Chemie-Unterricht der Qualifikationsphase habe ich selbst oft einen schönen Versuch zur Synthese von Dibenzalpropanon durchgeführt, den ich in einem alten DDR-Chemiebuch gefunden habe.
Auf dieser Seite wird der Versuch ausführlich beschrieben.
Die Bildung von Dibenzalpropanon aus Aceton
Das folgende Reaktionsschema zeigt die einzelnen Teilschritte dieser Synthese:
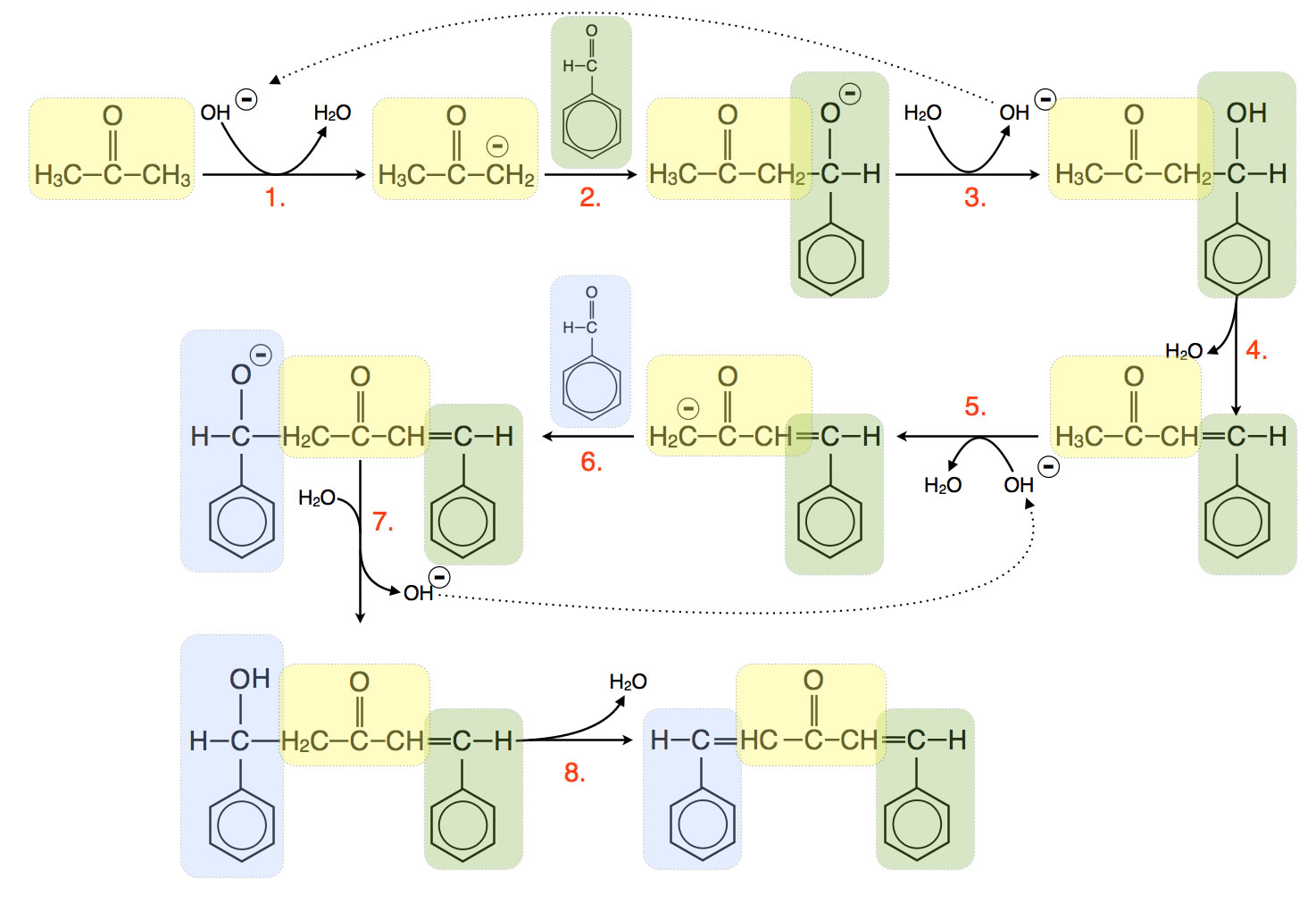
Die Synthese von Dibenzalpropanon in acht Schritten
Autor: Ulrich Helmich 2022, Lizenz: CC BY-NC-SA 4.0
Wir wollen uns diese Teilschritte nun einmal etwas näher ansehen. Die folgende Beschreibung ist sehr ausführlich. Wer es lieber etwas prägnanter möchte, kann ja auf die entsprechende Seite in der Studienvorbereitung Organik gehen:
Diese Seite wurde für Studienanfänger(innen) des Fachs Chemie geschrieben. Aber auch engagierte LK-Schüler(innen) sowie Studierende der Fächer Medizin und Biologie sind herzlich eingeladen, sich diese Ausführungen anzusehen.
Sie sind auf dieser Seite geblieben? Sehr schön, dann können wir die vier Schritte ja mal eingehend erläutern.
Schritt 1
Ein Aceton-Molekül gibt ein Proton an die starke Base OH-- ab. Zurück bleibt ein Aceton-Molekül mit einer negativ geladenen CH2--Gruppe.
Wenn Sie im Chemie-Unterricht gut aufgepasst haben, dann sollten Sie sich sehr wundern, wieso Aceton hier als Brönsted-Säure auftreten kann. H-Atome, die an C-Atome gebunden sind, können normalerweise nicht als Protonen abgegeben werden. Alkane und verwandte organische Verbindungen sind keine Protonenspender bzw. Brönsted-Säuren! Der pKS-Wert eines normalen Alkans liegt bei 50, entsprechend winzig ist der KS-Wert, der ja für die Stärke einer Säure steht: 10-50.
Beim Aceton ist der KS-Wert jedoch 1020 mal größer, nämlich 10-30. Das ist zwar immer noch extrem gering, aber es reicht aus, dass eine sehr starke Base ein Proton aus dem Molekül heraus ziehen kann. Ursache hierfür kann nur das O-Atom im Molekül sein, dass einen starken -I-Effekt auf die beiden C-Atoms ausübt, so dass die C-H-Bindungen etwas "gelockert" sind und die H-Atome leichter als Proton abgespalten werden können, falls eine starke Base vorhanden ist.
Schritt 2
Es ist ein Carbanion entstanden. Dieses Carbanion greift nun mit seiner -CH2--Gruppe die C=O-Gruppe des Benzaldehyd-Moleküls in einer nucleophilen Addition an.
Schritt 3
Ein Wasser-Molekül spaltet ein Proton ab, das sich an das negativ geladene O-Atom des Zwischenproduktes setzt und dieses in eine energetisch günstigere OH-Gruppe verwandelt. Aus dem Wasser-Molekül wird ein Hydroxid-Ion. Damit wird das in Schritt 1 eingesetzte Hydroxid-Ion zurück gewonnen. In der Gesamtgleichung taucht dieses OH--Ion daher nicht auf; ohne das Hydroxid-Ion würde die Reaktion aber nicht oder nur extrem langsam ablaufen. Daher fungiert das OH--Ion hier als Katalysator (basische Katalyse).
Schritt 4
Das Zwischenprodukt spaltet Wasser ab (Eliminierung), es bildet sich ein stabiles Reaktionsprodukt mit einer C=C-Doppelbindung.
Spezialisten achten darauf, dass die beiden Doppelbindungen (C=O und C=C) mit den Doppelbindungen des Benzolrings konjugiert sind. Es hat sich also ein stabiles System delokalisierter pi-Elektronen gebildet.
Schritt 5 bis 8
Die gleichen vier Reaktionsschritte finden jetzt noch einmal mit der CH3-Gruppe des bisherigen Reaktionsproduktes statt, so dass wir am Ende ein Molekül haben, dass man als Aceton beschreiben kann, dessen äußere C-Atome mit je einem Toluol-Molekül über eine C=C-Doppelbindung verbunden sind.
Seitenanfang -
Weiter mit ...