Amide sind eine Stoffgruppe der organischen Chemie, die rein formal mit Estern verglichen werden können. Während Ester Verbindungen aus einer Sauerstoffsäure und einem Alkohol sind, handelt es sich bei Amiden um Verbindungen aus Sauerstoffsäuren und Aminen.
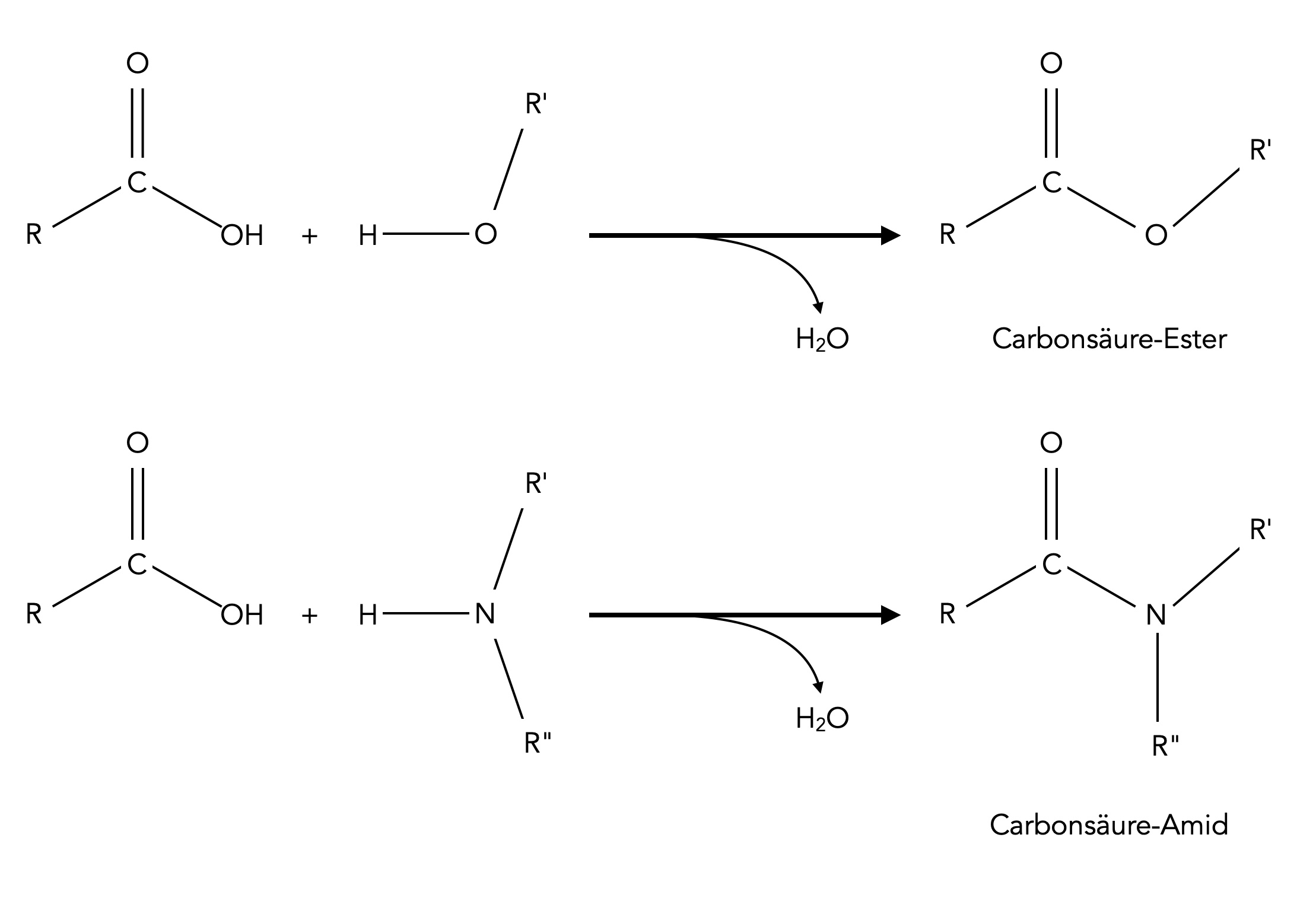
Carbonsäure-Ester und Carbonsäure-Amide im Vergleich
Autor: Ulrich Helmich 03/2024, Lizenz: Public domain
Hier sehen wir die allgemeine Struktur von Carbonsäure-Estern und Carbonsäure-Amiden. Es gibt auch Ester und Amide von anderen Sauerstoffsäuren, beispielsweise Schwefelsäure-Ester und Schwefelsäure-Amide, auf die hier aber nicht weiter eingegangen werden soll.
Carbonsäure-Amide
Diese Verbindungen könnte man als Derivate des Ammoniaks NH3 ansehen. Ein, zwei oder alle drei H-Atome des Ammoniaks sind bei einem Carbonsäure-Amide durch einen Acycl-Substituenten R-C=O ersetzt. Entsprechend bezeichnet man diese Amide als primäre, sekundäre bzw. tertiäre Carbonsäure-Amide.
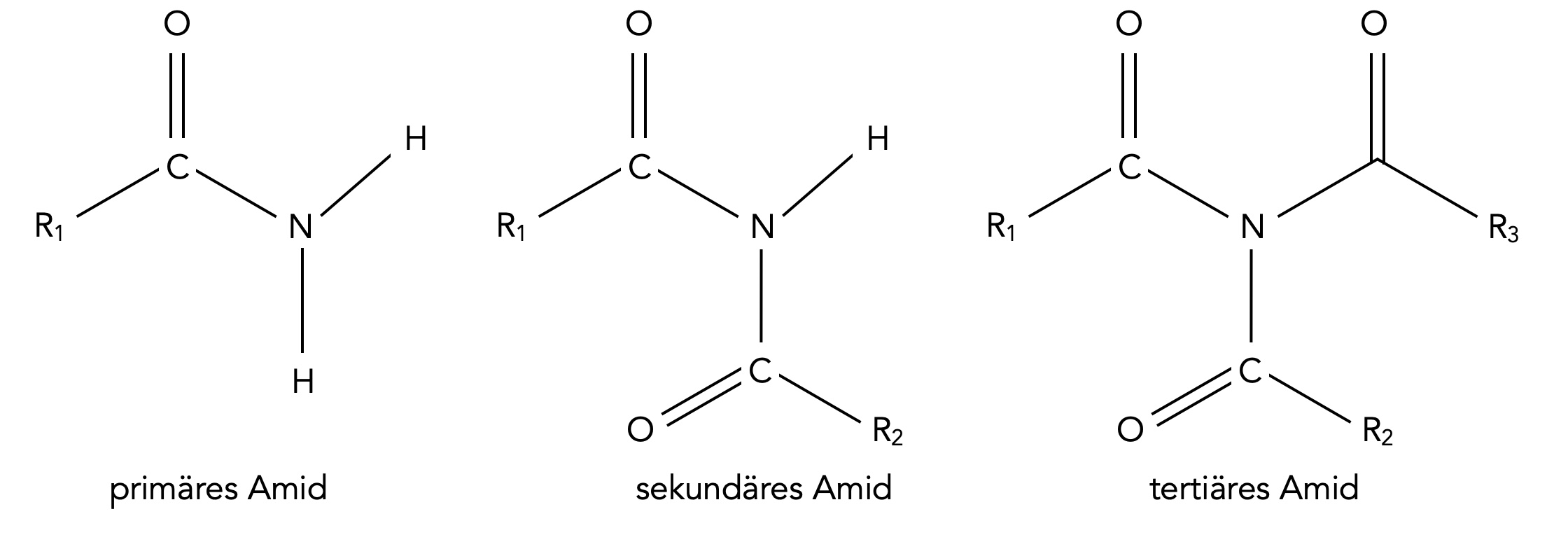
Primäre, sekundäre und tertiäre Amide des Ammoniaks
Autor: Ulrich Helmich 03/2024, Lizenz: Public domain
Hier sehen wir die Amide, die sich formal vom Ammoniak NH3 ableiten. Ein primäres Amid besitzt einen Acylrest, ein sekundäres deren zwei und ein tertiäres sogar drei.
Aber nicht nur vom Ammoniak können sich Amide ableiten, auch von primären und sekundären Aminen ist das möglich:
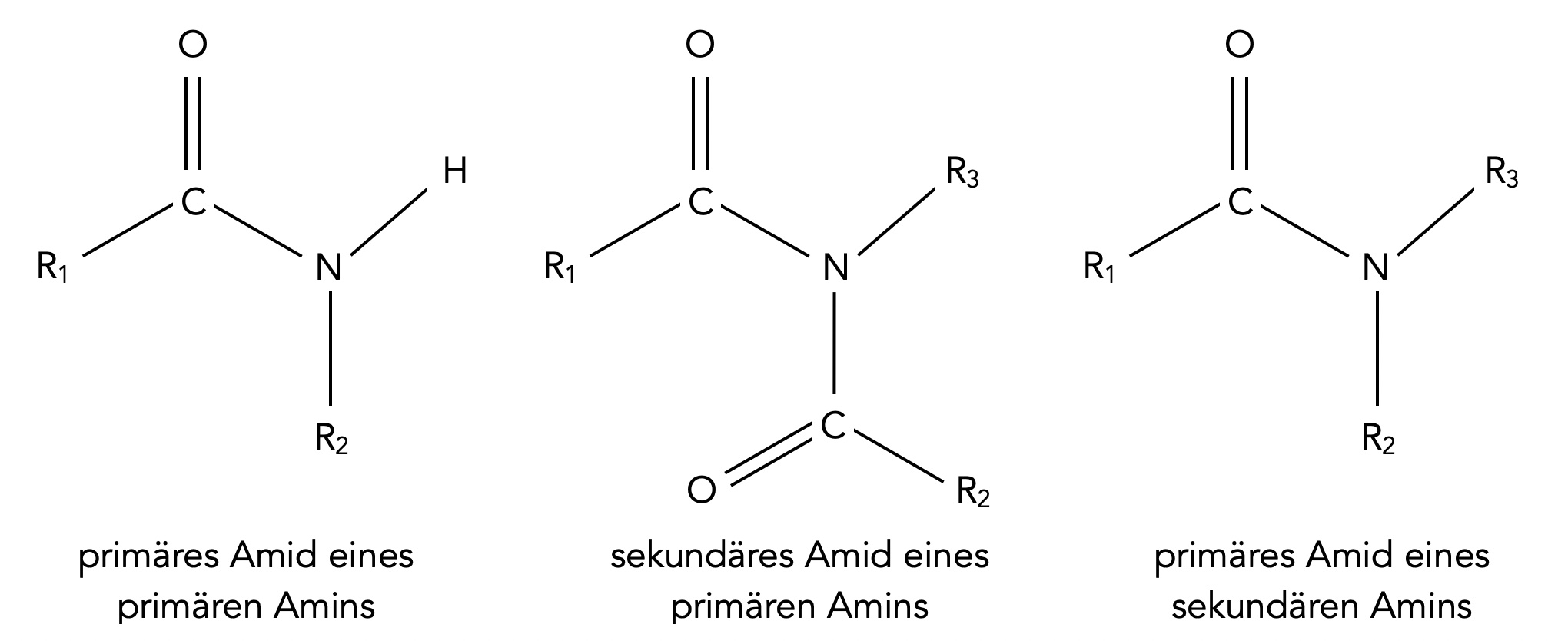
Primäre und sekundäre Amide primärer und sekundärer Amine
Autor: Ulrich Helmich 03/2024, Lizenz: Public domain
Wegen der Tatsache, dass es primäre, sekundäre und tertiäre Amide von Ammoniak, primären und sekundären Aminen gibt, ist die Nomenklatur der Amide nicht ganz einfach.
Peptide
Eine bedeutende Rolle spielen Amide bei den Peptiden und Proteinen. Die Peptidbindung, die zwei Aminosäuren zusammenhält, ist nämlich identisch mit der Amidbindung eines primären Amides.
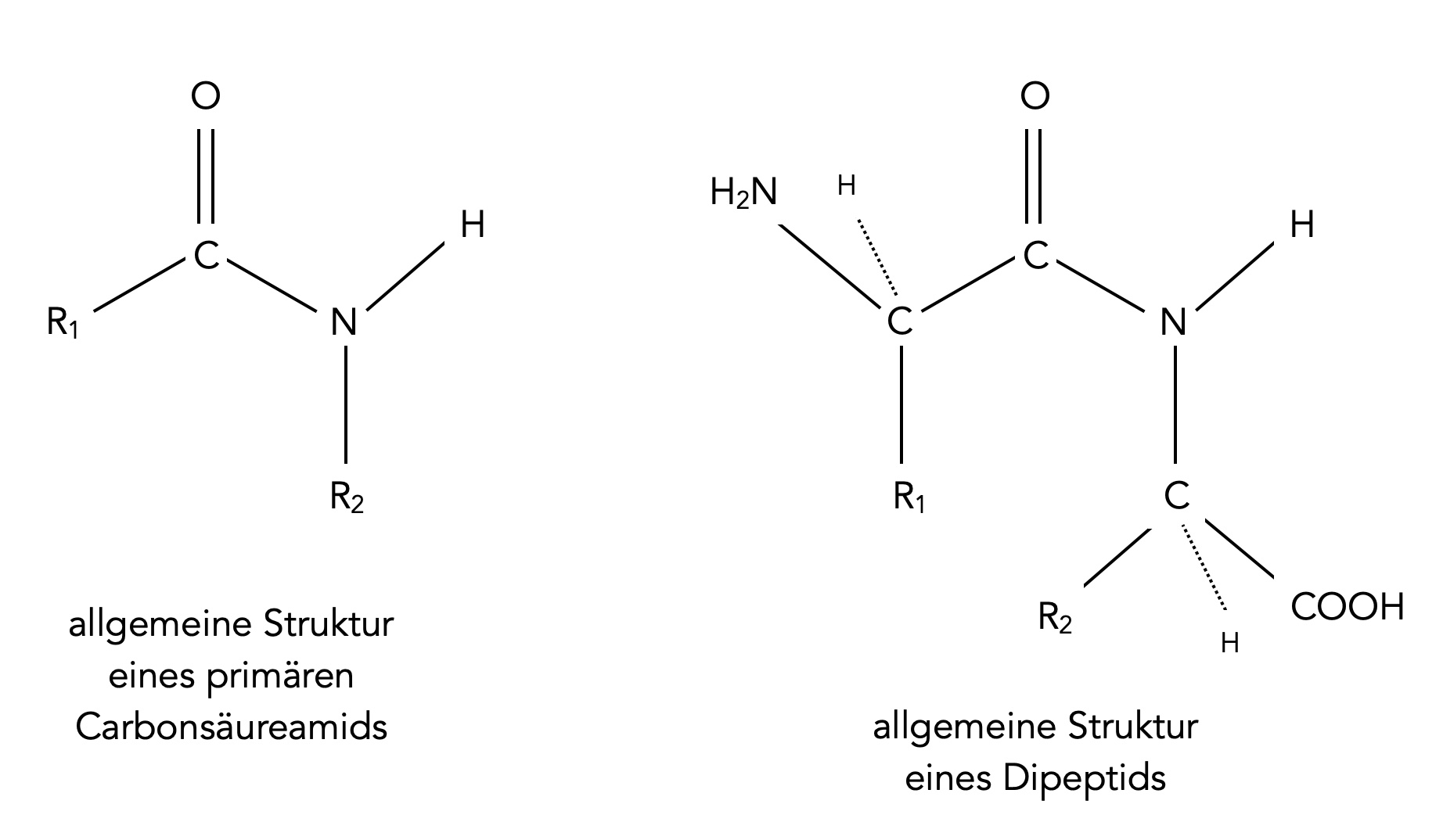
Ein Dipeptid ist ein primäres Carbonsäureamid
Autor: Ulrich Helmich 03/2024, Lizenz: Public domain
Die Amid- bzw. Peptidbindung
Betrachten wir die Peptidbindung / Amidbindung etwas näher. Warum liegen die vier Atome C, O, N und H in einer Ebene, und wieso ist die freie Drehbarkeit um die C-N-Bindung eingeschränkt?
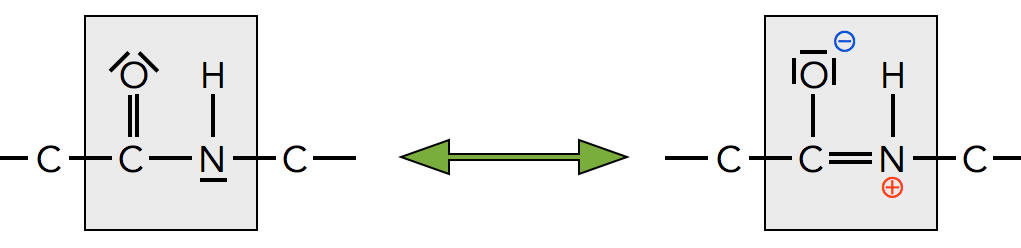
Die Peptidbindung ist mesomeriestabilisiert
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese Abbildung zeigt, warum das so ist. Nicht nur das C-Atom der Carbonylgruppe ist sp2-hybridisiert, sondern auch das O-Atom und das N-Atom. Die pz-Orbitale dieser drei Atome überlappen, so dass die pi-Elektronen delokalisiert sind.
Die C-C-Einfachbindung in dem Peptid ist auch etwas kürzer als eine normale C-C-Einfachbindung, 151 pm statt wie üblich 154 pm. Das liegt natürlich daran dass das C-Atom der Carbonylgruppe sp2-hybridisiert ist. Die sp2-Hybridorbitale sind kleiner als sp3-Hybridorbitale, daher ist die Bindung auch etwas kürzer. Auch die N-C-Bindung ist kürzer als eine normale N-C-Bindung, weil das N-Atom ebenfalls sp2-hybridisiert ist.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.
- Wikipedia, Artikel "Amide"