Alle Aminosäuren haben im Prinzip den gleichen Aufbau: An einem zentralen C-Atom, das auch als α-C-Atom bezeichnet wird, hängen vier verschiedene Gruppen:
- Ein H-Atom,
- eine Amino-Gruppe,
- eine Carboxy-Gruppe,
- ein organischer Rest.
Stereochemie
Bis auf die Aminosäure Glycin, bei der der organische Rest aus einem H-Atom besteht, enthält das α-C-Atom vier verschiedene Substituenten und ist somit chiral. Von jeder Aminosäure - außer eben Glycin - gibt es also zwei Enantiomere (Spiegelbild-Isomere).
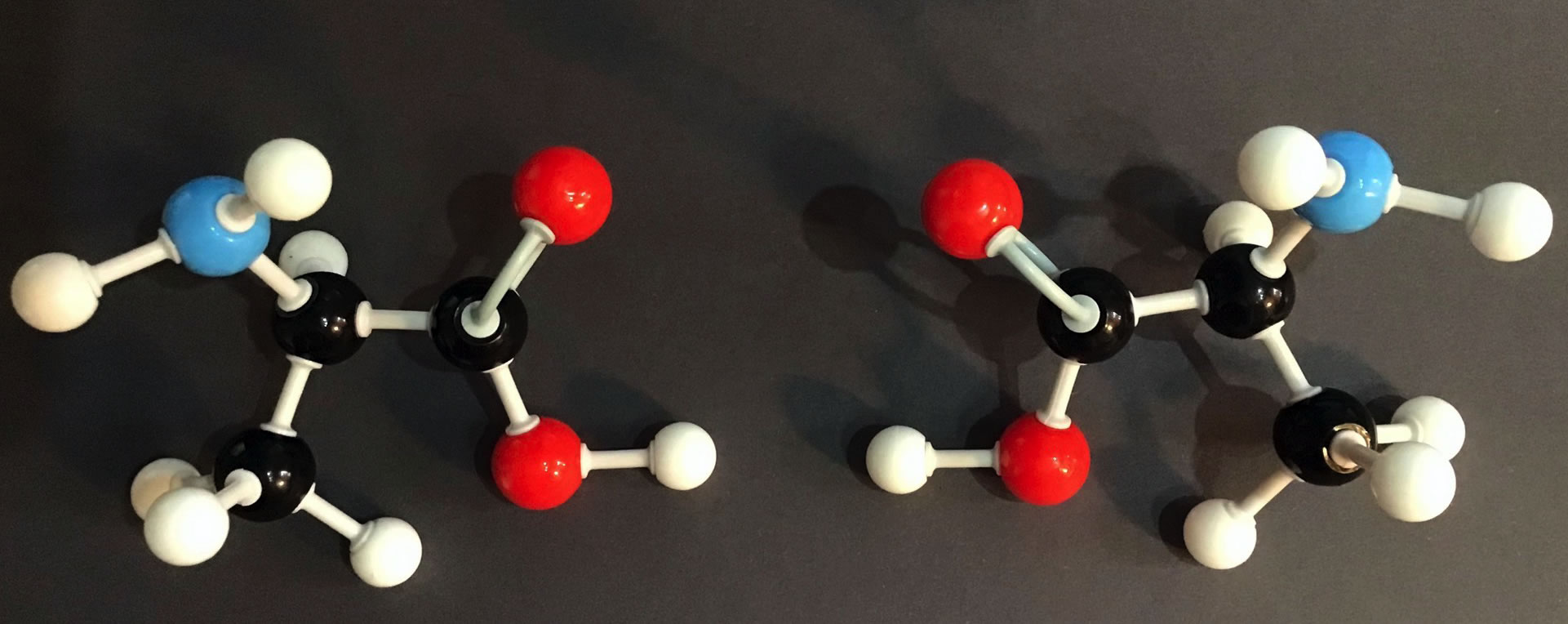
Die zwei Enantiomere des Alanins - als Spiegelbild angeordnet
Autor: Ulrich Helmich, Lizenz: Public domain
Die Abbildung 1 zeigt zwei Molekülmodelle des Alanins. Das rechte Modell wurde spiegelbildlich zum linken Modell gebaut. Die beiden Amino-Gruppen befinden sich jeweils oben bzw. vorne, der Methyl-Rest zeigt bei beiden Modellen nach unten, und das alpha-H-Atom befindet sich hinten.
Nun versuchen wir, das rechte Modell durch geschickte Drehungen in das linke zu überführen:
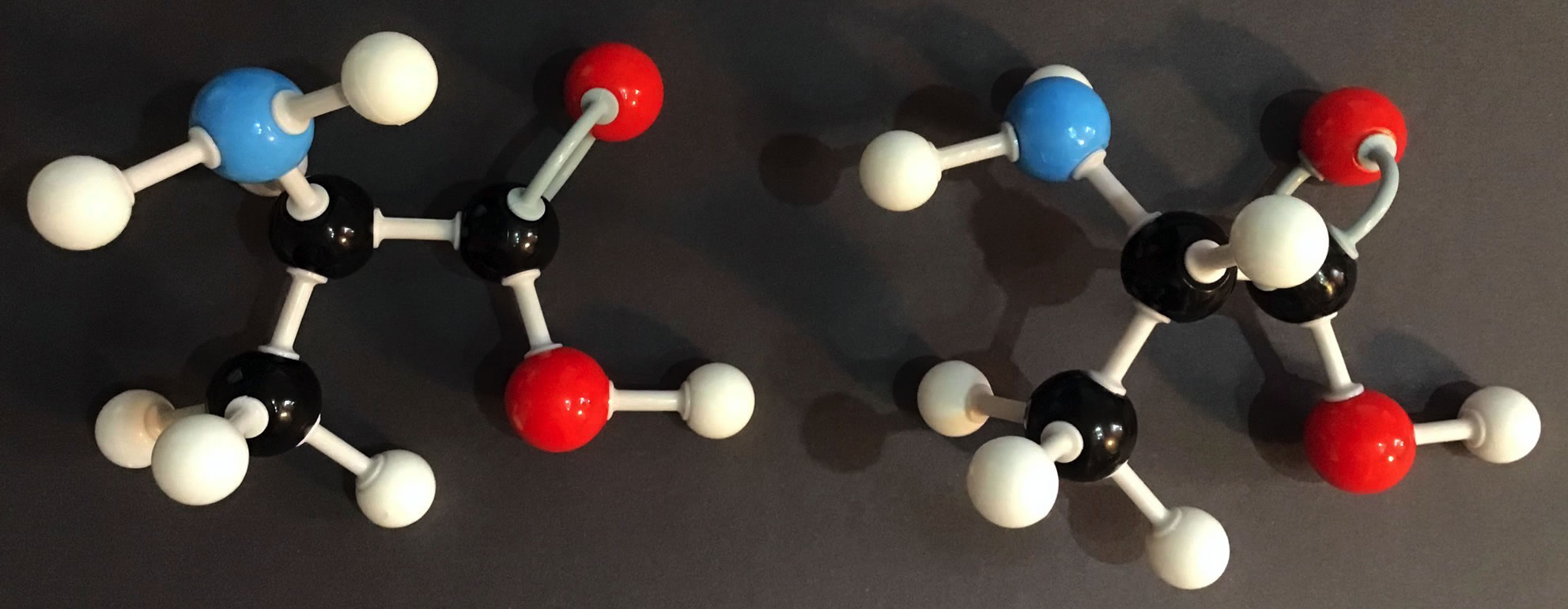
Das rechte Enantiomer kann nicht in das linke überführt werden
Autor: Ulrich Helmich, Lizenz: Public domain
Wie man leicht sieht, kann man das rechte Enantiomer durch einfaches Drehen nicht in das linke überführen. Beim linken Enantiomer befindet sich die Amino-Gruppe vorne, beim rechten dagegen hinten. Dafür befindet sich das alpha-H-Atom beim rechten Enantiomer jetzt vorne, während es beim linken hinten ist.
Es handelt sich tatsächlich um zwei verschiedene Strukturen, die sich wie die linke Hand zur rechten Hand verhalten.
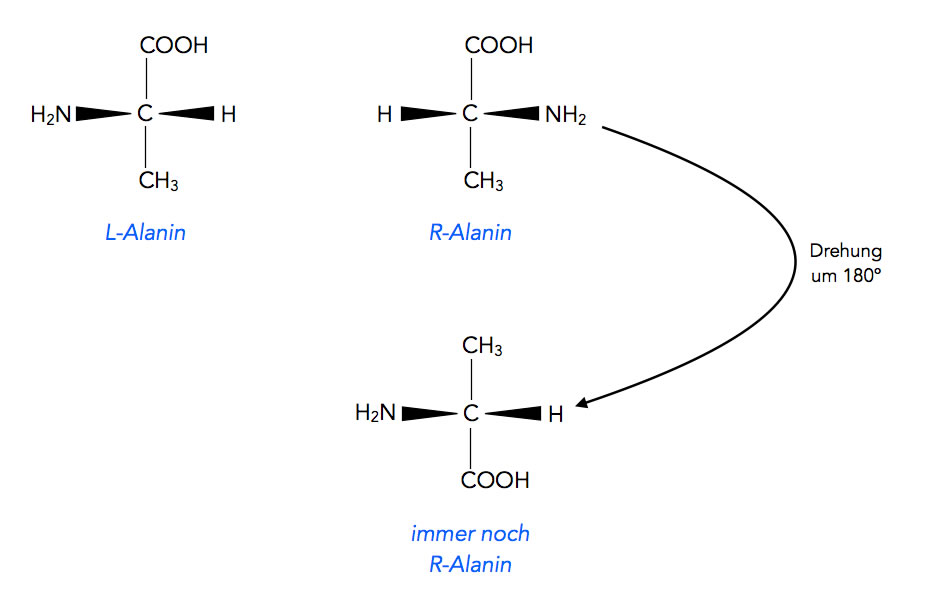
Vereinfachte Darstellung von L- und R-Alanin
Autor: Ulrich Helmich, Lizenz: Public domain
Die Abbildung 3 zeigt, wie man die Strukturen der beiden Enantiomere des Alanins, das L-Alanin und das R-Alanin - graphisch auf einfache Weise darstellen kann, ohne dass man gleich einen Molekülbaukasten zur Hand nehmen muss. Außerdem verdeutlicht die Abbildung noch einmal die Unmöglichkeit, aus R-Alanin durch einfaches Drehen das L-Alanin zu machen.
Alle 20 biogenen Aminosäuren liegen in der L-Form vor. Wie das kommt, darüber kann man nur spekulieren. Evolutionsbiologen beschäftigen sich aber mit solchen grundlegenden Fragen. Es ist ja nicht so, dass die L-Form energetisch irgendwie günstiger wäre als die R-Form. Vielleicht hat das erste RNA-Enzym, das in der Lage war, mehrere Aminosäuren zu einem Peptid zu verbinden, zufällig ein aktives Zentrum gehabt, in das nur die L-Formen der Aminosäuren hineinpassten. Wer weiß?
Säure-Base-Chemie
Die Ladung einer Aminosäure hängt stark vom pH-Wert ab, also von der Konzentration der Protonen im Lösemittel. Schauen wir uns dazu die folgende Abbildung an, die man so ähnlich auch in vielen Fachbüchern findet:
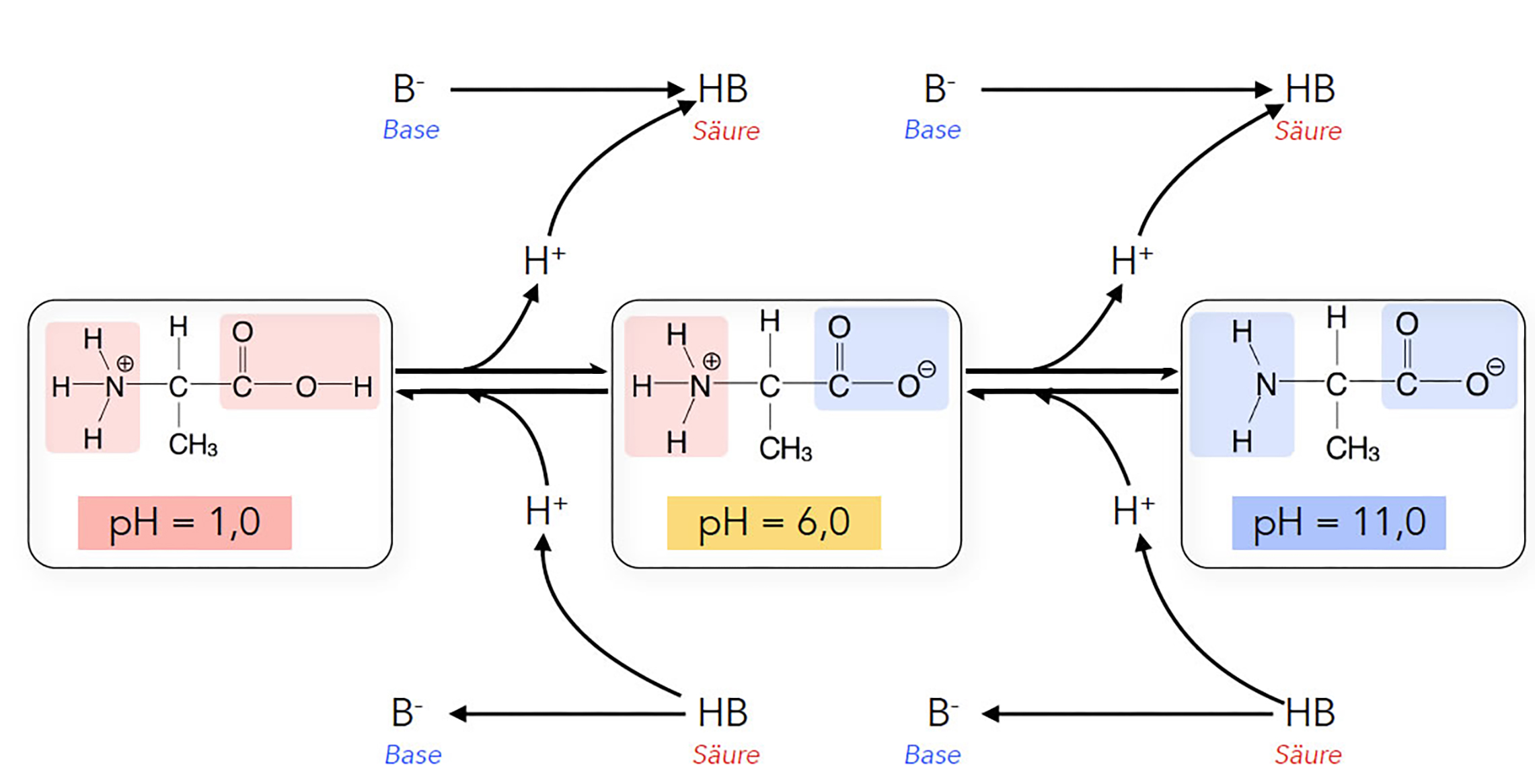
Die pH-Abhängigkeit der Ladung einer Aminosäure
Autor: Ulrich Helmich, Lizenz: Public domain
Bei einem hohen Protonenüberschuss (pH = 1,0) liegen die beiden funktionellen Gruppen der Aminosäure voll protoniert vor, die Carboxy-Gruppe also neutral als -COOH, die Amino-Gruppe positiv geladen als -NH3+.
Gibt man nun eine Base wie OH- in die Lösung (indem man beispielsweise Natronlauge zugibt), sinkt die Protonenkonzentration, weil sich die Base mit den Protonen verbindet. Theoretisch könnten nun beide funktionelle Gruppen ein Proton abgeben, die NH3+-Gruppe und die COOH-Gruppe.
Auf den ersten Blick könnte man hier denken, dass zunächst die NH3+-Gruppe ihr Proton abgibt, weil diese Gruppe ja schon positiv geladen ist und ein Proton zu viel besitzt.
Tatsächlich ist es aber die COOH-Gruppe, die zuerst ihr Proton spendet. Offensichtlich ist die COOH-Gruppe eine stärkere Brönsted-Säure als die NH3+-.
Die NH3+-Gruppe gibt ihr Proton erst ab, wenn die Protonenkonzentration noch weiter gesunken ist, also bei einem alkalischen pH-Wert von 10 oder mehr.
Vertiefung: Das Beispiel Glycin
So viel hatten wir bereits auf der Seite "Aminosäuren" in diesem Chemie-Lexikon gesehen. Nun wollen wir uns die Sache mit der Säure-Base-Chemie der Aminosäuren mal etwas genauer anschauen.
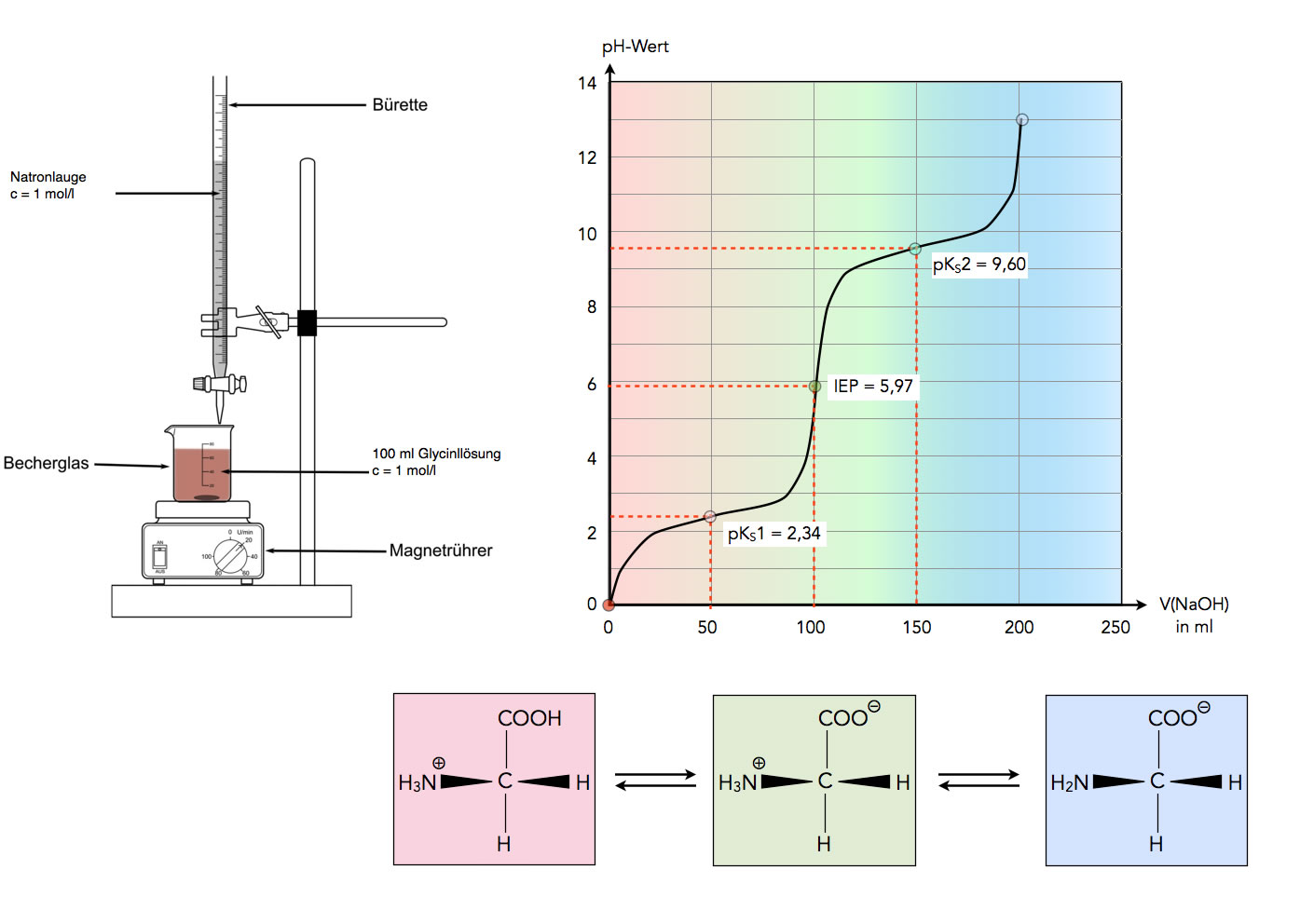
Titration einer Glycin-Lösung mit NaOH
Autor: Ulrich Helmich, Lizenz: Public domain
Das obige Bild zeigt eine typische Säure-Base-Titration, wie man sie aus dem Chemieunterricht der 8. oder 9. Klasse kennt. Im Becherglas befindet sich eine 1-molare Glycin-Lösung, in der Bürette eine 1-molare Natronlauge. Mit 100 ml NaOH hat man die 100 ml Glycin-Lösung neutralisiert, der pH-Wert dieses Äquivalenzpunktes liegt bei 5,97. Die Aminosäure liegt dann als Zwitterion vor, und daher ist hier auch die Bezeichnung isoelektrischer Punkt (IEP) korrekt.
Die Daten für diese Titrationskurve stammen aus dem aktuellen Lehninger [1]. Was mich persönlich dabei etwas wundert: Wieso beginnt die Kurve bei pH=0? Wenn der erste pKS-Wert von Glycin bei 2,34 liegt, dann müsste der pH-Wert dieser Lösung bei 1,17 liegen und nicht bei 0. Es sei denn, man hat eine deutlich konzentriertere Glycin-Lösung verwendet.
Wie dem auch sei, der erste pKS-Wert von Glycin ist deutlich niedriger als der pKS-Wert von Essigsäure. Sie erinnern sich: Glycin ist eigentlich ein Derivat der Essigsäure, ein H-Atom wurde durch eine Amino-Gruppe ersetzt. Der pKS-Wert von Essigsäure liegt bei 4,7. Das heißt mit anderen Worten: Glycin ist mehr als 100 mal so sauer wie Essigsäure (3,7 wäre 10 mal so sauer, 2,7 100 mal).
Warum ist die Carboxy-Gruppe des Glycins derart stark sauer?
Das muss natürlich an der positiv geladenen Amino-Gruppe liegen. Bei der Protolyse der COOH-Gruppe wird ja ein Proton abgegeben, und übrig bleibt die negativ geladene COO--Gruppe. Alle Faktoren, welche diese negative Gruppe stabilisieren, erhöhen die Acidität (Säurestärke) der COOH-Gruppe. Gruppen mit einem positiven induktiven Effekt (Elektronen schiebenden Effekt) würden die negative Ladung der COO--Gruppe noch verstärken, das wäre jetzt nicht sehr hilfreich. Gruppen mit einem negativen induktiven Effekt (Elektronen ziehend) jedoch würden Elektronendichte von der COO--Gruppe abziehen und sie so stabilisieren. Genau diese Funktion erfüllt die positiv geladene Amino-Gruppe. Durch die positive Ladung wird Elektronendichte von der COO--Gruppe abgezogen und diese dadurch stabilisiert.
Eine stabilisierte COO--Gruppe wird leichter gebildet als eine nicht-stabilisierte, und das begünstigt die Abgabe des Protons. Daher ist es logisch, dass Glycin eine deutlich stärkere Säure ist als die verwandte Essigsäure.
Gibt man nach der Neutralisation des Glycins weitere Natronlauge in das Becherglas, wird die Hydroxidionen-Konzentration erhöht, der pH-Wert steigt und auch die NH3+-Gruppe gibt ihr Proton ab. Das Glycin liegt dann als negativ geladenes Ion vor.
Interessanterweise gibt es bei den Aminosäuren noch stärkere Säuren als Glycin. Phenylalanin hat zum Beispiel einen pKS-Wert von 1,83 und Histidin einen von 1,82 [1].
Vertiefung: Das Beispiel Asparaginsäure
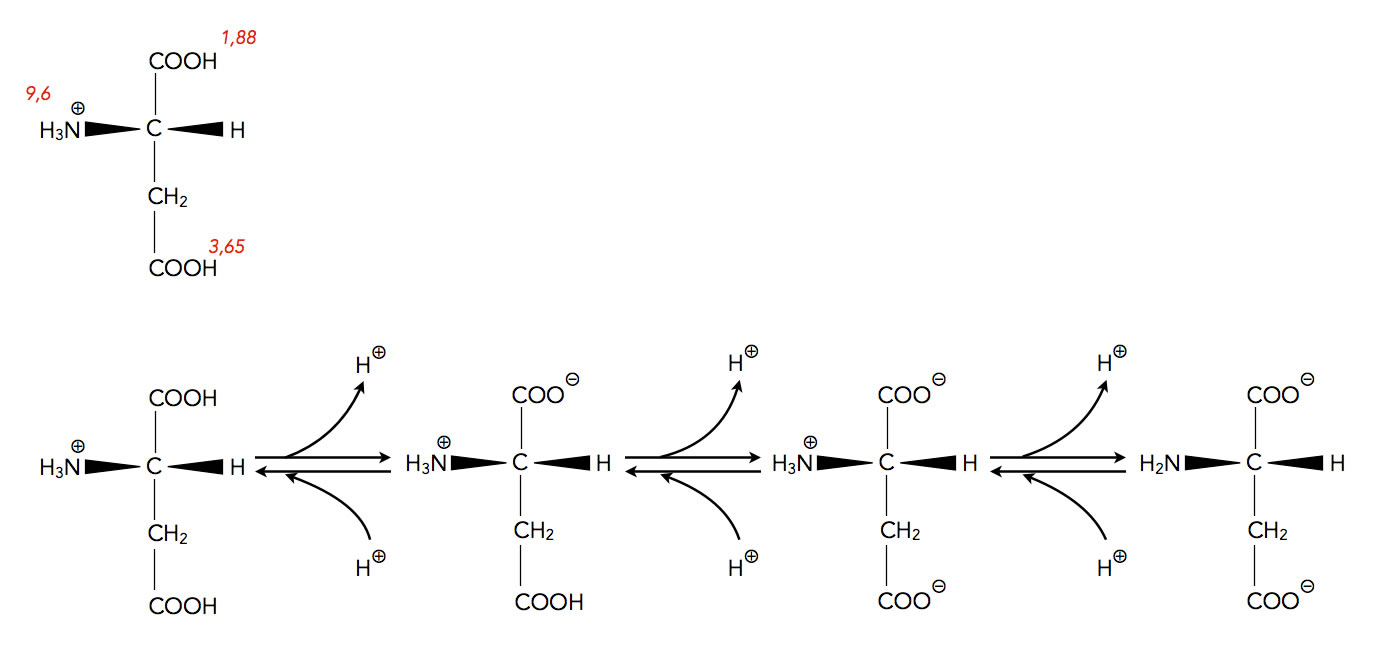
Asparaginsäure kann drei Protonen abgeben
Autor: Ulrich Helmich, Lizenz: Public domain
Die Aminosäure Asparaginsäure besitzt in ihrer Seitenkette eine zweite Carboxy-Gruppe. Daher kann das Asparaginsäure-Kation (Aspartat) sogar drei Protonen abgeben. Das erste Proton wird von der COOH-Gruppe abgegeben, die im Aminosäure-Grundgerüst sitzt. Der pKS-Wert dieser COOH-Gruppe liegt bei starken 1,88.
Sinkt der pH-Wert, wird recht schnell das Proton der COOH-Gruppe in der Seitenkette abgegeben. Der pKS-Wert dieser zweiten COOH-Gruppe liegt bei 3,65. Diese zweite COOH-Gruppe ist also immer noch acider (saurer) als die COOH-Gruppe der Essigsäure.
Erst wenn der pH-Wert im stark alkalischen Bereich angekommen ist, gibt schließlich auch die NH3+-Gruppe ihr Proton ab. Der pKS-Wert hierfür liegt bei 9,6 (Zahlen wieder aus dem Lehninger).
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.