Aprotische Lösemittel bestehen aus polaren Molekülen, die zwar Solvathüllen um Ionen bilden können, aber keine H-Brücken untereinander.
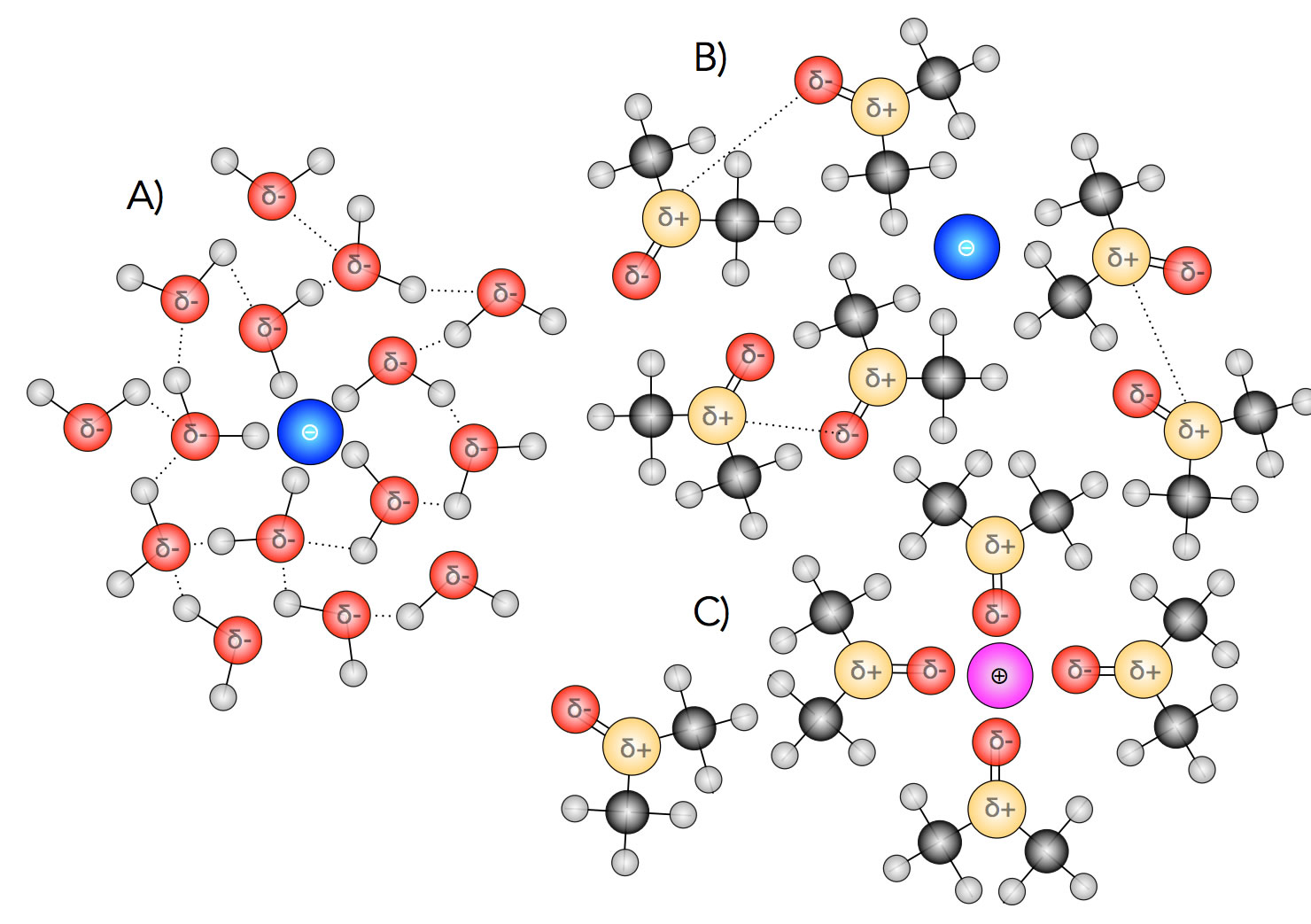
Solvathüllen von Wasser und einem aprotischen Lösemittel
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
A) Wasser bildet bekanntlich Hydrathüllen um positive und negative Ionen. Aber diese Hydrathüllen bestehen nicht nur aus einer einzigen Schicht von Wasser-Molekülen, sondern sind mehrschichtig. Diese zusätzlichen Schichten werden mit Hilfe von Wasserstoffbrücken-Bindungen gebildet, welche dann die vielen Wasser-Moleküle verbinden.
B) Aprotische Lösemittel wie Aceton oder DMSO sind nicht in der Lage, eine Solvathülle um Anionen zu bilden. Die positiv polarisierten Molekülteile (C-Atom im Aceton, S-Atom im DMSO) sind von den Methylgruppen verdeckt und können daher keinen Kontakt mit dem Anion aufnehmen.
C) Um Kationen können aprotische Lösemittel kleine Solvathüllen bilden, allerdings können die Lösemittel-Moleküle untereinander keine Wasserstoffbrücken-Bindungen bilden, so dass die Solvathülle recht klein bleibt.
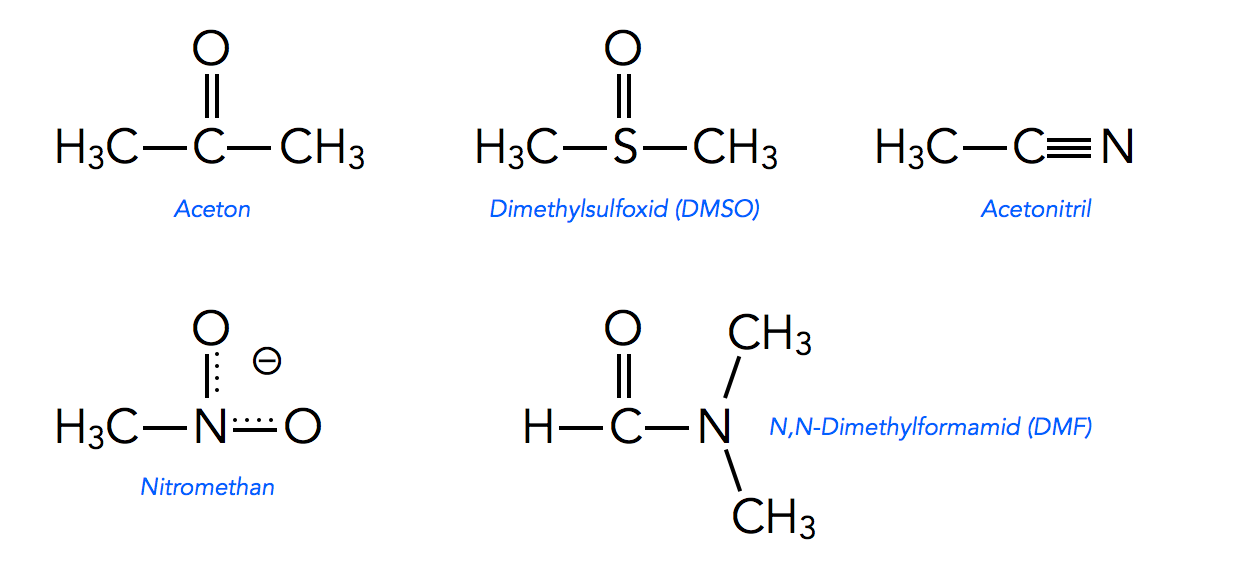
Fünf bekannte aprotische Lösemittel
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Bekannte aprotische Lösemittel sind Aceton, Dimethylsulfoxid (DMSO), Acetonitril, Nitromethan und N,N-Dimethylformamid (DMF).
Chemische Reaktionen, die in aprotischen Lösemitteln durchgeführt werden, verhalten sich oft völlig anders als Reaktionen, die in protischen Lösemitteln wie Wasser, Ethanol oder flüssigem Ammoniak durchgeführt werden. So ist beispielsweise die Nucleophilie vieler Anionen in aprotischen Lösemitteln viel größer als in protischen, weil in aprotischen Lösemitteln kaum Solvathüllen um die Anionen gebildet werden. In einem protischen Lösemittel wie Wasser bilden sich starke Solvathüllen, die das Nucleophil bei der Reaktion behindern.
Beispiel DMSO
DMSO ist die Abkürzung für Dimethylsulfoxid, ein organisches Lösemittel. Die Struktur von DMSO ist fast die gleiche wie die von Aceton, nur ist hier das mittlere C-Atom gegen ein Schwefel-Atom ausgetauscht.
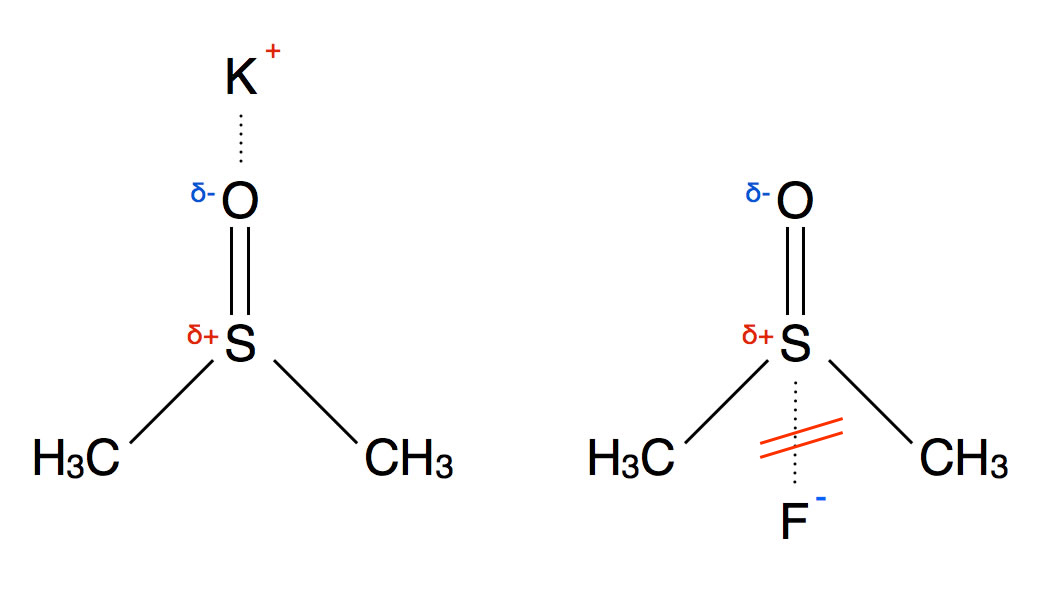
Das DMSO-Molekül als Lösemittel
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende
Auf Grund seiner Struktur kann das DMSO-Molekül ohne weiteres Kationen solvatisieren, nicht aber Anionen, die beiden Methylgruppen stellen hier ein sterisches Hindernis dar.
Nucleophile Reaktionen
Durch solche aprotischen polaren Lösemittel kann die Reaktionsgeschwindigkeit von nucleophilen Angriffen wie zum Beispiel bei der nucleophilen Substitution um einen Faktor gesteigert werden, der bis zu 1 Million erreichen kann, je nach Reaktionsbedingungen. Durch ein protisches Lösemittel wurde zum Beispiel das Fluorid als Nucleophil stark gehemmt, wegen der "dicken" Hydrathülle. DMSO oder ähnliche Lösemittel können das Fluorid-Ion nicht hydratisieren (siehe Abb. 1), so dass es quasi "nackt" vorliegt und um so besser das positiv polarisierte C-Atom des organischen Substrats angreifen kann. Beschränkt man sich nur auf die Halogenid-Ionen, so kehrt sich die Reihenfolge der Nucleophilie in einem Lösemittel wie DMSO um:
F- >Cl- > Br- > I-
Mehr zu diesem Thema finden Sie auf der oben angegebenen Seite.
Reinhard Brückner vergleicht in seinem Buch "Reaktionsmechanismen" [5] die Reaktion von Iodmethan mit Chlorid-Ionen in vier verschiedenen Lösemitteln.
H3C-I + Cl- → H3C-Cl + I-
Die Umsetzung wurde zunächst im Lösemittel Methanol durchgeführt. Die gemessene Reaktionsgeschwindigkeit wurde willkürlich auf 1 gesetzt (relative Reaktionsgeschwindigkeit).
Dann wurde die gleiche Reaktion in drei anderen Lösemitteln durchgeführt:
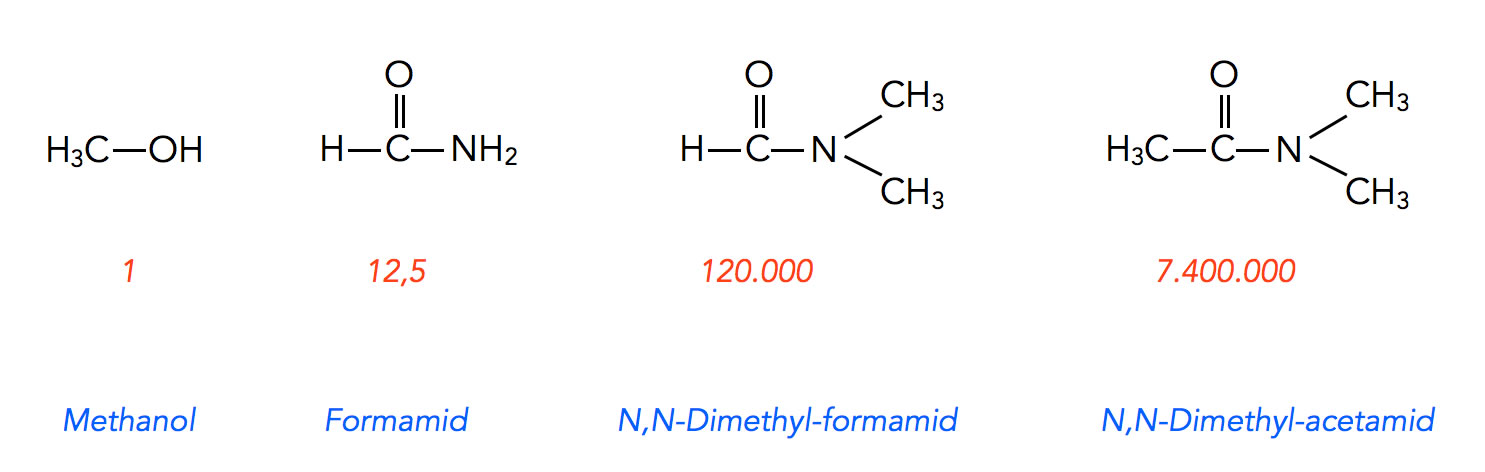
Reaktionsgeschwindigkeit in vier Lösemitteln nach Brückner
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
In Formamid, einem protischen Lösemittel, lief die Reaktion 12,5 mal so schnell ab wie in Methanol. In N,N-Dimethyl-formamid steigerte sich die Geschwindigkeit auf das 120.000fache, und in N,N-Dimethyl-acetamid mit nur einer CH3-Gruppe mehr betrug die relative Geschwindigkeit sogar das 7.400.000fache. Die Zahlen beziehen sich übrigens nicht direkt auf die gemessene Reaktionsgeschwindigkeit, sondern auf die Geschwindigkeitskonstanten.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.