Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- Was man allgemein unter einer Substitution versteht,
- was der Unterschied zwischen einem Nucleophil und einer Lewis-Base ist,
- dass es zwei Arten von Nucleophilen gibt, anionische und neutrale,
- das hauptsächlich Halogenalkane und Alkohole das Angriffsziel von Nucleophilen sind,
- wie die Reaktion zwischen Brombutanen und Ethanol abläuft.
Nucleophile Substitution
Substitution
Zunächst einmal fragen wir uns, was man in der Chemie überhaupt unter einer Substitution versteht.
Das deutsche Wort für "Substitution" ist "Ersetzung". Bei einer solchen Substitution wird ein Atom oder eine Gruppe von Atomen, die wir mal als X bezeichnen wollen, durch ein anderes Atom/Atomgruppe Y ersetzt. Das allgemeine Schema für eine Substitution ist daher
R-X + Y → R-Y + X
R ist dabei der Rest der organischen Verbindung, beispielsweise ein Methyl- oder ein Ethyl-Rest.
Vielleicht haben Sie im Chemieunterricht ja schon die radikalische Substitution behandelt. Bei der Chlorierung von Butan beispielsweise wird ein H-Atom des Butan-Moleküls durch ein Chlor-Atom ersetzt oder substituiert, wie man sagt.
Es hat sich bewährt, die organische Verbindung R-X als Substrat zu bezeichnen, das Atom oder die Atomgruppe X als Abgangsgruppe und das Atom oder die Atomgruppe Y als Eintrittsgruppe.
Bei einer Substitution wird die Abgangsgruppe X eines organischen Substrats R-X durch eine Eintrittsgruppe Y ersetzt.
Neben den Substitutionen gibt es noch zwei andere Reaktionstypen in der organischen Chemie, die Addition und die Eliminierung. Bei einer Addition kommen nur ein oder zwei Eintrittsgruppen zum organischen Substrat dazu, und bei einer Eliminierung wird nur eine Abgangsgruppe abgegeben, aber nicht ersetzt.
Nun haben wir gelernt, was man in der organischen Chemie unter einer Substitution versteht, und wie sich eine Substitution von einer Addition und Eliminierung unterscheidet. Wir müssen jetzt "nur" noch verstehen, was das Besondere an einer nucleophilen Substitution ist.
Drei Typen von Teilchen
In der organischen Chemie gibt es grundsätzlich drei Typen von angreifenden Teilchen. In Ihrem Chemieunterricht haben Sie bestimmt schon einmal den Teilchenbegriff besprochen. Ein "Teilchen" ist dabei entweder ein Atom, ein Ion oder ein Molekül. Wenn man es nicht genau weiß, oder wenn man verallgemeinern will, spricht man von "Teilchen".
In der organischen Chemie unterscheidet man aber auch folgende Gruppen von Teilchen: Elektrophile, Radikale und Nucleophile.
Elektrophile sind Teilchen (Atome, Ionen oder Moleküle!), die von elektrisch negativ geladenen organischen Molekülen angezogen werden. Ein solches Elektrophil kann positiv geladen sein (dann ist das Elektrophil ein Kation), oder es handelt sich um ein Molekül, das an einer Stelle positiv polarisiert ist.
Wenn wir diesen Abschnitt jetzt einfach kopieren und ins Gegenteil verkehren, erhalten wir die Definition der Nucleophile:
Nucleophile sind Teilchen (Atome, Ionen oder Moleküle!), die von elektrisch positiv geladenen organischen Molekülen angezogen werden. Ein solches Nucleophil kann negativ geladen sein (dann ist das Nucleophil ein Anion), oder es handelt sich um ein Molekül, das an einer Stelle negativ polarisiert ist.
Bei Radikalen, dem dritten Typ von angreifenden Teilchen, kann man den Abschnitt nicht einfach kopieren.
Radikale sind meistens ungeladene Teilchen (Atome oder Moleküle), die eine einfach besetzte Kugelwolke besitzen. In manchen Büchern wird auch von einem "einsamen Elektron" oder einem "ungepaarten Elektron" gesprochen.
Mit Elektrophilen und Radikalen müssen wir uns bei der Besprechung der Nucleophilen Substitution nicht weiter beschäftigen, daher konzentrieren wir uns auf die nucleophilen Teilchen, die Nucleophile.
Nucleophile
Bei einer nucleophilen Substitution ist das angreifende Teilchen ein Nucleophil. Wörtlich übersetzt heißt Nucleophil so viel wie "Kern liebendes Teilchen". Atomkerne sind positiv geladen, daher kann man auch etwas lockerer sagen, dass ein Nucleophil "auf der Suche" nach einer positiven Ladung oder Teilladung ist.
Anionische und neutrale Nucleophile
Es gibt zwei Sorten von nucleophilen Teilchen:
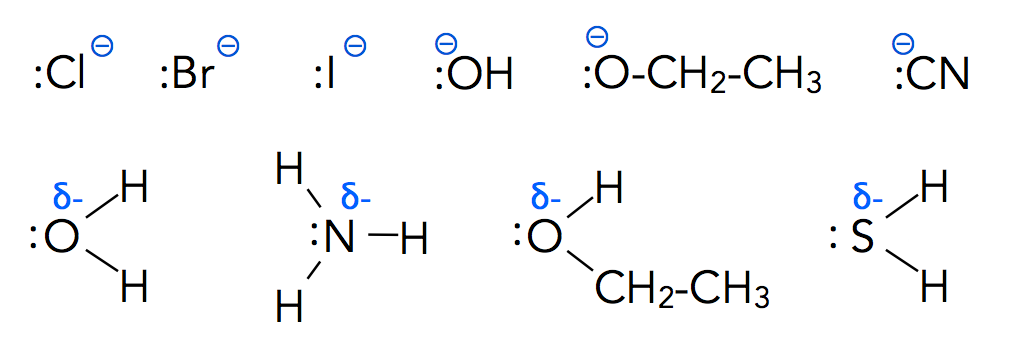
Anionische Nucleophile (obere Reihe) und neutrale Nucleophile
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Nucleophile sind also Anionen oder Moleküle mit einem negativ polarisierten Teil, der ein freies Elektronenpaar zur Verfügung stellen kann.
Kleiner Exkurs in die Säure/Base-Chemie
Vielleicht kennen Sie aus dem Säure/Base-Kurs der Oberstufe schon den Begriff Lewis-Base. Eine Brönsted-Base ist ja ein Teilchen, das in der Lage ist, ein Proton aufzunehmen. Das Hydroxid-Ion ist das Musterbeispiel für eine solche Brönsted-Base. Aber auch das Wasser-Molekül oder das Ammoniak-Molekül ist in der Lage, ein Proton aufzunehmen.
Eine Lewis-Base ist dagegen ein Teilchen, das über ein freies Elektronenpaar verfügt und sich mit Teilchen verbinden kann, die leere Kugelwolken besitzen, zum Beispiel mit Protonen, mit Bor-Atomen, mit positiv geladenen Kohlenstoff-Atomen und so weiter. Solche Teilchen werden dann konsequenterweise als Lewis-Säuren bezeichnet.
Der Begriff Lewis-Base ist also mächtiger als der Begriff Brönsted-Base. Alle Brönsted-Basen sind gleichzeitig Lewis-Basen, aber nicht alle Lewis-Basen sind Brönsted-Basen.
Wir haben eben gerade gesehen, dass Nucleophile über mindestens ein freies Elektronenpaar verfügen. Somit ist ein Nucleophil immer gleichzeitig eine Lewis-Base. Und zwar eine Lewis-Base, die sich mit positiv geladenen oder positiv polarisierten Kohlenstoff-Atomen verbindet. Es gibt auch Lewis-Basen, die keine Tendenz zeigen, sich mit C-Atomen zu verbinden. Diese Lewis-Basen sind dann keine Nucleophile.
Die folgenden Links verweisen auf Lexikon- und Vertiefungsseiten. Für den Unterricht in der gymnasialen Oberstufe sind diese Seiten nicht unbedingt wichtig, aber wer sich dafür interessiert oder einen Leistungskurs Chemie belegt, kann sich ja gerne hier schlau machen. Für Leute, die überlegen, ob sie nach dem Abitur mal Chemie studieren sollen, habe ich sogar eigene Seiten geschrieben, die das Thema noch tiefgründiger behandeln.
Auf dieser Lexikon-Seite finden Sie weitere Informationen das Phänomen der Nucleophilie.
Wenn Sie noch mehr Einzelheiten über Nucleophile und Nucleophilie wissen möchten, dann gehen Sie doch bitte auf diese Expertenseite. Hier werden all die Faktoren besprochen, die den Grad der Nucleophilie beeinflussen, zum Beispiel Stellung des Zentralatoms im PSE, Einfluss von Lösemitteln und so weiter.
Diese Seiten sind speziell für Leute geschrieben, die nach dem Abitur Chemie oder eine verwandte Wissenschaft studieren wollen, und natürlich auch für Studienanfänger in diesen Fächern.
Ein kleiner Versuch
Nach dieser kurzen theoretischen Einführung machen wir erst mal einen kleinen Versuch, der so schön ist, dass er inzwischen in vielen Schulbüchern der Chemie abgedruckt ist, beispielsweise im aktuellen Schroedel-Band "Chemie heute SII Qualifikationsphase"[3].
Reaktion verschiedener Brombutane mit Ethanol
Auf dieser Seite finden Sie eine Beschreibung der Versuchsdurchführung sowie der Beobachtungen, außerdem zwei selbst erstellte Photos der Versuchsergebnisse.
Deutung des Versuchs
Das Alkohol-Molekül besitzt eine polare Hydroxygruppe, wobei das Sauerstoff-Atom eine negative Teilladung und zwei freie Elektronenpaare trägt. Das Ethanol-Molekül ist also ein gutes neutrales Nucleophil.
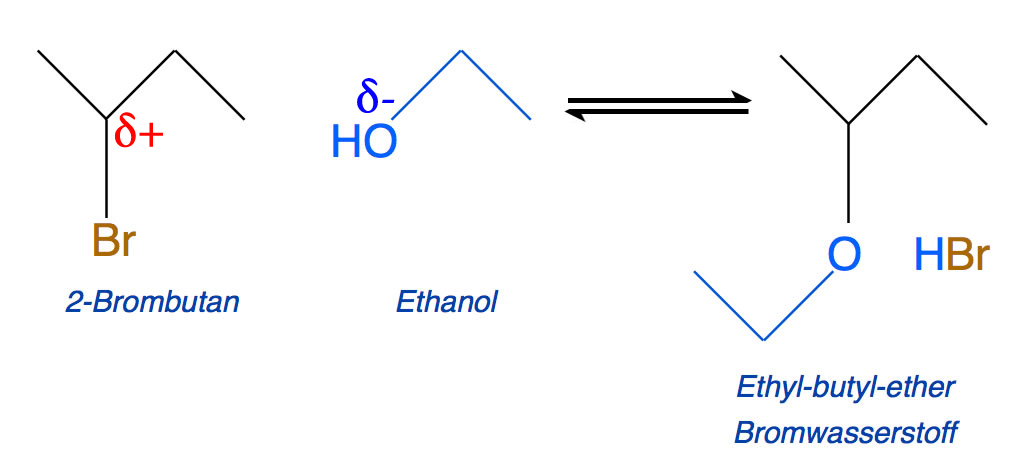
Die Reaktion im zweiten Reagenzglas: 2-Brombutan + Ethanol ---> Ethylbutylether + Bromwasserstoff
Autor: Ulrich Helmich 2020, Lizenz: siehe Seitenende
Das Ethanol-Molekül substituiert das Brom-Atom im 2-Brombutan, dabei entstehen Ethylbutylether und Bromwasserstoff.
In Wirklichkeit läuft die Reaktion etwas komplexer ab. Zunächst spaltet Ethanol ein Proton ab und wird zum Ethanolat-Ion CH3-CH2-O-. Dieses Anion ist jetzt ein recht starkes ionisches Nucleophil. Es verdrängt das Brom-Atom aus dem 2-Brombutan, das dann als Bromid-Anion Br- freigesetzt wird.
Diese Bromid-Ion verbindet sich nun mit dem zuvor vom Alkohol abgespaltenen Proton zu Bromwasserstoff HBr, und ein Teil der Bromid-Ionen reagiert mit den Silber-Ionen Ag+ zu schwer löslichem Silberbromid AgBr.
Das Silberbromid ist schwer wasserlöslich und fällt als gelblich weißer Niederschlag aus. Dadurch wird dem Reaktionsgemisch Bromid entzogen, und das führt nach dem Prinzip des kleinsten Zwangs dazu, dass sich das chemische Gleichgewicht der Reaktion weiter nach rechts verschiebt, zur Produktseite also.
Mit dem Substrat 1-Brombutan läuft die Reaktion nicht so gut, mit den vorhandenen Schulmitteln konnte jedenfalls keine Reaktion beobachtet werden. 2-Brombutan reagiert deutlich stärker, und am besten läuft die Reaktion bei 2-Brom-2-methylpropan ab. Offensichtlich nimmt die Reaktivität des Brombutans zu, wenn das Brom-Atom an einem sekundären C-Atom sitzt, und erst recht, wenn es an einem tertiärem C-Atom sitzt.
In der Dyker-Vorlesung[1] werden folgende spektakuläre Zahlen genannt:
- Bromethan: 1
- 2-Brompropan: 12
- 2-Brom-2-methylpropan: 120.000
Bei diesen Zahlen handelt es sich um die relative Geschwindigkeit der Reaktion von Bromalkanen mit Wasser als Nucleophil in Aceton als Lösemittel bei Zimmertemperatur. Das tertiäre 2-Brom-2-methylpropan reagiert 120.000 mal heftiger / schneller / besser als das primäre Bromethan. Woran das liegt, werden wir auf einer späteren Seite noch genauer sehen.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Chemie heute SII, Qualifikationsphase, Braunschweig 2014.
Seitenanfang -
Weiter mit der Kinetik nucleophiler Substitutionen...