Es gibt einige Radikale, die - meistens auf Grund sterischer Hemmung - so stabil sind, dass man sie bei Zimmertemperatur für längere Zeit aufbewahren kann.
Der Römpp[1] nennt DPPH (2,2-Diphenyl-1-picrylhydrazyl) als stabiles Radikal, das bei Zimmertemperatur unbegrenzt haltbar ist.
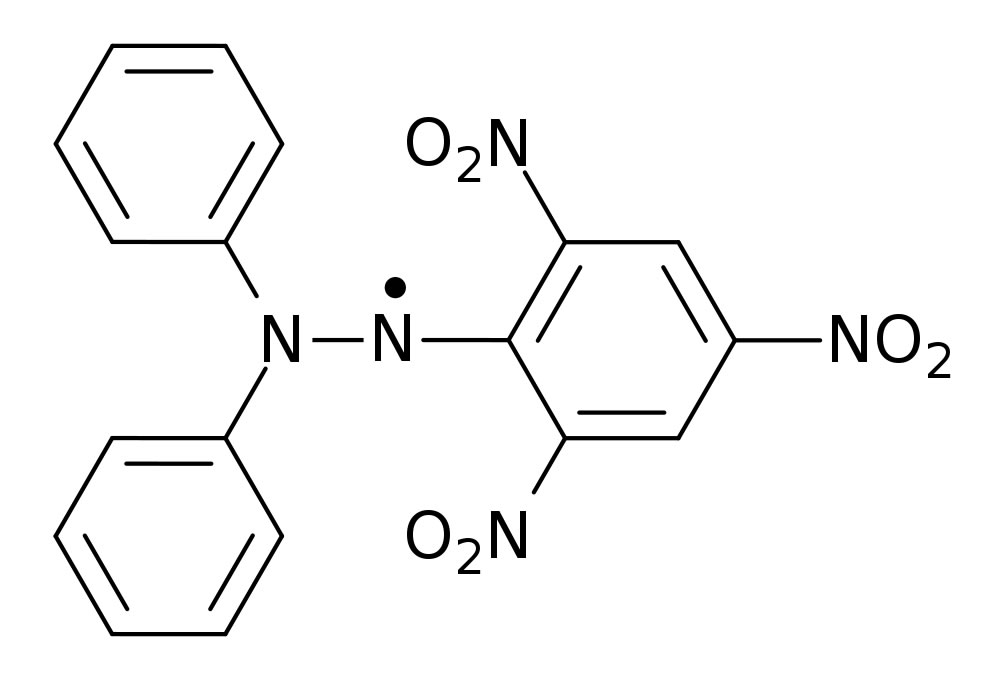
Das DPPH-Radikal
Die Verbindung ist ein schwarzgrünes Pulver mit einem Schmelzpunkt von 135 ºC[2].
Weitere stabile Radikale
Das Triphenylmethyl-Radikal
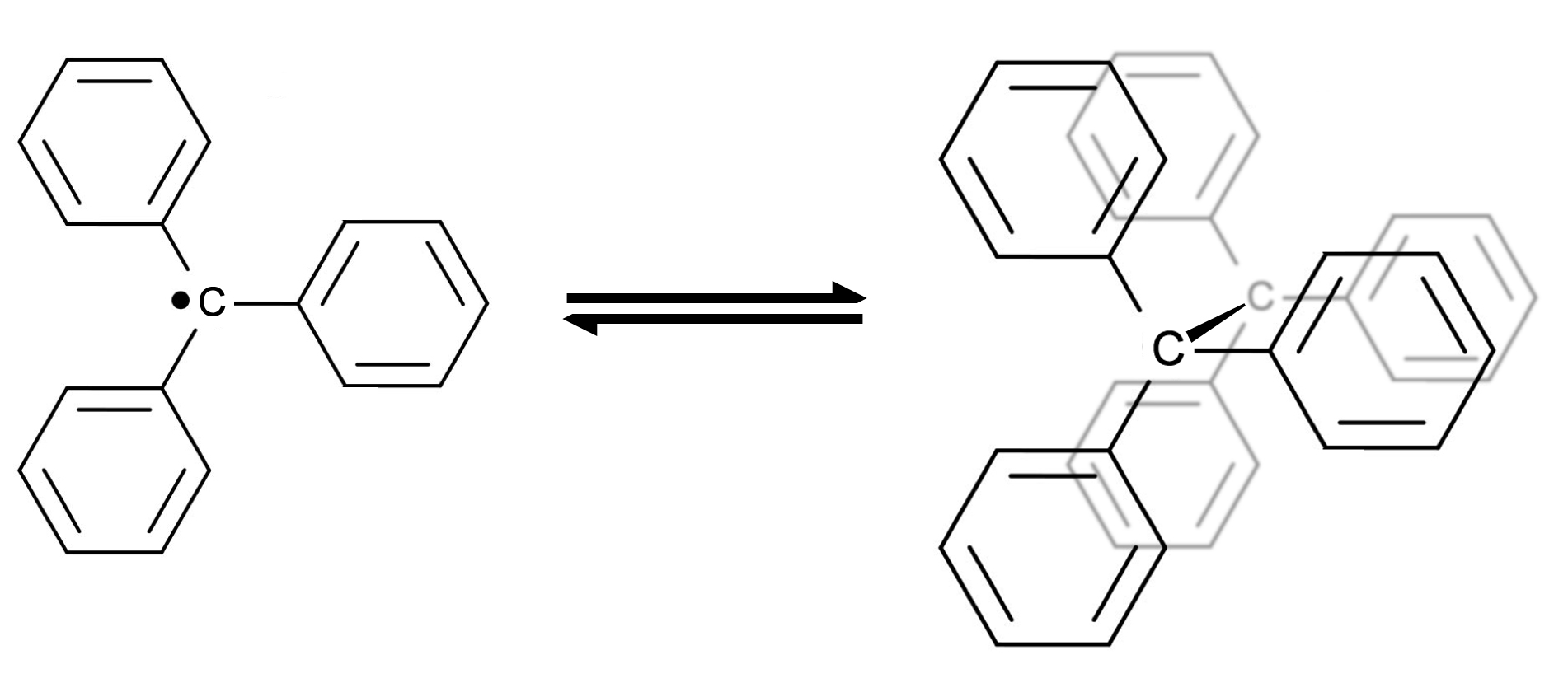
Das Triphenylmethyl-Radikal (links) kann sich mit einem Partner zu einem Dimer vereinigen
Dieses Radikal ist nicht ganz so stabil, dass man es bei Zimmertemperatur als Pulver aufbewahren könnte. Aber in Lösung kann das Triphenylmethyl-Radikal ganz schön lange bei höheren Temperaturen existieren. Allerdings können sich zwei dieser Radikale zu einem Dimer vereinigen. Das Radikal steht dann im Gleichgewicht mit dem Dimer.
Warum ist dieses Radikal so stabil?
Es besitzt zwar eine Kugelwolke, die mit nur einem Elektron besetzt ist. Theoretisch ist das Radikal also sehr reaktionsfreudig. Das Problem ist nur, ein Reagenz muss erst mal an diese Kugelwolke herankommen. Da sind aber die drei großen Benzolringe im Weg. Ein klassisches Beispiel einer sterischen Hinderung.
Warum ist dieses Radikal nicht so stabil, dass man die Verbindung in fester Form bei Zimmertemperatur aufbewahren kann?
Die Struktur des Triphenylmethyl-Radikals suggeriert, dass man es mit einem großen System sp2-hybridisierter C-Atome zu tun hat, in dem sich dann sämtliche Elektronen der Doppelbindungen und des radikalischen C-Atoms delokalisiert aufhalten. Wäre dem so, dann wäre das Radikal in der Tat sehr stabil.
Leider ist dem nicht so. Die drei Benzolringe liegen nämlich nicht in der gleichen Ebene, sondern sind gegeneinander propellerartig verdreht.
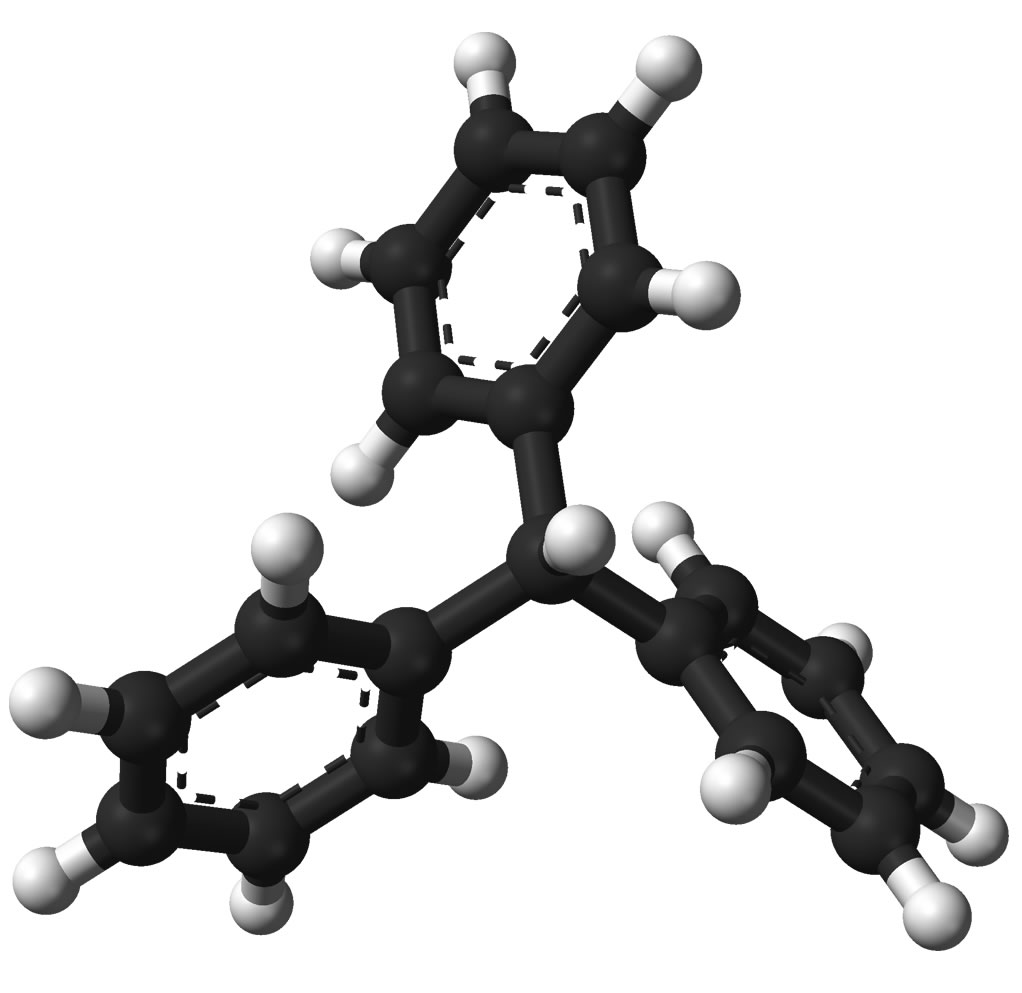
Die räumliche Struktur des Triphenylmethan-Moleküls (und des Radikals)
Quelle: Wikipedia. Autor: Ben Mills
This work has been released into the public domain by its author, Benjah-bmm27. This applies worldwide.
Dadurch, dass die drei Benzolringe gegeneinander verdreht sind, sind die pz-Orbitale der 18 C-Atome nicht mehr parallel ausgerichtet. Die p-Orbitale des einen Rings können nicht mehr mit den p-Orbitalen eines Nachbarrings überlappen. Das Molekül besitzt also nicht ein großes System delokalisierter Elektronen, sondern drei kleine einzelne Systeme. Das C-Radikal im Zentrum des Moleküls kann daher nicht mehr stabilisiert werden, jedenfalls nicht durch Überlappung mit den p-Orbitalen der drei Ringe. Die einzige Stabilisierung ist die sterische.
Quellen:
- Falbe, J.; Regitz, M. (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- engl. Wikipedia, Artikel DPPH, Zugriff am 04.02.2019
- Vollhardt, K. P. C.; Schore, N. E.: Organische Chemie. 6. Auflage. Weinheim: Wiley-VCH, 2020.
- Wikipedia, Artikel Einelektronenübertragung, Zugriff am 04.02.2019
- Clayden, J.; Greeves, N.; Warren, S.: Organische Chemie. Berlin: Springer-Spektrum, 2013.