Grundlegendes
Bei der radikalischen Addition, kurz AR, werden Atome oder Atomgruppen an die C=C-Doppelbindung eines Alkens oder einer vergleichbaren Verbindung angelagert.
Die C=C-Doppelbindung ist mit vier Bindungselektronen sehr elektronenreich. Positive Ionen oder Moleküle mit einem positiven Pol werden davon angezogen und führen dann zu einer elektrophilen Addition, die wir an anderer Stelle dieser Homepage ausführlich behandelt haben. Auch Radikale sind elektrophil, denn einem Radikal fehlt ein Elektron zur Vervollständigung der Außenschale.
Erster Kettenfortpflanzungsschritt
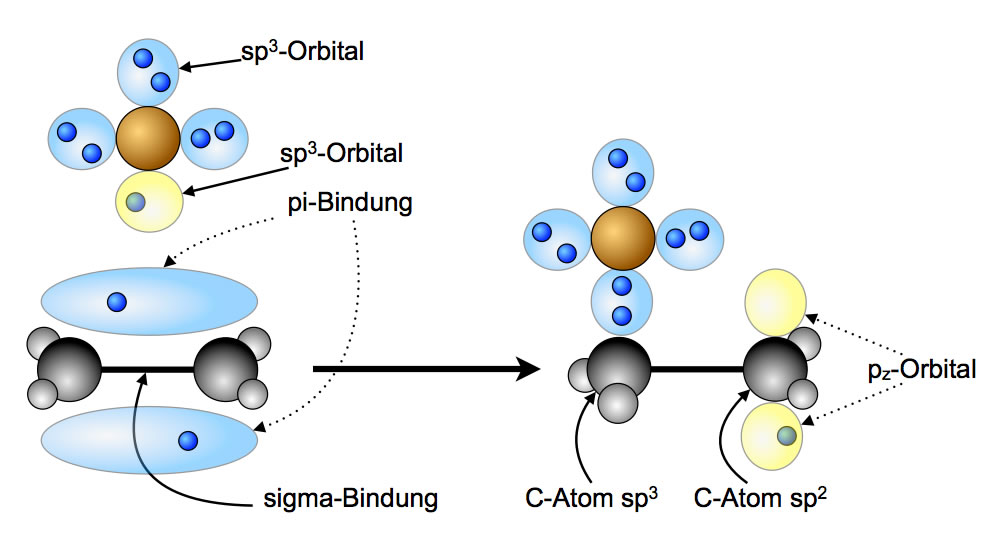
Kettenfortpflanzungsschritt 1:
Addition eines Brom-Radikals an die Doppelbindung des Ethen-Moleküls
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz
Wie sehen hier die Addition eines Bromradikals Br* an Ethen. Der Mechanismus dieser Reaktion ist recht einfach. Nach der lichtinduzierten Startreaktion (siehe auch "Radikalische Substitution") hat das entstandene Brom-Radikal ein sp3-Hybridorbital, das nur mit einem Elektron besetzt ist (und daher in dem Bild gelb dargestellt ist).
Die C=C-Doppelbindung besteht aus einer normalen sigma-Bindung (zwei überlappende sp2-Hybridorbitale) und einer pi-Bindung. Diese pi-Bindung kann mit dem Kugelwolkenmodell nicht mehr erklärt werden. Nach dem Orbitalmodell besteht die pi-Bindung aus zwei leicht überlappenden pz-Orbitalen, die mit je einem Elektron besetzt sind. Die beiden Orbitallappen der pi-Bindung enthalten zusammen zwei Bindungselektronen. Nähere Einzelheiten zur C=C-Doppelbindung siehe "Die C=C-Doppelbindung" in der Reihe zum Orbitalmodell auf dieser Homepage.
Wenn sich das Brom-Radikal der Doppelbindung nähert, dann "klappt" die pi-Bindung sozusagen auf, und es entstehen wieder die beiden separaten pz-Orbitale. Das eine der beiden pz-Orbitale überlappt nun mit dem einfach besetzten sp3-Hybridorbital des Brom-Radikals, es bildet sich eine normale kovalente Bindung, aus dem pz-Orbital wird dabei ein sp3-Hybridorbital, weil das linke C-Atom seinen Hybridisierungszustand von sp2 nach sp3 ändert - das ist energetisch wohl günstiger.
Das rechte C-Atom besitzt aber jetzt ein pz-Orbital, das mit nur einem Elektron besetzt ist. So etwas geht natürlich gar nicht ("energetisch ungünstig"), daher "sucht" sich dieses pz-Orbital nun ein Teilchen, das bereit ist, ein zweites Elektron beizusteuern.
Zweiter Kettenfortpflanzungsschritt
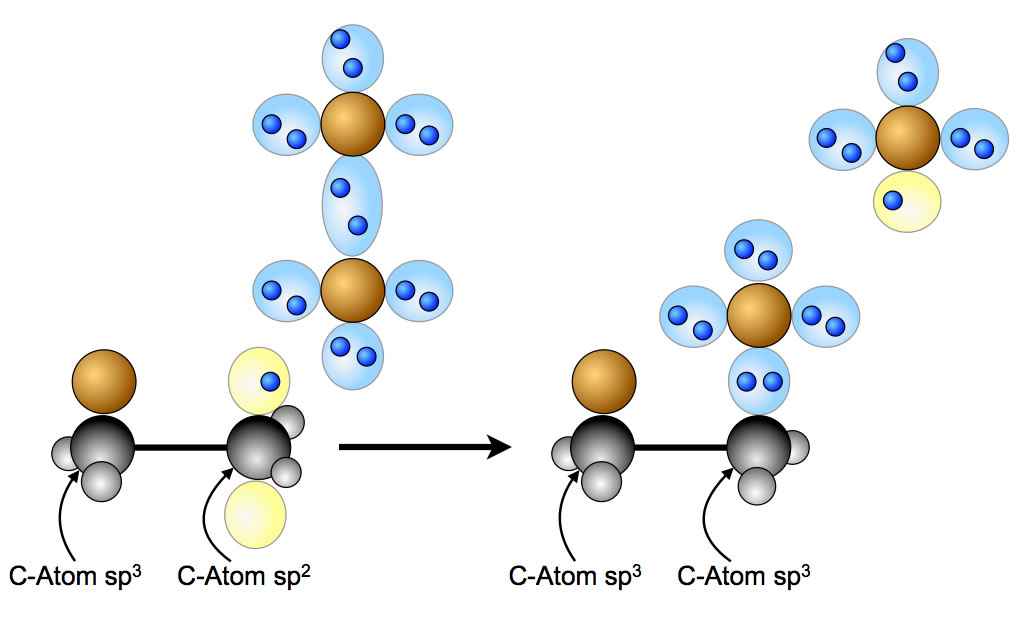
Kettenfortpflanzungsschritt 2:
Reaktion des Alkylradikals mit einem weiteren Brom-Molekül
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz
Das Brom-Atom des linken C-Atoms ist hier der Einfachheit halber als braune Kugel dargestellt, auf die Kugelwolken bzw. Orbitale wurde hier verzichtet. Man sieht, wie sich ein weiteres Brom-Molekül dem Ethyl-Radikal nähert. Das Ethyl-Radikal "zieht" nun ein Br-Atom aus dem Brom-Molekül heraus, und es entsteht das Endprodukt der radikalischen Addition, das 1,2-Dibrom-ethan. Übrig bleibt ein neues Brom-Radikal. Dieses neue Brom-Radikal kann nun mit einem weiteren Ethen-Molekül nach dem gleichen Schema reagieren, und wir haben wieder die schönste Kettenreaktion - ähnlich wie bei der radikalischen Substitution. Die Kettenabbruch-Schritte sind übrigens ähnlich wie bei der radikalischen Substitution: Immer dann, wenn zwei Radikale zufällig zusammenstoßen, bricht die Reaktionskette ab.
Bedeutung für den Chemie-Unterricht
Der Mechanismus der radikalischen Addition wird von den meisten Chemiebüchern der gymnasialen Oberstufe gern übersehen oder nur ganz versteckt dargestellt; er hat für den Chemie-Unterricht eigentlich nur eine untergeordnete Bedeutung. Es sei denn, man behandelt das Thema "Kunststoffe" intensiv und geht dabei auf die Bildung von Polymeren wie Polyethylen oder Polypropylen durch einen radikalischen Kettenmechanismus ein.
Anti-Markownikow-Addition
Interessant an der radikalischen Addition ist aber, dass sie die Möglichkeit einer Anti-Markownikow-Addition bietet. Stellen wir uns mal die Addition von HBr an Propen vor. Normalerweise läuft hier die elektrophile Addition ab, und das Proton des HBr addiert sich so an das Propen-Molekül, dass das stabilste Carbenium-Ion entseht, nämlich das sekundäre mit der positiven Ladung am mittleren C-Atom. Das Bromid-Ion setzt sich dann natürlich an dieses mittlere C-Atom mit der positiven Ladung, und wir bekommen 2-Brom-propan als fast reines Produkt und nur sehr wenig 1-Brom-Propan als Nebenprodukt.
Wenn wir aber hauptsächlich 1-Brom-propan benötigen, hilft uns diese elektrophile Addition nicht viel weiter.
Würde die Reaktion aber nach dem radikalischen Mechanismus ablaufen, wie er hier eben beschrieben wurde, sieht das Ergebnis ganz anders aus.
Bei der sogenannten Hydrobromierung (Addition von HBr) muss man einen Kettenstarter zusetzen. Bei diesen Kettenstartern handelt es sich normalerweise um sehr instabile organische Peroxide, also Verbindungen, die zwei miteinander verbundene O-Atome enthalten, allgemein also R1-O-O-R2. Solche Peroxide lassen sich durch Licht, Wärme, manchmal schon durch leichtes Schütteln in zwei Radikale spalten:
$R_{1}-O-O-R_{2} \to R_{1}-O \bullet + \bullet O-R_{2}$
Ein solches $R_{1}-O \bullet $-Radikal zieht nun ein H-Atom aus dem Bromwasserstoff heraus. Diese Reaktion ist energetisch besonders günstig, weil eine sehr stabile O-H-Bindung entsteht. Übrig bleibt ein Brom-Radikal Br*, welches sich nun an die Doppelbindung des Propens setzt.
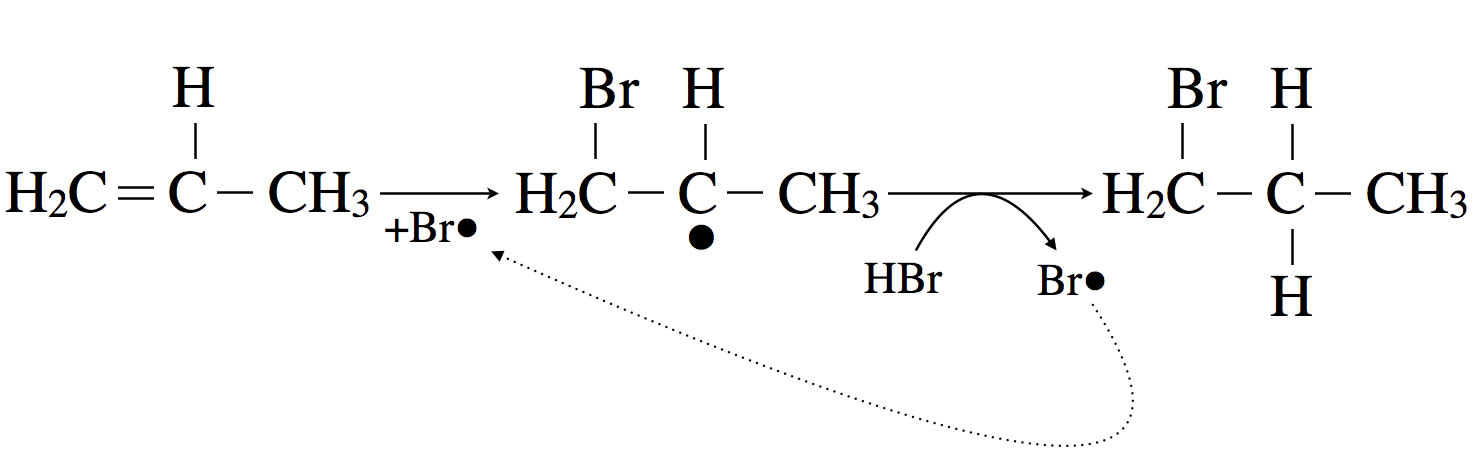
Die radikalische Hydrobromierung von Propen
Dabei bildet sich ein stabiles sekundäres Propyl-Radikal. Das Brom-Atom setzt sich dabei an eines des beiden äußeren C-Atome. Wenn jetzt das Propyl-Radikal ein H-Atom aus dem HBr-Molekül herausholt, erhalten wir das 1-Brom-propan als Hauptprodukt.
Im Unterschied zur elektrophilen Addition von HBr greift bei der radikalischen HBr-Addition zuerst das Brom (als Radikal) die Doppelbindung an. Bei der elektrophilen Addition greift dagegen der Wasserstoff (als Proton) die Doppelbindung im ersten Schritt an. In beiden Fällen bilden sich jeweils die stabilsten Zwischenprodukte, nämlich ein sekundäres Alkyl-Radikal bei der radikalischen Addition bzw. ein sekundäres Carbenium-Ion bei der elektrophilen Addition. Bei der radikalischen HBr-Addition lagert sich dann ein H-Atom an das sekundäre Radikal an, bei der elektrophilen Addition aber ein Bromid-Anion.
Synthese von Polymeren
Polymere, also Makromoleküle aus vielen gleichen oder verschiedenen kleinen Bausteinen, werden nach verschiedenen Verfahren hergestellt. Bei der sogenannten Polymerisation unterscheidet man eine radikalische, eine kationische und eine anionische Polymerisation. Die auf dieser Seite besprochene radikalische Addition spielt bei der radikalischen Polymerisation eine entscheidende Rolle, wie auf der entsprechenden Seite näher ausgeführt wird.