Allgemeines
So komisch wie es klingt, aber der Sehprozess ist eng verwandt mit dem Riechprozess.
In beiden Prozessen spielen G-Protein-gekoppelte Rezeptoren eine entscheidende Rolle.
Riechprozess:
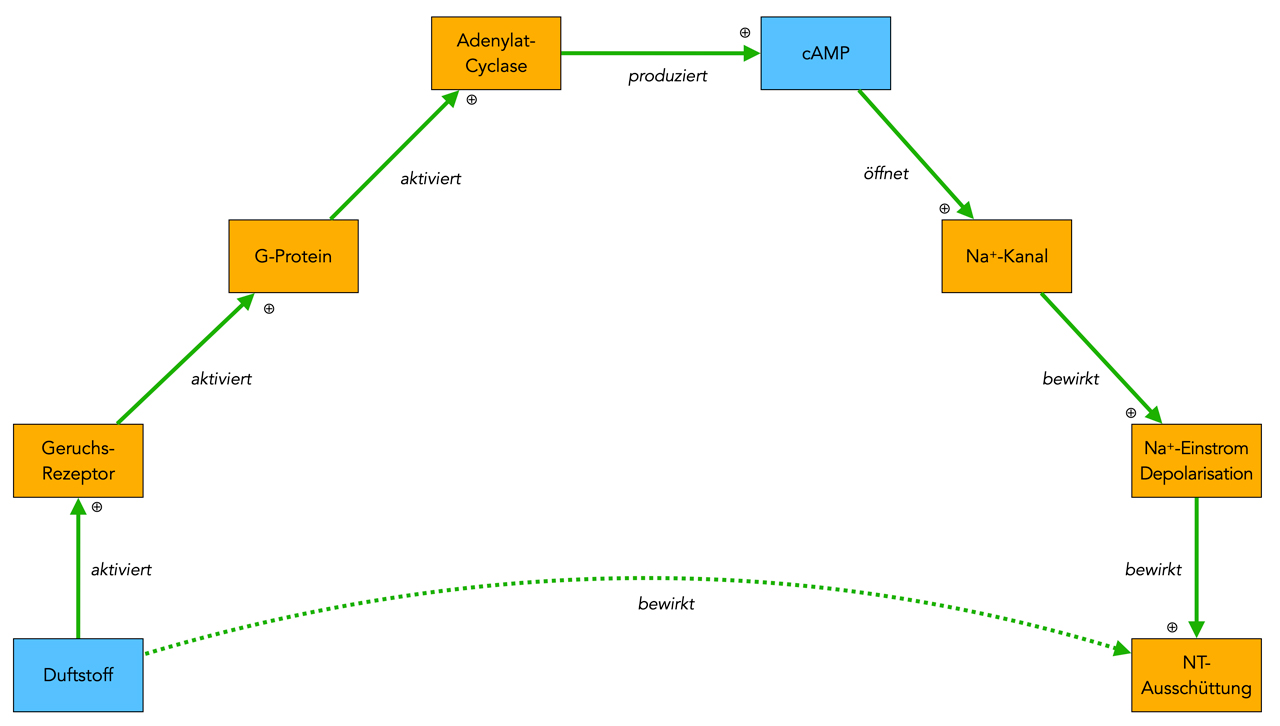
Beim Riechprozess dockt ein Geruchsstoff an den Rezeptor an, der dann über ein G-Protein eine Adenylatcyclase aktiviert, die daraufhin cAMP aus ATP produziert. Das cAMP setzt sich dann von innen an Natrium-Kanäle und öffnet diese, woraufhin dann Natrium-Ionen in die Zelle strömen und die Membran depolarisieren. Dies bewirkt dann die Ausschüttung von Neurotransmittern an die nachfolgenden Nervenzellen.
Zusammenfassend kann man also sagen, dass der Duftstoff die Ausschüttung von Neurotransmittern bewirkt. Diese Tatsache wird durch den unteren grünen Pfeil verdeutlicht. Es handelt sich aber um eine indirekte Wirkung um "mehrere Ecken".
Sehprozess:
Betrachten wir nun ein analoges Schema zum Sehprozess:
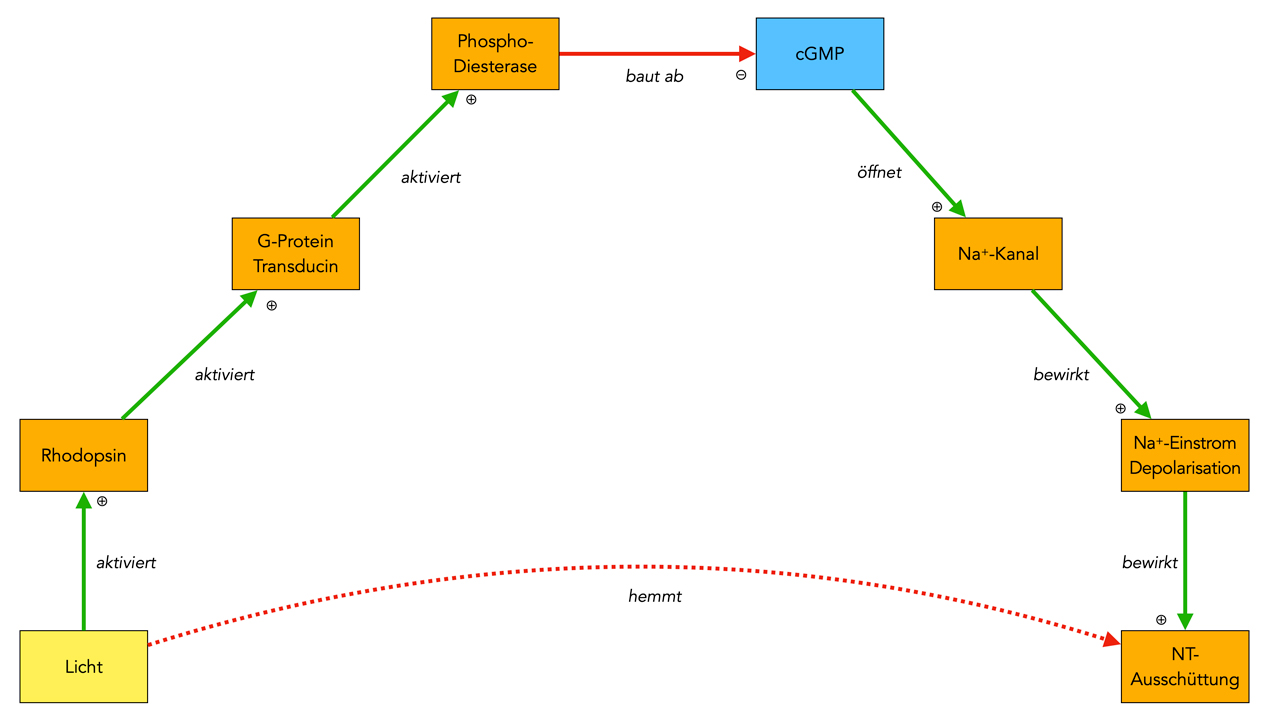
Auf den ersten Blick ähneln sich die beiden Abläufe sehr stark. Das einfallende Licht aktiviert ein Protein namens Rhodopsin, das wieder ein G-Protein aktiviert (das sogar einen eigenen Namen hat, nämlich Transducin) welches seinerseits ein weiteres Enzym aktiviert - genau wie beim Riechprozess.
Das weitere Enzym ist die Phosphodiesterase. Im Gegensatz zur Adenylatcyclase baut die Phosphodiesterase keinen sekundären Botenstoff auf, sondern im Gegenteil, sie baut diesen ab. Der sekundäre Botenstoff cGMP wird zu GMP umgesetzt.
Das cGMP öffnet genau wie das cAMP beim Riechprozess auch beim Sehprozess die Natrium-Kanäle in der Zellmembran, durch die einströmenden Natrium-Ionen kommt es zu einer Depolarisierung und zu einer Ausschüttung von Neurotransmittern.
Durch den Einfall von Licht wird aber das cGMP abgebaut, so dass sich die cGMP-Konzentration verringert. Die Natrium-Kanäle schließen sich, eine Depolarisation findet nicht statt, und es kommt auch zu keiner Transmitter-Ausschüttung.
Zusammenfassend kann man also sagen, dass der Einfall von Licht eine Neurotransmitter-Ausschüttung des Photorezeptors verhindert bzw. hemmt.
Dunkelstrom
Und genau so ist es. Ein Photorezeptor, sei es ein Stäbchen oder ein Zapfen, schüttet im Dunklen ständig Neurotransmitter aus. Bei Belichtung (mit der richtigen Wellenlänge) wird dieser Prozess gehemmt bzw. stillgelegt. Das ständige Einströmen von Natrium-Ionen im Dunklen bezeichnet man übrigens als Dunkelstrom.
Dieser Dunkelstrom wird durch die Absorption von Licht unterbunden.
Wieso "sehen" wir etwas, wenn Licht den Dunkelstrom hemmt?
Sie haben sicherlich schon einmal etwas von hemmenden Synapsen gehört. Wird hier ein Neurotransmitter ausgeschüttet, so öffnen sich Chlorid-Kanäle (seltener auch Kalium-Kanäle) in der postsynaptischen Membran, und es findet eine Hyperpolarisierung statt.
Die Synapsen der Photorezeptoren kann man als hemmende Synapsen betrachten. Solange der Dunkelstrom fließt, schütten diese Synapsen Neurotransmitter aus. Und diese Neurotransmitter hemmen die nachfolgende Zelle, so dass diese keine Aktionspotenziale über den Sehnerv zum Gehirn schicken kann.
Wird der Photorezeptor dagegen belichtet, wird dieser Dunkelstrom gehemmt, und es werden keine hemmenden Neurotransmitter mehr an die nachfolgenden Zellen ausgeschüttet. Da diese nicht mehr gehemmt werden, senden sie nun Aktionspotenziale über den Sehnerv an das Sehzentrum des Gehirns, und wir "sehen" etwas.
Der Sehprozess im Detail
Die folgende Zeichnung zeigt den oberen Teil eines Zapfens oder Stäbchens:
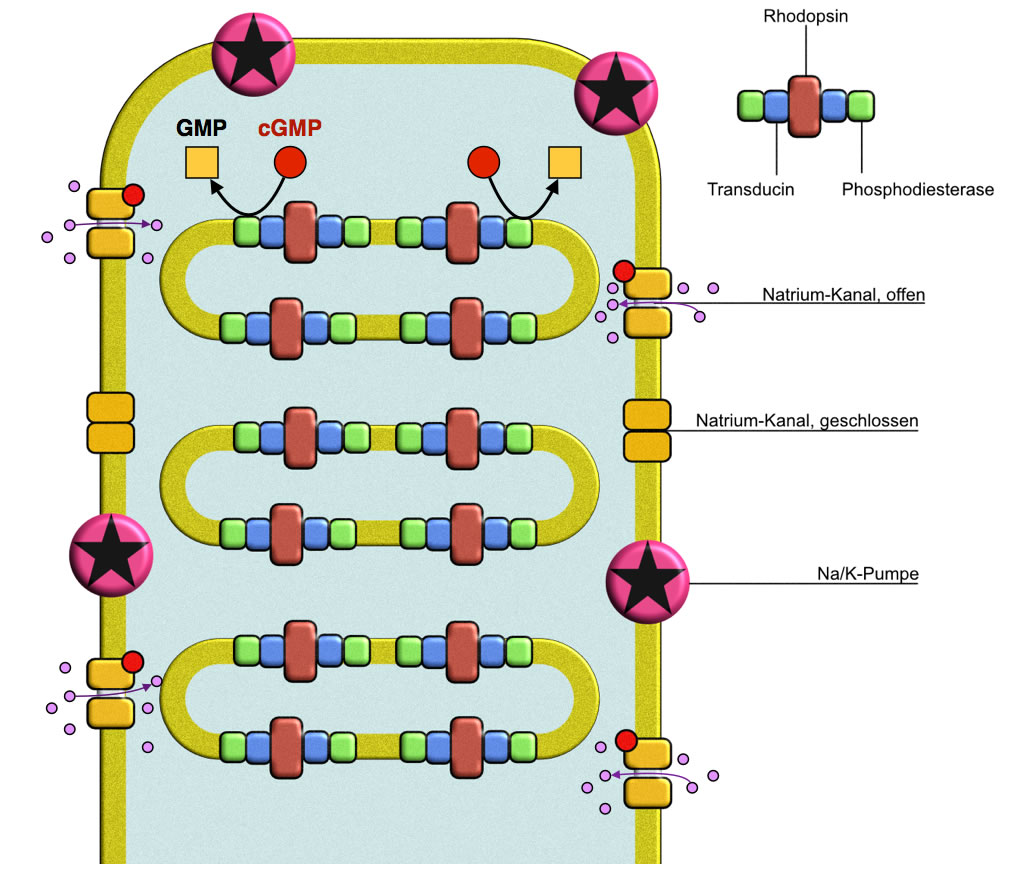
Vereinfachte Darstellung der photochemischen Vorgänge beim Sehprozess
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Wir befinden uns hier im oberen Teil des Außensegments eines Photorezeptors, drei der vielen Discs sind vergrößert dargestellt, und man erkennt die drei Schlüsselenzyme des Sehprozesses, das Rhodopsin, das Transducin (ein G-Protein) und die Phosphodiesterase.
Ein Lichtquant kann hundertfach verstärkt werden
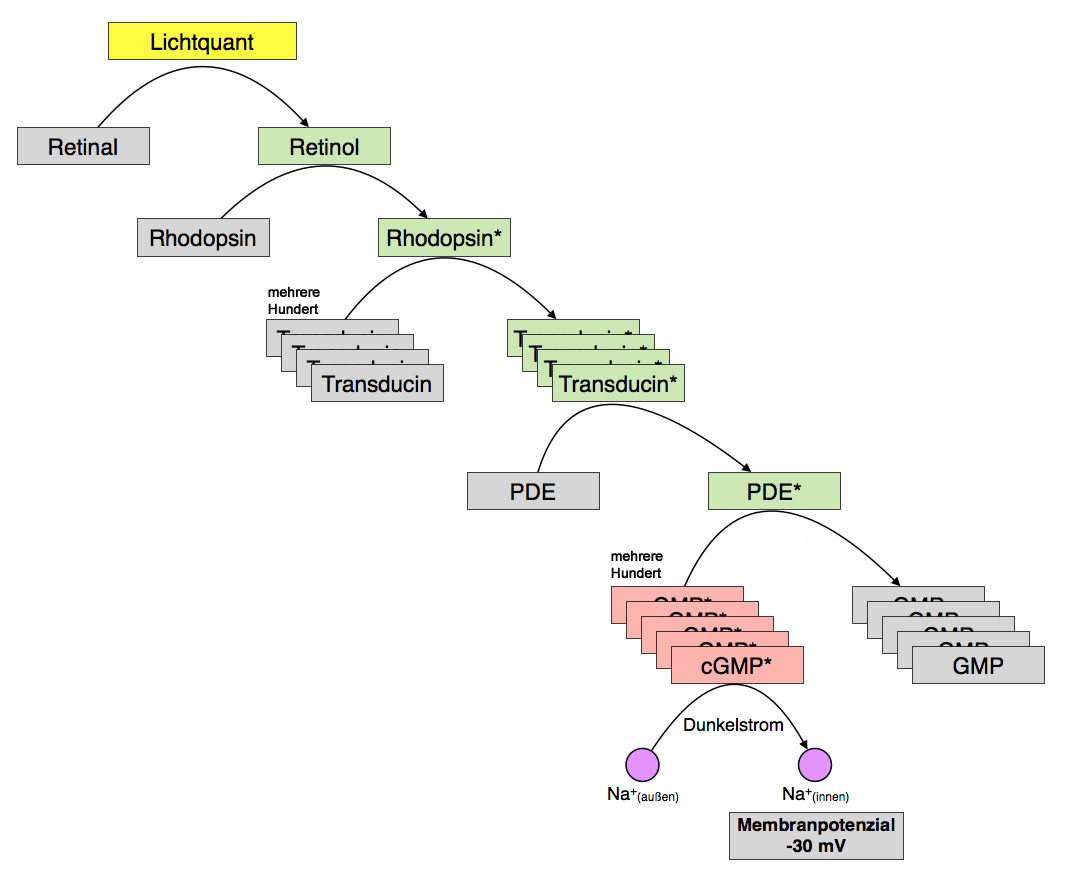
Im Zentrum des Sehprozesses steht das Protein Rhodopsin. Das Rhodopsin besteht aus zwei Anteilen, dem Protein Opsin und dem Aldehyd Retinal. Das Retinal spielt eine Schlüsselrolle im Sehprozess. Wenn das Retinal-Molekül Licht absorbiert, ändert es seine Struktur (siehe "Der Retinal/Retinol-Zyklus"). Daraufhin wird auch der Opsin-Anteil des Rhodopsins verändert, und das aktivierte Rhodopsin wiederum aktiviert mehrere Hundert Transducin-Moleküle, die sich ebenfalls in der Membran der Discs befinden. Der eingefallene Lichtreiz wird also mehr als hundertfach verstärkt [1, 2].
Aber damit sind wir noch lange nicht am Ende. Jedes Transducin-Molekül wiederum kann ein Molekül des Enzyms Phosphodiesterase aktivieren. Hier kann man keinen Verstärkungseffekt beobachten; das Verhältnis Transducin zu Phosphodiesterase ist ungefähr 1:1.
Dass hier keine weitere Verstärkung stattfindet, liegt an der Natur des G-Proteins Transducin. Das Transducin spaltet eine Untereinheit ab, die dann zur Phosphodiesterase (PDE) wandert und diese aktiviert. Da ein Transducin-Molekül jeweils nur eine dieser Untereinheiten hat, kann ein Transducin-Molekül auch nur ein PDE-Molekül aktivieren.
Die Rolle der Phosphodiesterase
Jedes Phosphodiesterase-Molekül kann den sekundären Botenstoff cGMP in einfaches GMP umwandeln (cGMP = cyclisches Guanosinmonophosphat, GMP = Guanosinmonophosphat, ähnlich aufgebaut wie cAMP bzw. AMP). Hier kann man wieder einen enormen Verstärkungseffekt beobachten: Jedes Phosphodiesterase-Molekül kann ca. 1000 cGMP-Moleküle pro Sekunde [1] oder zumindest mehrere Hundert cGMP-Moleküle [2] in GMP umwandeln.
Der Gesamtverstärkungseffekt hat jetzt einen Wert von ungefähr 1.000.000. Das heißt, ein einzelner absorbierter Lichtquant kann den Abbau von einer Millionen cGMP-Molekülen zu GMP verursachen. Das ist der Grund dafür, dass wir selbst in nahezu vollständiger Dunkelheit noch etwas sehen können (natürlich nicht so gut wie Katzen oder andere Raubtiere, die noch zehnfach besser im Dunklen sehen können).
Was bewirkt jetzt dieser massive Abbau von cGMP?
Bisher haben wir uns auf die Membran der Discs konzentriert, die sich zu Hunderten im Innern eines Photorezeptors befinden. Schauen wir uns nun die Außenmembran eines Photorezeptors an. Dort befinden sich weitere Enzyme bzw. Proteine.
Die Natrium-Kanäle in der Außenmembran sind normalerweise - also im Dunklen - geöffnet.
Das ist allerdings ungewöhnlich. Normalerweise sind Natrium-Kanäle im "Ruhezustand" geschlossen und werden erst dann geöffnet, wenn die Zelle Informationen empfangen oder weiterleiten soll. Chemisch gesteuerte Natrium-Kanäle der postsynaptischen Membran öffnen sich beispielsweise erst dann, wenn die präsynaptische Zelle Neurotransmitter ausschüttet. Spannungsgesteuerte Natrium-Kanäle der Axonmembran öffnen sich erst dann, wenn das Membranpotenzial am Axon einen gewissen Schwellenwert erreicht hat.
Die Natrium-Kanäle der Außenmembran eines Photorezeptors werden durch cGMP-Moleküle offengehalten, die sich in ein entsprechendes allosterisches Zentrum der Kanalproteine setzen. Durch die geöffneten Kanäle fließen ständig Natrium-Ionen nach innen, und die Natrium-Kalium-Pumpe ist ständig aktiv, um diese Natrium-Ionen wieder nach außen zu befördern. Man spricht hier von einem ständigen Dunkelstrom. Das Membranpotenzial liegt bei einem Stäbchen im Dunklen ungefähr bei -30 mV.
Licht unterbricht den Dunkelstrom
Wird der Photorezeptor nun belichtet, so wird die oben beschriebene Verstärkungskaskade in Gang gesetzt; ein einziges Lichtquant sorgt für den Abbau von sechs Millionen cGMP-Molekülen. Wenn die cGMP-Moleküle abgebaut werden, können aber die Natrium-Kanäle in der Außenmembran nicht mehr offen gehalten werden, und der Dunkelstrom kommt zum Erliegen. Der Photorezeptor schaltet auf "passiv", das Membranpotenzial verändert sich dank der Natrium-Kalium-Pumpe auf Werte, wie sie für ein Ruhepotenzial typisch sind, also auf ca. -70 mV. Und wie oben schon in der Einleitung ausgeführt, werden die nachfolgenden Nervenzellen nicht mehr gehemmt, so dass diese Informationen zum Gehirn schicken können.
Zusammenfassung
Im Dunklen
Die Natriumkanäle sind mit cGMP besetzt, es strömen Natrium-Ionen ein (Dunkelstrom). Ein Großteil der Natrium-Ionen wird durch die Natrium-Kalium-Pumpe wieder aus der Zelle heraus transportiert. Die Folge der erhöhten Natrium-Ionen-Konzentration: eine ständige Depolarisierung der Außenmembran, man kann ein Membranpotenzial von ca. -30 mV messen. Der Photorezeptor schüttet hemmende Neurotransmitter aus, so dass keine Informationen zum Gehirn gelangen.
Im Hellen
Die Phosphodiesterase-Moleküle werden durch Rhodopsin über das Transducin aktiviert, cGMP wird massiv abgebaut und in GMP umgewandelt. Jetzt ist nicht mehr genug cGMP vorhanden, um die Natriumkanäle offen zu halten. Die Natriumkanäle schließen sich, es strömen keine Natrium-Ionen mehr in die Zelle, und die Natrium-Kalium-Pumpe sorgt dafür, dass ganz schnell wieder "normale" Zustände herrschen, nämlich ein Membranpotenzial von ca. -70 mV.
Die nachgeschalteten Zellen, die im Dunklen von den Photorezeptoren gehemmt wurde, können jetzt nicht mehr gehemmt werden, sie werden aktiv und "wir sehen".
Der Sehprozess schematisch:
Quellen, die über allgemeines Schulbuchwissen hinausgehen:
- Kandel, Schwartz, Jessel, Siegelbaum, Hudspeth, Principles of Neural Science, Fifth Edition. McGraw-Hill Education. Kindle-Version.
- Savada, Hillis, Heller, Hacker: Purves Biologie, Springer Verlag Deutschland 2019, 10. Auflage. Herausgegeben von Jürgen Markl.