Katalysatoren
In jedem Biologiebuch liest man: "Enzyme sind Biokatalysatoren". Gemeint ist damit, dass Enzyme chemisch wie ein Katalysator wirken, aber in lebenden Zellen (Bio) vorkommen.
Definieren wir doch zuerst einmal den Begriff des Katalysators:
Katalysator = Molekül, Atom oder Ion, das eine chemische Reaktion stark beschleunigt, ohne selbst formal an der Reaktion teilzunehmen.
"Formal" heißt hier, dass der Katalysator nicht in der Reaktionsgleichung auftaucht, weder auf der linken Seite noch auf der rechten. Aber man darf den Katalysator über den Reaktionspfeil schreiben.
Aus der Chemie kennen Sie vielleicht Reaktionen, die unter saurer Katalyse ablaufen. Ein Proton verbindet sich mit einer OH-Gruppe des Ausgangsstoffs, dieser reagiert dann in ein, zwei oder mehreren Schritten zum Endprodukt, und bei der Bildung des Endprodukts wird quasi "nebenbei" wieder ein Proton abgegeben. Das Proton taucht daher in der Gesamtgleichung nicht mehr auf, nimmt aber sehr wohl an der Reaktion teil. Auch einen solchen Stoff bezeichnen wir als Katalysator.
Katalysatoren bewirken die Beschleunigung der Reaktion auf das Millionenfache oder mehr, indem Sie Ordnung schaffen und so die Wahrscheinlichkeit eines erfolgreichen Zusammenstoß zwischen den Teilchen erhöhen.
Bei einer chemischen Reaktion im flüssigen Medium, wie sie in einer Zelle tausendfach ständig ablaufen, müssen die Teilchen, die miteinander reagieren sollen, möglichst passgenau zusammenstoßen. Es hängt dann von mehreren Faktoren wie Konzentration der Teilchen, Temperatur, Dichte des Mediums u.a. ab, wie wahrscheinlich ein solcher Zusammenstoß ist. Leider ist die Wahrscheinlichkeit für einen "erfolgreichen" Zusammenstoß zweier Edukt-Moleküle (zum Beispiel Glucose und ATP) äußerst gering. Würde man Glucose und ATP, die beiden Ausgangsstoffe des ersten Schrittes der Glycolyse, einfach so zusammen in ein Reagenzglas geben, könnte man wahrscheinlich Stunden, Tage oder Wochen warten, bis ein nennenswerter Umsatz stattfindet. Gibt man jedoch ein passendes Enzym dazu, läuft die Reaktion in Sekundenbruchteilen ab. Das Enzym erhöht nämlich die Wahrscheinlichkeit, dass die beiden Edukt-Teilchen erfolgreich zusammenstoßen.
Die RGT-Regel
Natürlich könnte man nach der RGT-Regel die Geschwindigkeit einer chemischen Reaktion auch durch Erhöhung der Temperatur günstig beeinflussen. Leider ist diese Möglichkeit in lebenden Zellen stark eingeschränkt. Bei einer Außentemperatur von 10 ºC könnte eine Erhöhung der Temperatur in den Organen eines Lebewesens auf 30 ºC eine Vervierfachung der Geschwindigkeit bewirken, vielleicht auch eine Verfünf- oder Versechsfachung. Eine noch höhere Temperatur würde die Zelle nicht aushalten, die Proteine würden anfangen, zu denaturieren. Mit Enzymen kann man solche Reaktionen jedoch leicht um den Faktor 104 bis 107 und mehr beschleunigen. Rechnen Sie doch selbst einmal aus, welche Temperatur man vorgeben müsste, um eine solche Beschleunigung zu bewirken.
Wie arbeitet ein Enzym im Prinzip?
Ein Enzym wie die Hexokinase, das die Reaktion
Glucose + ATP → Glucose-6-Phosphat + ADP
katalysiert, hat in seiner Raumstruktur zwei taschenartige Ausbuchtungen, in die Moleküle hineinpassen. Solche Taschen bezeichnet man auch als aktive Zentren. Die eine Tasche dient zur Aufnahme eines Glucose-Moleküls, die andere Tasche zur Aufnahme eines ATP-Moleküls. Durch eine kleine Veränderung der Raumstruktur kann das Enzym nun die beiden Edukte der obigen Reaktion so nahe zusammenbringen, dass eine Phosphatgruppe des ATP-Moleküls auf das Glucose-Molekül übertragen wird.
Würden die Glucose- und die ATP-Moleküle einfach nur frei in der Lösung herumschwimmen, dann wäre die Wahrscheinlichkeit eines erfolgreichen Zusammenstoßes nicht allzu groß, es würde vermutlich Monate oder sogar Jahre dauern, bis alle Glucose-Moleküle phosphoryliert wären. Durch die gezielte Zusammenführung der beiden Moleküle kann die Reaktion jedoch um einen Faktor, der mehrere Zehnerpotenzen beträgt, beschleunigt werden.
Katalysatoren senken die Aktivierungsenergie
Ein Beispiel, das Sie sicherlich aus dem Chemieunterricht kennen, ist die Verbrennung von Magnesium über dem Bunsenbrenner. Eine grell-weiße Flamme entsteht dabei, daran erinnern Sie sich bestimmt noch.

Ein Schüler verbrennt Magnesium
Photo: Ulrich Helmich, Lizenz: siehe Seitenende
In der Chemiesammlung liegt das Magnesium aber über Jahre an der Luft, ohne zu verbrennen. Es bildet sich mit der Zeit nur ein kleiner dunkler Überzug aus Magnesiumoxid. Wieso entzündet sich das Magnesium nicht spontan, wenn es mit Luft in Berührung kommt? Und wenn man etwas Magnesiumband über die Flamme des Bunsenbrenners hält, fängt es auch nicht sofort an zu brennen, sondern es dauert ein paar Sekunden, bis es zur Reaktion kommt. Wie kann man dies erklären?
Ein anderes Beispiel aus dem Alltag: Glucose ist ein Nährstoff mit einem sehr hohen Brennwert. Mit Sauerstoff reagiert Glucose in einer heftigen Reaktion. Trotzdem beginnt der Zucker nicht zu brennen, wenn man die Packung öffnet. Man muss ihn erst ziemlich stark erhitzen.
Im Chemieunterricht erklärt man solche Phänomene mit dem Begriff der Aktivierungsenergie und zeichnet meistens gleich ein Energiediagramm dazu, das vielleicht so aussieht:
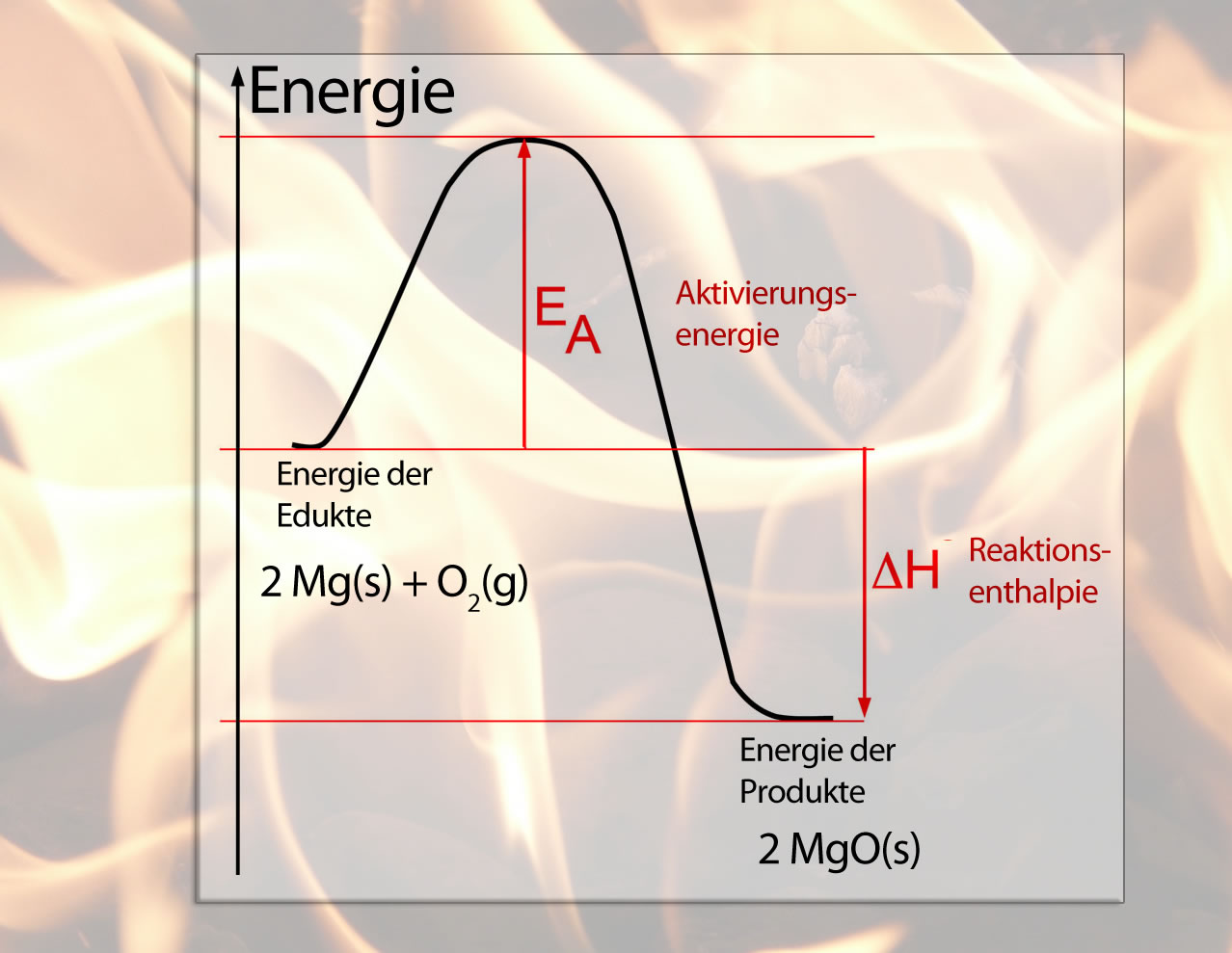
Energiediagramm der Oxidation von Magnesium
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Die Reaktion des Magnesiums mit dem Sauerstoff setzt nicht spontan ein, es muss erst ein "Aktivierungsberg" überwunden werden. So nennt man den "Berg" in der Graphik tatsächlich manchmal. Besser ist es aber, von einer Aktivierungsenergie zu sprechen, die überwunden werden muss.
Je höher dieser Aktivierungsberg, desto schwieriger ist es, die Reaktion zu starten, und desto geringer ist die Reaktionsgeschwindigkeit. Ein niedriger Aktivierungsberg kann leicht überwunden werden, entsprechend hoch ist die Reaktionsgeschwindigkeit von Reaktionen mit geringer Aktivierungsenergie.
Ein Katalysator beschleunigt nun eine chemische Reaktion, indem er diese Aktivierungsenergie absenkt. Dadurch wird die Reaktion stark beschleunigt.
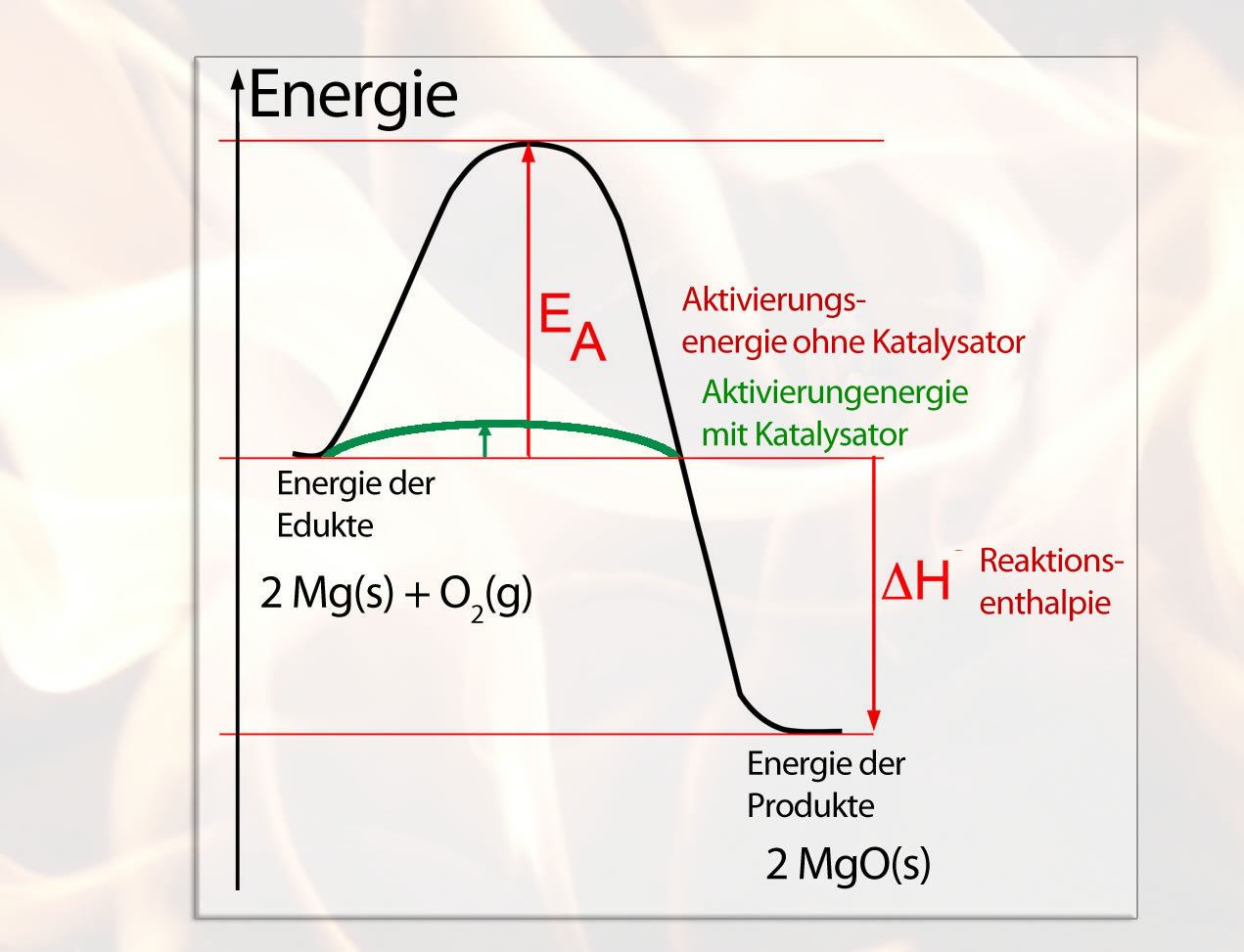
Ein Katalysator erniedrigt die Aktivierungsenergie
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Hier sehen wir das Ganze noch mal graphisch dargestellt. Der Katalysator / das Enzym senkt die Aktivierungsenergie, so dass die Reaktion erheblich schneller ablaufen kann. Die Reaktionsenthalpie wird durch den Katalysator allerdings nicht verringert oder erhöht, nur die Aktivierungsenergie.
Viele chemische Reaktionen sind Gleichgewichtsreaktionen, das heißt, sie sind umkehrbar und können in beide Richtungen ablaufen. Ein phosphoryliertes Glucose-Molekül könnte zum Beispiel seine Phosphatgruppe wieder abgeben. Ein Katalysator beschleunigt dann auch die Umkehrreaktion, denn für die umgekehrte Reaktion wird ja die Aktivierungsenergie ebenfalls abgesenkt. Weil nun aber beide Reaktionsrichtungen gleichermaßen beschleunigt werden, kann ein Katalysator die Lage des chemischen Gleichgewichts nicht verändern.
Merke:
Katalysatoren beschleunigen chemische Reaktionen um mehrere Zehnerpotenzen, indem sie die Aktivierungsenergie absenken. Die Reaktionsenthalpie der Umsetzung wird dagegen durch den Katalysator nicht verändert, auch nicht die Lage des chemischen Gleichgewichts. Ein Katalysator beschleunigt umkehrbare Reaktionen also in beide Richtungen.
Wenn Sie sich genauer über die Arbeitsweise von Katalysatoren informieren wollen, gehen Sie auf diese Seite in meinem Chemie-Lexikon.
Enzyme sind die besseren Katalysatoren
Eine bekannte Reaktion, die oft im Unterricht durchgeführt ist, wenn es um das Thema Katalyse geht, ist die Zersetzung von Wasserstoffperoxid in Wasser und Sauerstoff.
$2 \ H_2O_2 \to 2 \ H_2O + O_2$
Die Aktivierungsenergie der nicht-katalysierten Reaktion liegt bei ca. 75 kJ/mol. Ein Platin-Katalysator senkt die Aktivierungsenergie auf rund 50 kJ/mol, während das Enzym Katalase die Aktivierungsenergie auf nur noch 8,4 kJ/mol senkt [1].
Wenn wir die Reaktionsgeschwindigkeit der nicht-katalysierten Reaktion auf den Wert 1 setzen, dann erhöht der Platin-Katalysator die Reaktionsgeschwindigkeit auf den Wert 104, also auf das Zehntausendfache. Das ist enorm, aber noch gar nichts gegen das, was das Enzym Katalasebewirkt. Katalase erhöht die Reaktionsgeschwindigkeit auf den Wert 107, ist also tausend mal effektiver als der Platinkatalysator.
Übertragen wir diese Zahlen einmal auf ein etwas verständlicheres Beispiel. Stellen wir uns eine Eisenstange vor, die wir draußen aufbewahren. Nach 10.000 Tagen, also mehr als 27 Jahren, ist die Eisenstange mit Sicherheit komplett verrostet und bröselt weg, wenn man sie kräftig anfasst.
Der Platinkatalysator würde die Zeit um den Faktor 104 abkürzen, nämlich auf 1 Tag bzw. 24 Stunden. Das ist schon recht eindrucksvoll. Man könnte der Eisenstange beim Rosten richtig zuschauen.
Das ist aber noch gar nichts gegen die Wirkung des Enzyms Katalase. Durch den Faktor 107 würde die Katalase die Eisenstange in gut 84 Sekunden rosten lassen, wenn sie das könnte. Zum Glück kann Katalase Eisen nicht rosten lassen, jedes Enzym ist ja substratspezifisch und wirkungsspezifisch. Katalase kann also nur Wasserstoffperoxid umsetzen (das Substrat), und sie kann nur den Zerfall von Wasserstoffperoxid in Wasser und Sauerstoff katalysieren (die Wirkung).
Ein Extrembeispiel!
Vergessen Sie die Katalase, die kann jetzt weggehen und sich warm anziehen. Es gibt nämlich ein Enzym, das noch viel wirkungsvoller ist. In dem berühmten Buch "Lehninger Principles of Biochemistry" [2] finden wir auf Seite 178 Folgendes:
"The enzyme orotidine phosphate carboxylase ... provides a special example, with a rate enhancement vo 1017. "
Dieses Enzym ist also 1010 = 10.000.000.000 mal schneller als die Katalase.
Enzyme sind Proteine
Die meisten heute bekannten Enzyme sind aus mehreren bis vielen Aminosäuren zusammengesetzt, chemisch gesehen gehören die Enzyme damit zu den Peptiden und Proteinen.
Einige wenige Enzyme bestehen aus RNA-Molekülen und werden als Ribozyme bezeichnet.
Wenn Sie meinen, dass Sie nicht genug über Proteine (Eiweiße) wissen, gehen Sie bitte auf die sehr ausführlichen Proteinseiten meiner Homepage.
Protein-Enzyme sind in der Regel globuläre Proteine, haben also ein mehr oder weniger kugelförmiges Aussehen. Die molare Masse von Enzymen liegt zwischen 12.000 und mehr als 1.000.000 Dalton.
Die Einheit Dalton wird eigentlich nur in der Biochemie gebraucht. Chemiker rechnen lieber mit g/mol oder u, wenn sie molare Massen angeben wollen. Für 1000 Dalton schreibt man auch 1 kD (Kilodalton).
Aufgabe:
Aus wie vielen Aminosäuren besteht ein Enzym mit einer molaren Masse von 1.000.000 Dalton schätzungsweise?
Lösungsvorschlag:
Nehmen wir mal eine durchschnittliche Aminosäure, vielleicht Valin. Die molare Masse von Valin beträgt ca. 117 g/mol. Wenn wir 1.000.000 durch diesen Wert dividieren, erhalten wir 8.547. Ein solches "Riesen-Enzym" besteht also aus über 8.500 Aminosäuren.
Das größte menschliche Enzym heißt übrigens Titin und besteht aus über 30.000 Aminosäuren.
Cofaktoren und Coenzyme
Viele Enzyme sind reine Proteine, bestehen also ausschließlich aus einer Kette von Aminosäuren. Andere Enzyme benötigen einen sogenannten Cofaktor. Das ist entweder ein anorganisches Ion wie Fe2+ oder Mg2+, oder ein komplexes organisches Molekül, das dann als Coenzym bezeichnet wird.
Coenzyme transportieren bestimmte Atomgruppen und bringen sie zu dem Enzym. Bekannte Beispiele für solche Transport-Coenzyme sind ATP für den Transport von Phosphatgruppen, NADH2 für den Transport von Wasserstoff oder Acetyl-Coenzym A für den Transport von Acetyl-Gruppen (Essigsäure-Resten).
Aktive Zentren
Jedes Enzym hat ein, zwei oder drei aktive Zentren, das sind taschenförmige Ausbuchtungen, in die die Substrate und Hilfesstoffe hineinpassen.
Die Seitenketten bestimmter Aminosäuren verbinden sich nicht-kovalent, manchmal aber sogar auch kovalent mit bestimmten Atomgruppen des Substrats. Auch schirmt ein aktives Zentrum das Substrat von dem "Lösemittel" ab, in dem sich das Substrat normalerweise befindet. Daher können in einem aktiven Zentrum Reaktionen stattfinden, die außerhalb des Enzyms gar nicht möglich wären.
Substratspezifität
Enzyme sind hochspezifisch, d.h. sie können nur bestimmte Substrate umsetzen. Manche Enzyme verarbeiten nur Glucose, andere nur Fructose, und wieder andere nur bestimmte Fettsäuren.
Die Ursache für diese Substratspezifität ist das Schlüssel-Schloss-Prinzip: das Substrat passt in das zugehörige aktive Zentrum wie ein Schlüssel ins Schloss.
Einige Enzyme arbeiten nach dem induced-fit-Modell: Hier wird die Passung zwischen Substratmolekül und Enzym nachträglich verbessert, indem das Substratmolekül eine Konformationsänderung des Enzyms bewirkt, so dass es noch fester vom aktiven Zentrum umschlossen ist.
Wirkungsspezifität
Enzyme sind aber nicht nur substratspezifisch, sondern auch gleichzeitig reaktionsspezifisch oder wirkungsspezifisch. Glucose ist eine Verbindung, die in vielen verschiedenen Stoffwechselprozessen eine Rolle spielt und daher auch von vielen verschiedenen Enzymen als Substrat akzeptiert wird. Jedes dieser Enzyme katalysiert aber eine andere Reaktion der Glucose: manche Enzyme hängen eine Phosphatgruppe an das Glucosemolekül an, andere Enzyme schneiden vielleicht eine OH-Gruppe ab, wieder andere können vielleicht zwei Glucose-Moleküle zusammenbauen etc.
Auf diesen Vertiefungsseiten (Bio-LK, Studium) finden sie weitere Informationen zu diesen beiden wichtigen Aspekten.
Quellen, die über allgemeines Schulbuchwissen hinausgehen:
- Hafner: Biochemie, Schroedel-Verlag 1994.
- Nelson, Cox: LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
Seitenanfang -
Weiter mit
der Enzymkinetik...