Nach der hoffentlich allgemeinverständlichen Einleitung zum Thema "Entropie" gehen wir auf dieser Seite nun ans "Eingemachte", wie man so sagt. Grundkenntnisse der Chemie, vor allem der Energetik chemischer Reaktionen, sind hier von Vorteil, aber nicht zwingend erforderlich.
Hauptsätze der Thermodynamik
Mit dem Begriff der Entropie beschäftigt sich auch der wichtige zweite Hauptsatz der Thermodynamik, den man aber nur richtig verstehen kann, wenn man auch den ersten Hauptsatz kennt. Daher sollen hier die beiden Hauptsätze kurz vorgestellt werden.
1. Hauptsatz
Die Energie des Universums ist konstant. Energie kann weder erzeugt noch vernichtet werden.
Oder wie es im neuen Lehninger [1] formuliert ist:
"For any physical or chemical exchange, the total amout of energy in the universe remains constant; energy may change form or it may be transportet from one region to another, but it can not be created or destoyed."
In der Didaktik der Naturwissenschaften legt man stets Wert darauf zu sagen, dass es keine Energieerzeuger gibt. Wenn Ihnen also irgendjemand einen Energieerzeuger verkaufen will, so hat dieser Mensch sicherlich den Nobelpreis für Physik verdient. Ein "Energieerzeuger", der zum Beispiel aus Sonnenlicht elektrischen Strom "erzeugt", ist kein Energieerzeuger, sondern ein Energieumwandler. Das Sonnenlicht - genauer gesagt die elektromagnetische Energie des Sonnenlichts - wird in elektrische Energie - in Strom - umgewandelt ("energy may change form...").
Es gibt keine Energieerzeuger! Alle angeblichen Energieerzeuger sind Energiewandler. Ein Energieerzeuger würde den ersten Hauptsatz der Thermodynamik verletzen.
Kommen wir nun zum zweiten Hauptsatz der Thermodynamik:
2. Hauptsatz
Jeder Energietransport und jede Energieumwandlung erhöhen die Entropie des Universums.
Im Lehninger wird es noch deutlicher formuliert: "In all natural processes, the entropy of the universe increases". Also nicht nur Energieumwandlungen oder -transporte erhöhen die Entropie des Universums, sondern alle (!) natürlichen Prozesse (und natürlich auch alle technischen Vorgänge).
Die Konsequenz aus diesem zweiten Hauptsatz ist leider etwas unangenehm für uns alle. Irgendwann, in mehreren Milliarden Jahren, ist die Entropie des Universums maximal, alle Galaxien und alle Planeten sind vernichtet, es existiert nur noch eine riesige Energiewolke, in der maximale Unordnung besteht. Aber, wie gesagt, das dauert noch ein paar Milliarden Jahre, wir sollten uns deswegen also nicht aufregen.
Zunächst ein kleiner Versuch...
Wie so oft auf meiner Homepage beginne ich komplexe theoretische Themen gern mit einem kleinen Versuch, den ich im Chemie- oder Biologie-Unterricht am Söderblom-Gymnasium schon mal öfters durchgeführt habe.
Lösen von Ammoniumnitrat NH4NO3
Durchführung:
Wir nehmen ein Becherglas, füllen kaltes Leitungswasser hinein, messen die Temperatur, die dann meistens zwischen 20 und 22 Grad Celsius liegt, und geben dann einen gehäuften Teelöffel Ammoniumnitrat in das Wasser, ohne dabei umzurühren. Durch das Rühren würden wir dem System ja Energie zuführen (streng genommen: mechanische Energie in Wärmeenergie umwandeln), und das wollen wir unbedingt vermeiden.
Beobachtungen:
Nach einer Minute messen wir die Temperatur der Lösung, und siehe da: die Temperatur ist gesunken, auf 12 Grad Celsius oder sogar noch weniger.
Es gibt auch ein YouTube-Video, in dem dieser Vorgang gezeigt wird.
Dieses Versuchsergebnis erstaunt auf den ersten Blick. Es handelt sich um einen endothermen Vorgang, der völlig spontan und freiwillig abläuft.
Die meisten Leute erwarten nicht, dass ein endothermer Vorgang, also eine Reaktion, bei der man Wärme zuführen muss, freiwillig oder spontan abläuft. Hier haben wir aber ein Beispiel, wo genau das passiert.
Wieso kann man sagen, dass das Auflösen von Ammoniumnitrat in Wasser ein endothermer Vorgang ist?
Ganz einfach! Würde sich das Becherglas beim Auflösen des Salzes erwärmen, würde keiner fragen, wieso das ein exothermer Vorgang ist. Man kann ja regelrecht mit der Hand fühlen, wie Wärme bzw. Energie an die Umgebung abgegeben wird. Beim Auflösen von Ammoniumnitrat ist nun das Gegenteil der Fall, das Becherglas kühlt sich ab. Also muss es sich logischerweise um einen endothermen Vorgang handeln, bei dem der Umgebung Wärme entzogen wird.
OK, das ist klar. Aber wieso läuft dieser endotherme Vorgang freiwillig bzw. spontan ab?
Ja, liebe Leute, um das zu erklären, müssen wir jetzt etwas weiter ausholen und einen kleinen Ausflug in die Thermodynamik machen, also in das Teilgebiet der Chemie, das sich mit Energieumsetzungen beschäftigt. Machen wir doch einfach mal den "Sprung ins kalte Wasser" (bzw. in die kalte Ammoniumnitrat-Lösung, aber das wäre vielleicht nicht so gesund und außerdem sehr teuer).
Die Gibbs-Helmholtz-Gleichung
Aus dem Chemie-Unterricht der Oberstufe kennen Sie sicherlich den Begriff der Reaktionsenthalpie.
Unter Enthalpie versteht man die Summe aus der inneren Energie U eines Systems und dem Produkt aus Druck p und Volumen V des Systems:
H = U + pV
Die Enthalpie eines Systems (zum Beispiel eines Reagenzglases mit etwas Schwefel und etwas Eisenpulver) kann nicht direkt gemessen werden. Was man aber messen kann, sind Enthalpie-Änderungen ΔH = HProdukte - HEdukte. Treten diese Enthalpie-Änderungen bei einer chemischen Reaktion auf, spricht von der Reaktionsenthalpie.
Bei endothermen Reaktionen ist ΔH positiv, weil Energie aus der Umgebung zugeführt wird. Die Energie der an der Reaktion beteiligten Stoffe steigt also insgesamt an, die Produkte haben eine größere Enthalpie als die Edukte. Dieser Energieanstieg wird durch ein positives Vorzeichen verdeutlicht.
Bei einer exothermen Reaktion ist das Gegenteil der Fall. Insgesamt wird Energie an die Umgebung abgegeben, daher ist ΔH bei einer exothermen Reaktion negativ. Die Energie bzw. Enthalpie H der an der Reaktion beteiligten Stoffe nimmt ab. Man sagt auch, es wird ein "energetisch günstigerer Zustand eingenommen".
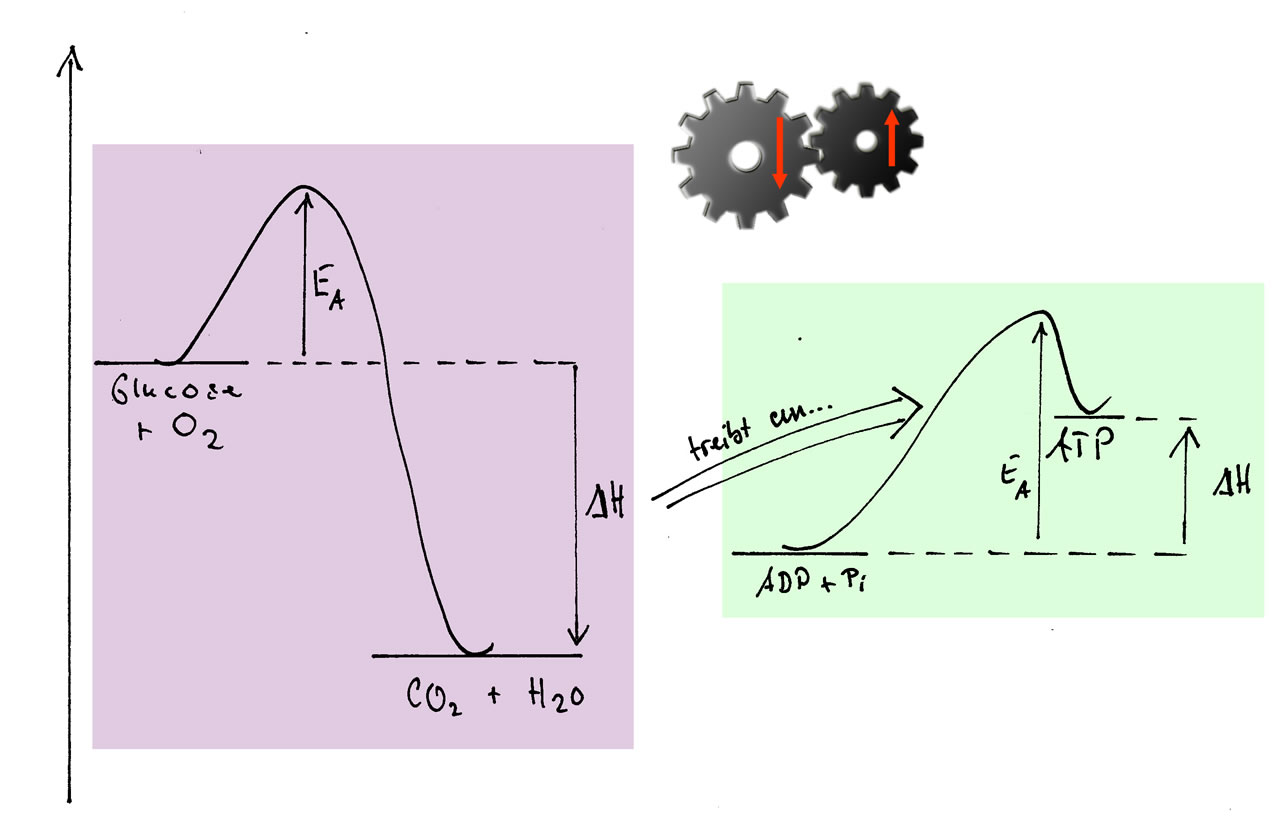
Eine exotherme Reaktion treibt eine endotherme an
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Auf diesem Bild sehen wir links das Energiediagramm einer exothermen Reaktion, Glucose und Sauerstoff reagieren zu Kohlendioxid und Wasser. Auf der rechten Seite sehen wir eine endotherme Reaktion, nämlich die Bildung von ATP aus ADP und Phosphat. Die innere Energie von ATP ist höher als die von ADP und Phosphat zusammen. Eine solche endotherme Reaktion kann durch eine gleichzeitig stattfindende exotherme Reaktion angetrieben werden. Nichts anderes passiert während der Oxidation von Glucose im menschlichen Körper, wir verbrennen Glucose (und andere Nährstoffe), um letzten Endes viel ATP zu erzeugen, das wir für alle möglichen Prozesse in den Zellen, Geweben und Organen brauchen.
Endotherme Reaktionen mit einem positiven ΔH können freiwillig ablaufen
Die Bildung von ATP aus ADP muss durch eine exotherme Reaktion angetrieben werden, es muss also Energie zugeführt werden. Das Abkühlen der Ammoniumnitrat-Lösung allerdings geschieht spontan, ohne Zufuhr von Energie, obwohl es eine endotherme Reaktion (also mit ΔH > 0) ist.
Auch in lebenden Zellen haben wir viele solcher endothermen Prozesse, die aber spontan ablaufen. Um solche Prozesse zu erklären, hat man einen erweiterten Energie-Begriff eingeführt, die sogenannte freie Energie oder nach ihrem "Erfinder" Josiah Willard Gibbs (1878), die Gibbs-Energie ΔG.
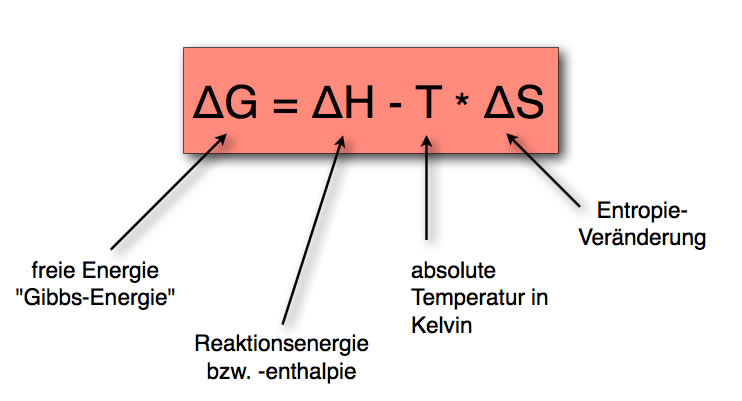
Die GIBBS-HELMHOLTZ-Gleichung
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Die Gleichung
$\Delta G = \Delta H - T \cdot\Delta S $
beschreibt, von welchen Faktoren diese freie Energie ΔG abhängig ist.
Da ist natürlich ΔH, die Reaktionsenthalpie, der wichtigste Faktor. Wenn die Reaktion stark exotherm mit einem negativen ΔH ist, sollte auch ΔG negativ sein. Umgekehrt, bei einer stark endothermen Reaktion mit einem positiven ΔH, sollte auch ΔG eigentlich positiv sein.
Dass das nicht immer so sein muss, haben wir aber bei dem Versuch mit Ammoniumnitrat gesehen, hier war ΔH positiv, ΔG aber negativ. Wäre ΔG positiv gewesen, wäre die Reaktion nicht freiwillig und spontan abgelaufen.
Also ist ΔH nicht der einzige Faktor, von dem ΔG abhängt. Schauen wir uns jetzt einmal ΔS näher an. Dieses Symbol steht für die Veränderung der Entropie. Was man unter Entropie versteht, wurde auf der vorhergehenden Seite hoffentlich anschaulich erklärt. ΔS ist nun nichts anderes, als der Entropie-Unterschied zwischen den Reaktionsprodukten und den Ausgangsstoffen, ähnlich wie ΔH der Unterschied zwischen der Enthalpie der Produkte und Edukte ist.
Was passiert nun, wenn ΔS bei einer Reaktion sehr groß ist? Zunächst einmal wird ΔS mit der Temperatur (gemessen in Kelvin) multipliziert. Je wärmer es also ist, desto größer ist der Einfluss von ΔS auf die freie Energie ΔG.
Wenn ΔS sehr groß ist und die Temperatur nicht allzu niedrig, dann wird das Produkt aus ΔS und T von ΔH subtrahiert. Und das kann dazu führen, dass ΔG einen negativen Wert annimmt, obwohl ΔHpositiv (endotherm) ist.
Und genau das passiert, wenn wir Ammoniumnitrat in Wasser auflösen. Die Reaktionsenthalpie ΔHist positiv, weil das Überwinden der Gitterenergie (der Anziehungskräfte zwischen den Ionen des Kristallgitters) unheimlich viel Energie kostet. Allerdings ist das Kristallgitter des festen Ammoniumnitrats ein hochgeordneter, entropiearmer Zustand. Durch das Auflösen des Salzes in Wasser nimmt die Entropie stark zu, die Ionen des Salzes verteilen sich im Wasser, was eine starke Zunahme der Unordnung darstellt. ΔS ist hier also ziemlich groß und vor allem positiv, denn die Reaktionsprodukte (gelöste Ammoniumnitrat-Ionen) haben eine höhere Entropie aus die Ausgangsstoffe (Ammoniumnitrat-Kristall). Nun wird ΔS aber mit der Temperatur multipliziert, und das Produkt wird dann von ΔH abgezogen. Dadurch wird ΔG negativ, und die Reaktion läuft spontan und freiwillig ab, ohne dass Energie von außen zugeführt werden muss.
Alles verstanden? Nein? Dann noch einmal die Version, die garantiert jeder versteht:
Eine endotherme Reaktion kann freiwillig ablaufen, wenn dabei die Entropie des Systems stark zunimmt.
Ach ja, für Prozesse, bei denen ΔG negativ ist, hat man den Fachbegriff exergonisch eingeführt. Entsprechend heißen Reaktionen, bei denen ΔG positiv ist, die also nicht freiwillig ablaufen, endergonisch. Bitte nicht verwechseln mit exotherm und endotherm!
Exotherm: Eine Reaktion, bei der ΔH negativ ist. Hier wird also Reaktionsenergie bzw. -enthalpie freigesetzt. Exotherme Prozesse laufen meistens freiwillig ab, aber nicht immer.
Exergonisch: Eine Reaktion, bei der ΔG negativ ist. Das kann zwei Ursachen haben:
Entweder ist ΔH negativ (exotherme Reaktion),
oder ΔH ist positiv (endotherme Reaktion), aber es findet eine starke Entropiezunahme ΔS statt.
Stenggenommen muss man auch noch folgenden Fall beachten, aber der spielt im Biologie-Unterricht meistens keine Rolle: Eine exotherme Reaktion, die nicht freiwillig abläuft, weil ΔS dabei negativ ist. Wenn also beispielsweise aus zwei gasförmigen Stoffen ein fester Stoff entsteht, dann nimmt die Entropie ab, und wenn ΔH nicht stark negativ ist, kann das dazu führen, dass die Reaktion nicht freiwillig abläuft. Allerdings kann das auch andere Gründe haben, die Aktivierungsenergie der Reaktion kann zum Beispiel besonders hoch sein, so dass die Reaktion bei Zimmertemperatur nicht abläuft, obwohl sie ja eigentlich exotherm ist. Das gilt übrigens auch für exergonische Reaktionen. Wenn die Aktivierungsenergie zu hoch ist, muss auch erst Energie zugeführt werden, damit die Reaktion abläuft.
Quellen:
- Nelson, Cox: LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
Seitenanfang -
Weiter mit "Entropie und Leben"...