Die Bildung von NaCl näher betrachtet
Im Grund wurde schon das Wichtigste zur Bildung von NaCl gesagt: Die Na-Atome haben ein Elektron zu viel, die Cl-Atome haben ein Elektron zu wenig. Damit beide Atomsorten in den begehrten Edelgaszustand kommen, gibt nun einfach jedes Na-Atom sein überschüssiges Elektron ab, und jedes Cl-Atom nimmt eines dieser abgegebenen Elektronen auf. Beide sind danach "glückliche" Edelgas-Atome, allerdings mit Natrium- bzw. Chlor-Atomkernen und positiver bzw. negativer Ladung. Dieser wichtige Vorgang ist auf dem nächsten Bild veranschaulicht:
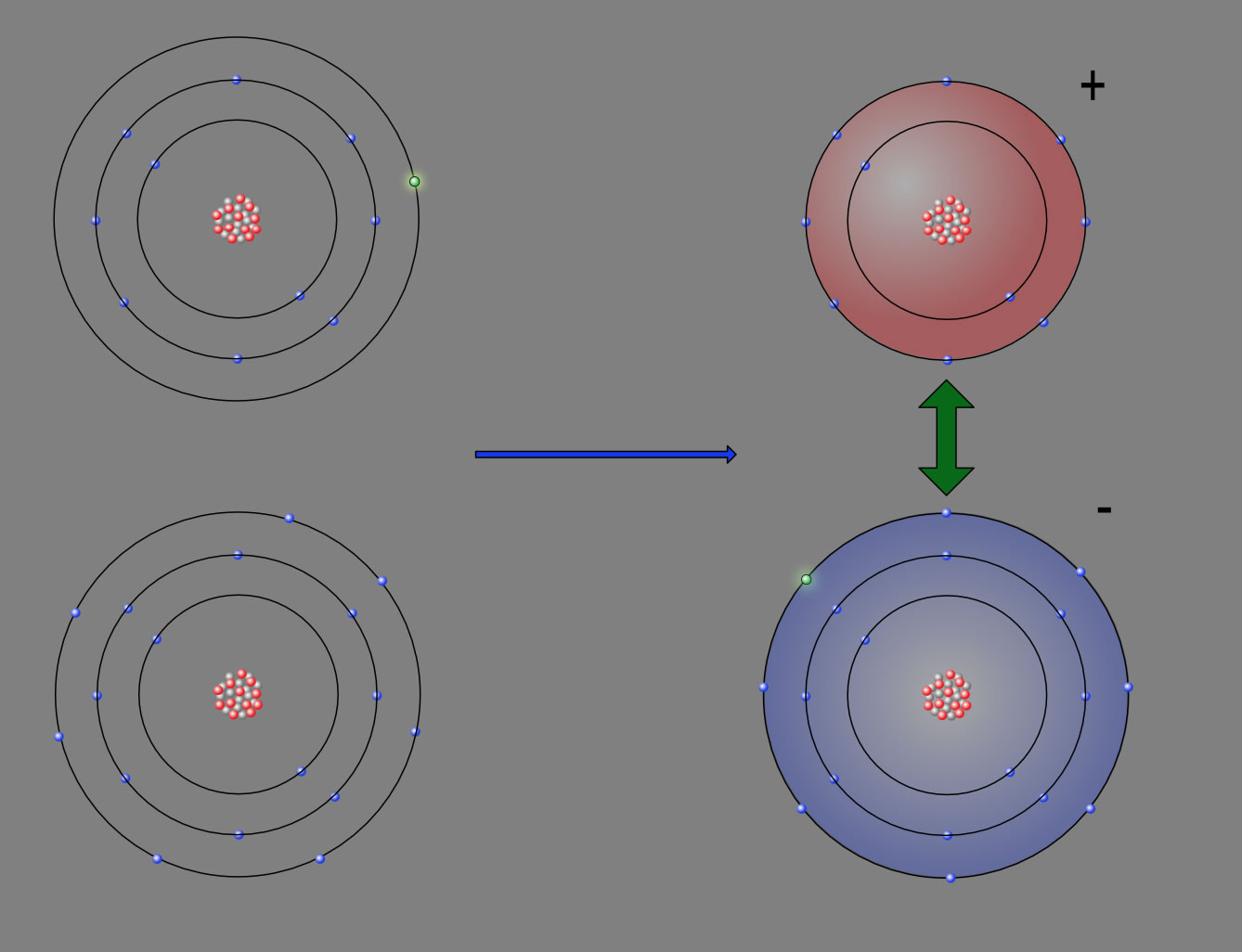
Elektronentransfer bei der NaCl-Bildung
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz. Autor: Ulrich HelmichLinks oben sehen wir ein Natrium-Atom mit einem Außenelektron (grün hervorgehoben), links unten ist ein Chlor-Atom mit sieben Außenelektronen dargestellt. Diese beiden Atome stehen für die Ausgangsstoffe der Reaktion zwischen Natrium und Chlor zu Natriumchlorid.
Nach dem Elektronentransfer sehen die Teilchen so aus wie rechts abgebildet. Aus dem Natrium-Atom ist ein positiv geladenes Natrium-Ion geworden (rot eingefärbt), und aus dem Chlor-Atom ist durch die Aufnahme des Elektrons ein negativ geladenes Chlorid-Ion geworden (blau eingefärbt).
Was bedeutet nun der dicke grüne Doppelpfeil zwischen dem Natrium- und dem Chlorid-Ion auf der rechten Seite?
Na+- und Cl--Ionen ziehen sich gegenseitig an. An der Reaktion nehmen unheimlich viele Natrium- und Chlor-Atome bzw. -ionen teil, nicht nur zwei oder vier. All diese vielen positiven und negativen Ionen ziehen sich gegenseitig an. Dabei entsteht ein regelmäßig aufgebauter Kristall. Jedes Natrium-Ion ist dabei von sechs Chlorid-Ionen umgeben, und jedes Chlorid-Ion ist von sechs Natrium-Ionen umgeben.
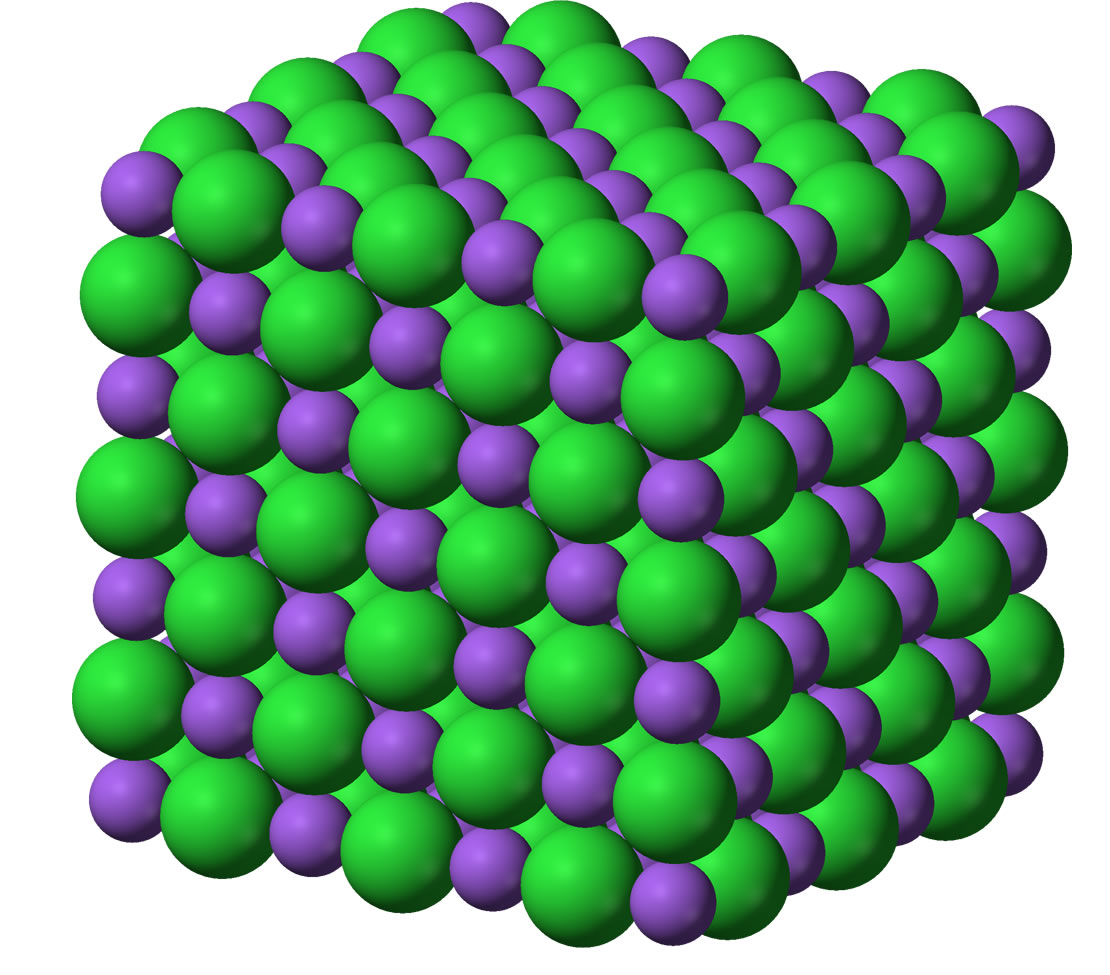
Die Kristallstruktur von Natriumchlorid mit Natrium-Ionen in violett und Chlorid-Ionen in grün. Quelle: englische Wikipedia. Autor: Benjah-bmm27. Lizenz: public domain.
Auf diesem Bild aus der engl. Wikipedia sieht man den regelmäßigen Aufbau des NaCl-Kristalls sehr schön. Natürlich stellt dieses Bild nur einen winzigen Ausschnitt aus dem tatsächlichen Kristall dar. Auf der Seite dawgsdk.org kann man sogar eine echte dreidimensionale Darstellung des NaCl-Kristalls bewundern, die man mit der Maus in alle Richtungen drehen kann. Allerdings setzt diese Seite Flash voraus.
Kristalle sind sehr regelmäßig aufgebaut und sehen auch so aus, wenn man sie mit dem Auge betrachtet. Natriumchlorid-Kristalle kann man sich ganz einfach selbst zu Hause herstellen. Dazu muss man viel NaCl in Wasser lösen, bis eine gesättigte Lösung entsteht. Diese lässt man dann an einem kühlen und vor allem erschütterungsfreien Ort für mehrere Tage stehen. Letzteres ist meistens des Hauptproblem, denn wo ist es wirklich erschütterungsfrei? Jedes vorbeifahrende Auto, schon jeder Gang durch den Raum führt zu Erschütterungen, die das Kristallwachstum negativ beeinflussen.
Salzbildung
Wir wollen jetzt verallgemeinern. Das, was zwischen Natrium und Chlor abgelaufen ist, findet auch bei vielen anderen Reaktionen zwischen Metallen und Nichtmetallen statt. Bereits in der 7. Klasse wurde die Oxidation von Eisen oder Kupfer besprochen.
Eisen-Atome haben zwei Außenelektronen, Sauerstoff-Atome sechs Außenelektronen. An sich ist jetzt klar, was bei der Reaktion zwischen Eisen und Sauerstoff passiert: Die Eisen-Atome geben ihre beiden Außenelektronen ab, es bilden sich zweiwertig positive Eisen-Ionen. Die Sauerstoff-Atome nehmen dagegen zwei Elektronen auf, und es entstehen zweiwertig negative Sauerstoff-Ionen, die allerdings nicht Sauerstoff-Ionen heißen, sondern Oxid-Ionen.
Die positiven Eisen-Ionen und die negativen Oxid-Ionen ziehen sich gegenseitig an, und es bildet sich ein fester Kristall aus Eisenoxid.
Bei der Bildung von Salzen geben die Atome eines Metalls die Außenelektronen ab, dabei entstehen positiv geladene Metall-Ionen. Die Atome des Nichtmetalls dagegen nehmen fehlende Elektronen auf, es bilden sich negativ geladene Nichtmetall-Ionen. Die Triebkraft für beide Vorgänge ist der "Drang" der Atome, einen Edelgaszustand zu erlangen. Die entgegengesetzt geladenen Ionen ziehen sich gegenseitig an und bilden ein festes Kristallgitter. Hier ist jedes Metall-Ion von einer festen Anzahl Nichtmetall-Ionen umgeben, und umgekehrt ist jedes Nichtmetall-Ion von einer bestimmten Anzahl Metall-Ionen umgeben.
Es gibt in der Natur verschiedene Kristallstrukturen, auf die wir hier aber nicht weiter eingehen wollen. Dafür existiert eine eigene Spezialseite auf dieser Homepage.
Die Ionenbindung
"Die ionische Bindung (auch Ionenbindung, heteropolare Bindung oder elektrovalente Bindung) ist eine chemische Bindung, die auf der elektrostatischen Anziehung positiv und negativ geladener Ionen basiert."
Dieses Wikipedia-Zitat aus dem Artikel "Ionische Bindung" fasst kurz und treffen zusammen, was man unter dem Fachbegriff Ionenbindung versteht. Die Bildung von Natriumchlorid aus den Elementen Natrium und Chlor ist das Musterbeispiel für die Bildung von Ionenbindungen. Im engeren Sinne des Begriffs ist mit "Ionenbindung" die elektrische Anziehungskraft gemeint, die zwischen zwei entgegengesetzt geladenenen Ionen herrscht, also beispielsweise zwischen einem positiven Natrium-Ion und einem negativen Chlorid-Ion.
Seitenanfang -
Versuch -
Erste Deutung -
Ionenbindung -
Energieaspekte -
Schmelzpunkte -
Kristallstrukturen