Das Modellsystem, das ich auf der letzten Seite entworfen habe, ist noch recht einfach. Auf dieser Seite möchte ich einen etwas stärker quantitativen Ansatz verfolgen.
Ionenleitfähigkeiten
Hätten alle Ionen die gleiche elektrische Leitfähigkeit, so würde sich während der Titration an der gemessenen Leitfähigkeit nicht viel ändern. Die Hydroxid-Ionen würden einfach durch Chlorid-Ionen ersetzt; die Gesamtzahl der Ionen würde sich aber nicht verändern und damit auch nicht die elektrische Leitfähigkeit.
So einfach ist es aber nicht. Die Hydroxid-Ionen haben eine wesentliche höhere "Äquivalentleitfähigkeit" als die Natrium-Ionen und als die Chlorid-Ionen. Und die Oxonium-Ionen tragen noch mehr zur Leitfähigkeit der Lösung bei. Die folgende Tabelle aus dem alten Lehrbuch der Physikalischen Chemie von Moore und Hummel soll das mal verdeutlichen:
| Kation | ÄLF | Anion | ÄLF |
| H+ | 349,82 | OH- | 198,0 |
| Li+ | 38,69 | Cl- | 76,34 |
| Na+ | 50,11 | Br- | 78,4 |
| K+ | 73,52 | J- | 76,8 |
Wie alt die Tabelle ist, sieht man daran, dass hier das Element Iod noch mit einem "J" gekennzeichnet ist. "ÄLF" ist eine Abkürzung für "Äquivalentleitfähigkeit"; man geht dabei von einer unendlich verdünnten Lösung aus und misst den Wert in Siemens * cm2/mol. Für die Analyse des Versuchs reicht es aber aus, sich nur die Zahlen anzusehen; die physikalischen Einheiten spielen für den Schulversuch keine Rolle.
Gehen wir jetzt unsere vier Modellvorstellungen noch einmal durch und berücksichtigen dabei die Äquivalentleitfähigkeiten der vier relevanten Ionen.
1. Versuchsbeginn
Modellvorstellung: 100 Na+-Ionen und 100 OH--Ionen pro Volumeneinheit. Keine H3O+-Ionen und keine Cl--Ionen.
Leitfähigkeit: 100 * 50,11 + 100 * 198,0 = 24.811.
2. Nach Zugabe von 10 ml HCl
Modellvorstellung: 100 Na+-Ionen, 60 OH--Ionen und 40 Cl--Ionen pro Volumeneinheit. Keine H3O+-Ionen.
Leitfähigkeit: 100 * 50,11 + 60 * 198,0 + 40 * 76,34 = 19.945.
Die Summe der Äquivalentleitfähigkeiten, jeweils multipliziert mit der Anzahl der Ionen (in der Modellvorstellung) ist also nach Zugabe von 10 ml HCl tatsächlich kleiner geworden.
3. Nach Zugabe von 25 ml HCl
Modellvorstellung: 100 Na+-Ionen, 0 OH--Ionen und 100 Cl--Ionen pro Volumeneinheit. Keine H3O+-Ionen.
Leitfähigkeit: 100 * 50,11 + 100 * 76,34 = 12.645.
Das ist ein wirklich niedriger Wert, da nur noch Ionen vorhanden sind, deren Äquivalentleitfähigkeiten nicht so besonders hoch sind.
4. Nach Zugabe von 50 ml HCl
Modellvorstellung: 100 Na+-Ionen, 0 OH--Ionen und 200 Cl--Ionen pro Volumeneinheit. Außerdem 100 H3O+-Ionen.
Leitfähigkeit: 100 * 50,11 + 200 * 76,34 + 100 * 349,82 = 55.261.
Die Leitfähigkeit unseres Modellsystems ist stark angestiegen, das liegt weniger an den zugefügten Chlorid-Ionen als vielmehr an der hohen Äquivalentleitfähigkeit der zugefügten Oxonium-Ionen.
Was wir bisher noch nicht berücksichtigt haben, ist die Volumenzunahme im Becherglas. Am Anfang haben wir 25 ml Natronlauge vorliegen, die mit einer beliebigen Wassermenge verdünnt wurde, die aber nicht berücksichtigt werden muss. Am Äquivalenzpunkt haben wir entsprechend 50 ml NaCl-Lösung + Wasser vorliegen, und nach Zugabe von 50 ml HCl haben wir 75 ml NaCl/HCl-Gemisch + Wasser vorliegen. Das "relevante Volumen" vergrößert sich also von 25 ml auf 75 ml. Wenn wir dies berücksichtigen und die errechnete Leitfähigkeit durch diese Volumina dividieren, erhalten wir folgende Tabelle:
| V(HCl) | LF | V(ges.) | LF* |
| 0 | 24.811 | 25 | 992 |
| 10 | 19.945 | 35 | 570 |
| 25 | 12.645 | 50 | 253 |
| 50 | 55.261 | 75 | 737 |
Legt man diese Daten als Graph über die Darstellung der Versuchsergebnisse, so erhält man:
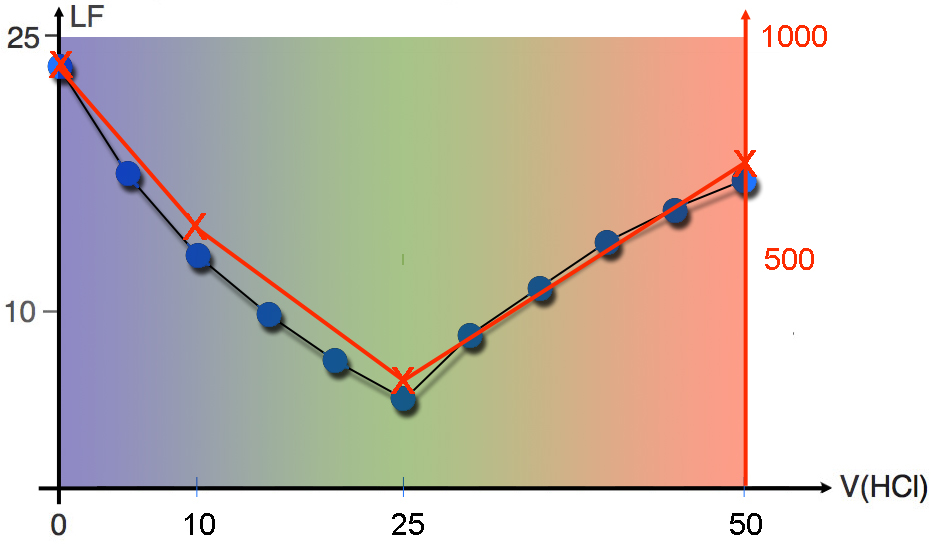
Die Modellvorstellung, die wir hier entwickelt haben, passt also sehr schön zu den Versuchsergebnissen.
Auf der folgenden Seite werden wir mit Hilfe einer Tabellenkalkulation unsere Modellvorstellung noch weiter verfeinern. Und dann müssen wir noch eine sehr wichtige Frage klären. Wieso eigentlich haben Hydroxid-Ionen und vor allem Oxonium-Ionen eine so hohe Äquivalentleitfähigkeit im Vergleich zu anderen Ionen? Das wird übrigens ansatzweise in meinem Lexikon-Artikel zum Grotthuss-Mechanismus erklärt.