Das Daniell-Element wurde 1836 von John Frederic Daniell (1790 - 1845) entwickelt. Es besteht aus einer Kupfer- und einer Zink-Halbzelle. Unter einer Halbzelle versteht man eine Elektrode, die in eine Salzlösung des gleichen Metalls taucht. Ein Kupferstab in einer Kupfersulfat-Lösung ist beispielsweise eine Kupferhalbzelle, ein Zinkstab in einer Zinksulfat-Lösung ist dann eine Zinkhalbzelle.
Ein galvanisches Element besteht immer aus zwei solcher Halbzellen, die leitend miteinander verbunden sind.
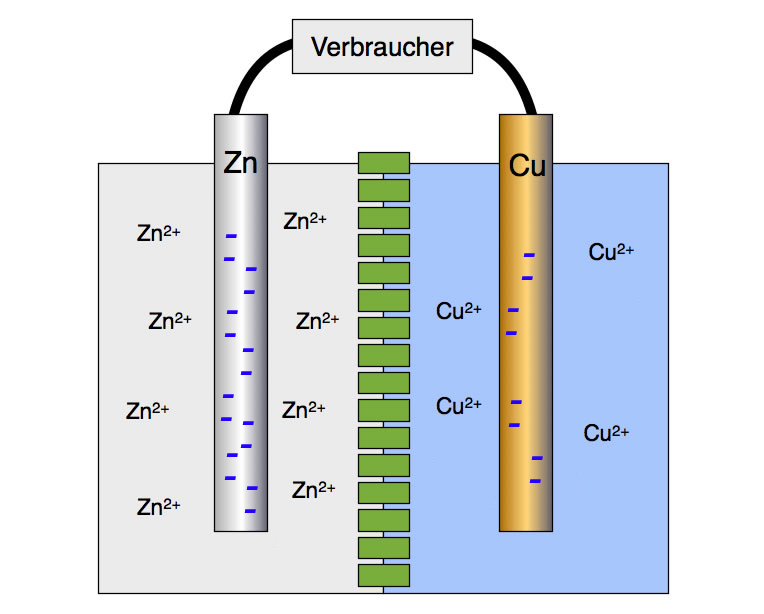
Aufbau eines Daniell-Elements
Autor: Ulrich Helmich 2015, Lizenz: Public domain.
Hier sehen wir eine Zink-Halbzelle (links) und eine Kupfer-Halbzelle (rechts), die durch eine semipermeable Membran (grün) getrennt sind. Die Membran verhindert eine direkte Vermischung der beiden Flüssigkeiten, erlaubt aber die Diffusion von Zink-, Kupfer- und Sulfat-Ionen sowie von Wasser-Molekülen. Der Verbraucher kann eine kleine Glühlampe, ein Elektromotor oder Ähnliches sein. Die Sulfat-Ionen und die Wasser-Moleküle sind hier nicht mit eingezeichnet.
Die chemischen Vorgänge beim Daniell-Element sind uns eigentlich bereits bekannt, sie ähneln den Prozessen bei der "Wasserbatterie".
Auf dieser Seite sind die Vorgänge in der "Wasserbatterie" (Kupfer + Zink in dest. Wasser) ausführlich beschrieben.
In der Zinkhalbzelle läuft folgende Reaktion ab:
$Zn (s) \rightleftharpoons Zn^{2+} (aq)+ 2 \ e^{-}$
Das Gleichgewicht liegt hier auf der linken Seite beim Zn(s), aber nicht sehr weit links. Zink hat ein relativ negatives ("hohes") Redoxpotenzial.
In der Kupferhalbzelle läuft eine analoge Reaktion ab:
$Cu (s) \rightleftharpoons Cu^{2+} (aq)+ 2 \ e^{-}$
Das chemische Gleichgewicht liegt hier noch stärker auf der linken Seite, da Kupfer edler ist als Zink und ein positiveres Redoxpotenzial hat.
Das heißt, der Zinkstab gibt pro Zeiteinheit mehr Ionen an die Zn2+-Lösung ab als der Kupferstab an die Cu2+-Lösung. Der Zinkstab lädt sich dadurch stärker negativ auf als der Kupferstab.
In der Abbildung ist das schön zu sehen. Der linke Zinkstab hat acht Zn2+-Ionen an die Lösung abgegeben, der rechte Kupferstab in der gleichen Zeit nur vier Cu2+-Ionen. In der Zink-Elektrode befinden sich dann 16 Elektronen, während die Kupfer-Elektrode nur acht Elektronen besitzt. Diese Zahlen sind natürlich nur exemplarisch zu sehen, jedes Ion und jedes Elektron steht in Wirklichkeit für Tausende von Ionen bzw. Elektronen, wenn nicht sogar für Millionen.
Schließt man die beiden Halbzellen elektrisch leitend zusammen, zum Beispiel indem man die beiden Elektroden mit einem Draht verbindet, dann kann man einen Elektronenfluss (Strom) von der Zink-Halbzelle zur Kupfer-Halbzelle messen.
Auf dieser Seite habe ich ausführlich erklärt, wieso der Elektronenstrom vom Zink zum Kupfer nicht zum Erliegen kommt. Wenn Sie sich dafür interessieren (es hat was mit dem Prinzip des kleinsten Zwangs zu tun), sollten Sie sich diese Seite durchlesen.
Im Prinzip haben wir mit dem Daniell-Element eine Batterie gebaut, die solange Strom liefert, bis die Zink-Elektrode aufgebraucht ist oder bis in der Kupferhalbzelle der Vorrat an Kupfer-Ionen erschöpft ist.
Die Rolle der Anionen
Nachdem wir die elektrochemischen Prozesse verstanden haben, die an der Zink- und Kupfer-Elektrode ablaufen, wollen wir uns nun mit der Frage beschäftigen, welche Rolle die Anionen bei dem Daniell-Element spielen, also die Sulfat-Ionen.
Die Zinksulfat-Lösung
Auf der Seite mit der Zink-Elektrode nimmt die Konzentration der Zink-Ionen ständig zu, die bei der Reaktion
$Zn (s) \rightleftharpoons Zn^{2+} (aq)+ 2 \ e^{-}$
freigesetzten Elektronen fließen über den elektrischen Leiter in die Kupfer-Elektrode; die positiven Zink-Ionen reichern sich in der Lösung an. Eigentlich müsste diese dadurch immer positiver werden.
Die Kupfersulfat-Lösung
Auf der Seite mit der Kupfer-Elektrode nimmt die Konzentration der Kupfer-Ionen ständig ab, die bei der Reaktion
$Cu^{2+} (aq)+ 2 \ e^{-} \rightleftharpoons Cu(s)$
verbrauchten Kupfer-Ionen setzen sich als dünne Schicht auf der Kupfer-Elektrode ab, und die Konzentration der positiven Kupfer-Ionen in der Kupfersulfat-Lösung wird immer geringer. Die Sulfat-Ionen werden dagegen nicht verbraucht. An sich müsste die Kupfersulfat-Lösung mit der Zeit immer negativer werden.
Der Ionenstrom als Ausgleich
Wenn die Zinksulfat-Lösung mit der Zeit immer positiver, die Kupfersulfat-Lösung immer negativer würden, käme der Elektronenstrom von der Zink- zur Kupfer-Elektrode bald zum Erliegen, da sich eine Art Gegenspannung aufbauen würde.
Dieses Problem vermeidet man, indem man es den Sulfat-Ionen oder allgemein den Anionen erlaubt, ihren Konzentrationsunterschied auszugleichen. Die Sulfat-Ionen, die auf der Kupferseite im Überschuss sind, müssen in die Zinksulfat-Lösung diffundieren können. Dadurch verringert sich die Negativladung der CuSO4-Lösung und gleichzeitig die Positivladung der ZnSO4-Lösung. Eine Gegenspannung kann so nicht entstehen, und die Elektronen können ungebremst von der Zink- zur Kupfer-Elektrode fließen.
Dieses Diffundieren der Anionen muss natürlich durch die Versuchsanordnung gewährleistet werden. Dazu setzt man sogenannte Ionenbrücken ein. Näheres dazu siehe den folgenden Abschnitt.
Umsetzung im Unterricht
Im Chemie-Unterricht der gymnasialen Oberstufe wird das Daniell-Element regelmäßig als Schülerversuch experimentell erforscht. Es gibt mehrere Möglichkeiten, wie man mit Schulmitteln ein Daniell-Element aufbauen kann.
Elektrochemie-Baukasten

Ein Versuch mit einem Elektochemiebaukasten
Photo: Ulrich Helmich 2020, Lizenz: Public domain
Das ist die einfachste Art, wenn ein solcher Baukasten zur Verfügung steht. Man füllt eine Kammer mit einer Kupfersulfat-Lösung, die gegenüberliegende Kammer mit einer Zinksulfat-Lösung, stellt ein Kupferblech in die Kupfersulfat-Lösung und ein Zinkblech in die Zinksulfat-Lösung und verbindet beide Elektroden mit dem eingebauten Voltmeter. Baukästen wie der oben abgebildete haben sogar einen kleinen Elektromotor, den man zum Laufen bringen kann.
Die Anionen der Elektrolyt-Lösungen können durch ein Stück Filtrierpapier als Ionenbrücke von der einen Halbzelle in die andere Halbzelle gelangen.
Zwei Bechergläser
Man nimmt ein Becherglas, füllt es mit der Kupfersulfat-Lösung und stellt eine Kupfer-Elektrode hinein. Das andere Becherglas wird entsprechend mit Zinksulfat-Lösung gefüllt, in der sich eine Zinkplatte befindet. Dann verbindet man beide Elektroden mit einem Voltmeter. Natürlich kann man jetzt noch keine Spannung ablesen, da die Anionen keinen Gegenstrom bilden können; es fehlt noch eine Ionenbrücke.
Dazu nimmt am einfachsten ein Papiertaschentuch, tunkt es in eine Kaliumnitrat-Lösung, so dass das Papier Ionen leiten kann, und legt das Taschentuch dann so über die Ränder der beiden Bechergläser, dass die Flüssigkeiten miteinander verbunden sind.
Manchmal wird auch vorgeschlagen, statt des Papiertaschentuchs ein kleines mit Salzlösung gefülltes U-Rohr als Ionenbrücke zu nehmen, das dann aber sehr geschickt platziert werden muss, was nicht jedem Schüler (m/w/d) gelingt.
U-Rohr mit Diaphragma
In den einen Schenkel kommt die Kupfersulfat-Lösung mit der Kupfer-Elektrode, in den anderen Schenkel die Zinksulfat-Lösung mit der Zink-Elektrode. Beide Elektroden werden mit dem Voltmeter verbunden. Das Diaphragma im U-Rohr ist passierbar für gelöste Ionen, somit ist auch hier der Stromkreis geschlossen.
Zweigeteilte Petrischale
In die eine Hälfte kommt die Kupfersulfat-Lösung mit der Kupfer-Elektrode, in die andere Hälfte die Zinksulfat-Lösung mit der Zink-Elektrode. Beide Elektroden werden mit dem Voltmeter verbunden. Die Ionenbrücke besteht aus einem kurzen Streifen Filtrierpapier, der mit Kaliumnitrat-Lösung getränkt ist.
Poröser Tonzylinder
In den Tonzylinder kommt die Kupfersulfat-Lösung mit der Kupfer-Elektrode, in das Becherglas die Zinksulfat-Lösung mit der Zink-Elektrode. Dann stellt man den Tonzylinder in die Zinksulfat-Lösung. Beide Elektroden werden dann mit dem Voltmeter verbunden. Der Tonzylinder ist porös und dient gleichzeitig als Ionenbrücke.
Historisches
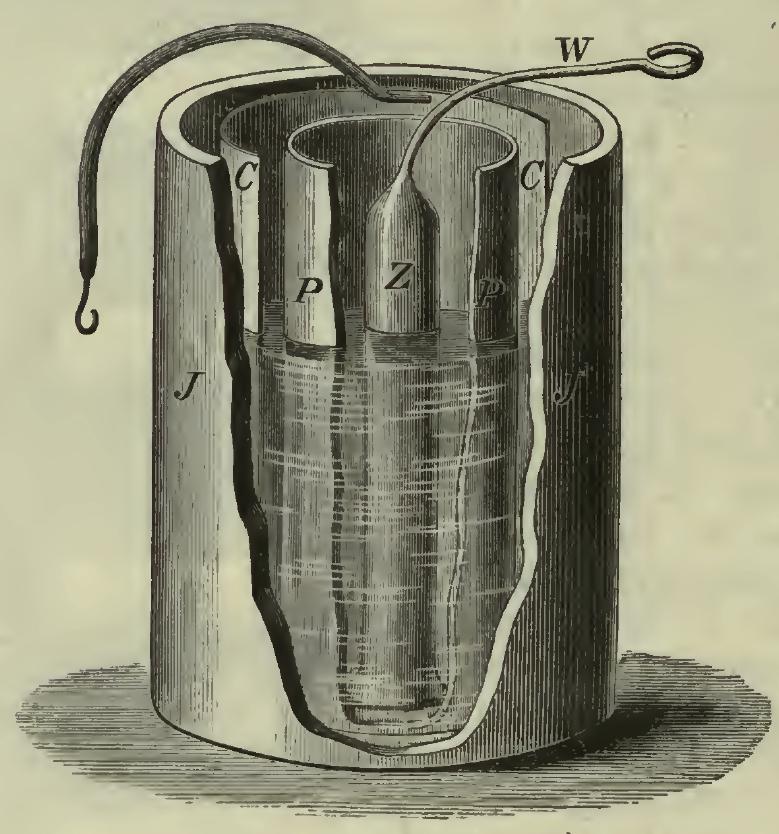
Der zuletzt genannte Aufbau (Poröser Tonzylinder) erinnert an das ursprüngliche, von dem Erfinder John Frederic Daniell selbst gebaute Element. Hier eine Abbildung aus der Wikipedia:
In einem Behälter aus porösem Steingut (P) befindet sich verdünnte Schwefelsäure, in die ein Zinkstab (Z) eintaucht.
Der innere Behälter (P) befindet sich in einem äußeren Behälter (J), der mit Kupfersulfat-Lösung gefüllt ist. Die Kupferelektrode (C) ist ein ringförmig gebogenes Blech, das den inneren Zylinder (P) umschließt.
Mit dieser Konstruktion konnte Daniell eine Spannung von 1,1 Volt mit einem maximalen Entladestrom von 100 mA erzeugen.
In der Wikipedia finden Sie weitere, auch historisch interessante Informationen zum Daniell-Element.
Seitenanfang -
Zwei Versuche -
Wasserbatterie -
Zitronenbatterie -
DANIELL-Element -
Galvanische Zellen