Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- den Begriff "Absorption" am Beispiel des Wasserstoff-Atoms erklären können,
- wissen, dass sich die Elektronen von Molekülen in Molekülorbitalen aufhalten,
- den Unterschied zwischen einem bindenden und einem anti-bindenden Molekülorbital kennen,
- am Beispiel des Ethen-Moleküls erläutern können, wie die Absorption von Licht bei organischen Verbindungen funktioniert.
Was geschieht bei der Absorption?
Zunächst wollen wir diesen wichtigen Begriff an einem ganz einfachen Beispiel klären, am denkbar einfachsten Beispiel überhaupt, nämlich dem Wasserstoff-Atom. In einem zweiten Schritt werden wir dann erfahren, wie größere Moleküle Licht absorbieren.
Absorption beim H-Atom
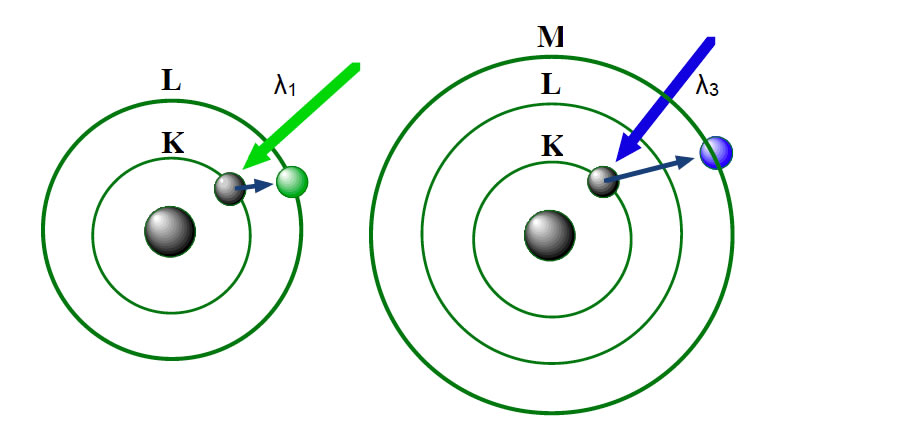
Absorption von grünem und blauem Licht durch ein H-Atom
In dem Bild sehen wir links ein Wasserstoff-Atom mit dem Elektron auf der K-Schale. Durch Einstrahlung von grünem Licht wird dieses Elektron so stark angeregt, dass es auf die nächste Schale springt, die L-Schale. Hier handelt es sich um einen sogenannten Quantensprung.
Rotes Licht hätte für diesen Quantensprung nicht ausgereicht, da es energieärmer ist als grünes Licht.
Blaues Licht dagegen ist so energiereich, dass das Elektron sogar auf die M-Schale "befördert" werden kann.
Absorption bei Molekülen
Moleküle haben im Gegensatz zu Atomen viele verschiedene Elektronen. Das Schalenmodell kann die Verhältnisse in Molekülen nicht mehr so gut erklären, auch das Kugelwolkenmodell ist hier nicht optimal, so dass man schon zum Orbitalmodell des Atoms greifen muss. Trotzdem versuche ich hier mal, die Absorption bei Molekülen so einfach wie möglich zu erklären - ganz ohne Orbitalmodell geht das allerdings nicht. Zumindest der Unterschied zwischen einem sp3- und einem sp2-hybridisierten Kohlenstoff-Atom sollte Ihnen klar sein, auch sollten Sie wissen, was ein p-Orbital ist. Für den Chemie-Grundkurs sollte das dann reichen.
Bei der organischen Farbstoffchemie spielen eigentlich nur die sogenannten pi-Elektronen eine entscheidende Rolle, also die Elektronen, die sich in den p-Orbitalen sp2-hybridisierter Kohlenstoff-Atome aufhalten. Zwei benachbarte sp2-hybridisierte Kohlenstoff-Atome können nun eine C=C-Doppelbindung bilden, bei der sich die beiden p-Orbitale der C-Atome schwach überlappen.
Schauen wir uns einmal das einfachste Molekül mit einer C=C-Doppelbindung an, das Ethen-Molekül. Für jedes p-Orbital in dem Molekül gibt es nun ein sogenanntes pi-Molekülorbital (kurz MO). Da das Ethen-Molekül zwei dieser p-Orbitale besitzt, gibt es auch zwei dieser pi-Molekülorbitale. Jedes pi-Molekülorbital kann nun zwei Elektronen aufnehmen (das kennen wir ja bereits vom Kugelwolkenmodell, jede Kugelwolke kann ja auch nur zwei Elektronen aufnehmen).
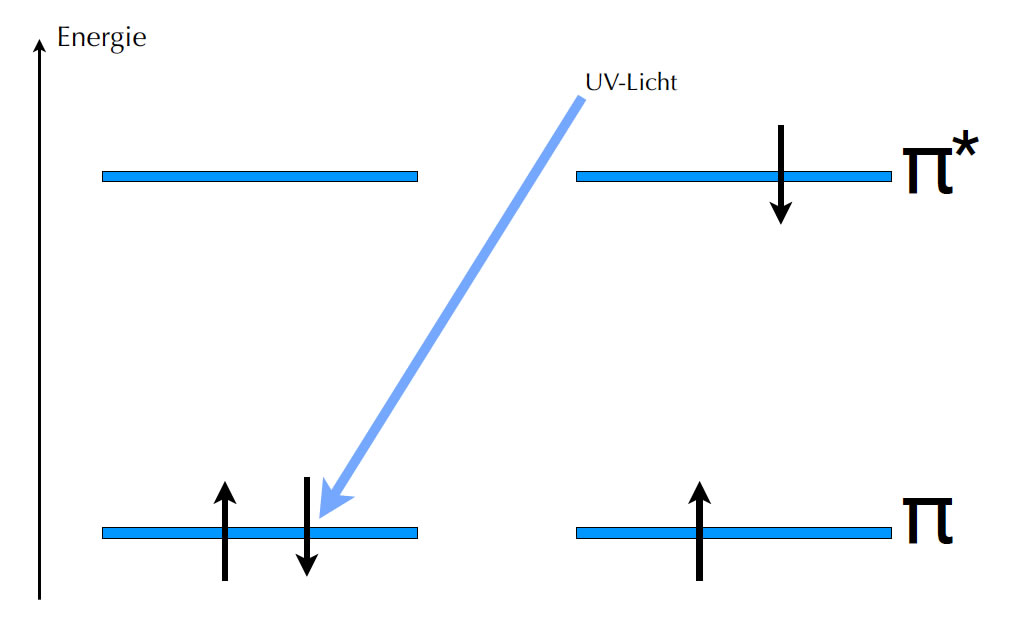
Die Molekülorbitale des Ethens und die Wirkung von UV-Licht
Links in dem Bild sieht man die Energieniveaus dieser beiden Molekülorbitale. Eines dieser Molekülorbitale hat eine sehr niedrige Energie, das andere eine hohe. Die beiden Elektronen der p-Orbitale halten sich natürlich in dem Molekülorbital auf, das energetisch am günstigsten ist, also in dem unteren Molekülorbital. Dieses Molekülorbital wird daher auch als bindendes Molekülorbital bezeichnet. Das darüberliegende energetisch ungünstige Molekülorbital ist dagegen ein anti-bindendes Molekülorbital. Normalerweise ist dieses Molekülorbital nicht von Elektronen besetzt.
Denken wir noch einmal kurz an das Wasserstoff-Atom zurück. Das einzige Elektron des H-Atoms sitzt auf der K-Schale, weil die energetisch am günstigsten ist. Durch Zufuhr von Lichtenergie kann man dieses Elektron jedoch so anregen, dass es auf die energetisch höherwertige L-Schale springt.
Auch bei Molekülorbitalen ist das möglich. Durch Absorption von UV-Licht wird eines der beiden pi-Elektronen des bindenden Molekülorbitals auf das anti-bindende Molekülorbital befördert.
So also ungefähr funktioniert die Absorption von Licht bei organischen Molekülen. Genaueres dazu erfahren Sie in dem nächsten Abschnitt, in dem es um die Farbigkeit organischer Verbindungen geht. Bevor Sie sich diesen Abschnitt zu Gemüte führen, sollten Sie sich allerdings in das Orbitalmodell des Kohlenstoff-Atoms einlesen; das wäre doch schon sehr hilfreich.
Seitenanfang -
Weiter mit "Die Farbigkeit organischer Verbindungen"…