Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- Die vier Molekülorbitale des Butadien-Moleküls beschreiben können,
- angeben können, was bei der Absorption von UV-Licht mit den pi-Elektronen des Butadiens passiert,
- den Unterschied zwischen HOMO und LUMO erklären können.
Struktur
Das Butadien-Molekül ist ein Butan-Molekül mit zwei C=C-Doppelbindungen, zwischen denen sich eine C-C-Einfachbindung befindet: H2C=CH-HC=CH2.
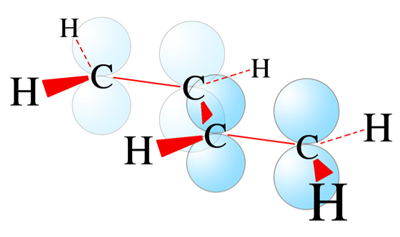
Das Butadien-Molekül nach dem Orbital-Modell
Alle vier C-Atome sind sp2-hybridisiert und die vier pz-Orbitale überlappen sich, daher ist das Butadien-Molekül planar, alle zehn Atome liegen in einer Ebene.
Die π-Elektronen der pz-Orbitale sind über die vier C-Atome delokalisiert . Es bildet sich ein einheitlicher Aufenthaltsraum für die vier π-Elektronen, und jedes Elektron kann sich oberhalb und unterhalb der Molekülebene aufhalten.
Molekül-Orbitale des Butadiens
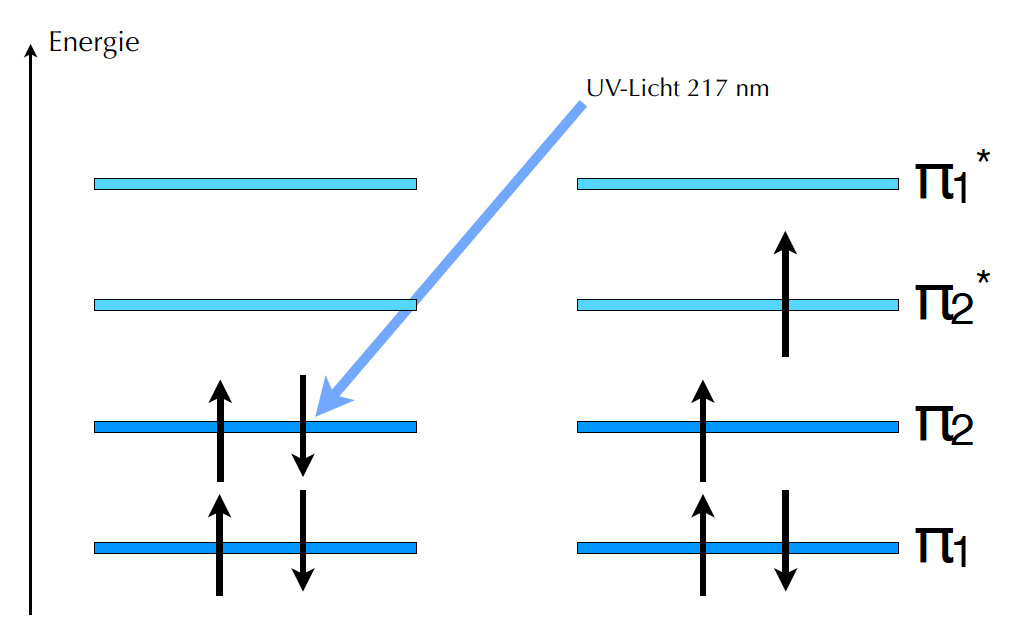
Molekülorbitale des Butadien, Anregung durch UV-Licht der Wellenlänge 217 nm.
Die vier pz-Orbitale des Butadiens können nach der MO-Theorie zu vier Molekülorbitalen kombiniert werden, zwei bindenden π- und zwei anti-bindenden π*-Orbitalen. Normalerweise sind nur die beiden energetisch günstigsten MOs mit den vier π-Elektronen besetzt, also die beiden bindenden Molekülorbitale.
Eine leicht verständliche Darstellung der MO-Theorie findet sich übrigens auf den Seiten der Chemgapedia; der Besuch dieser Seiten lohnt sich auf jeden Fall!
Eine genauere Darstellung der vier Molekülorbitale des Butadiens finden Sie im Lexikon-Eintrag "Butadien, Molekülorbitale".
Absorption von UV-Licht
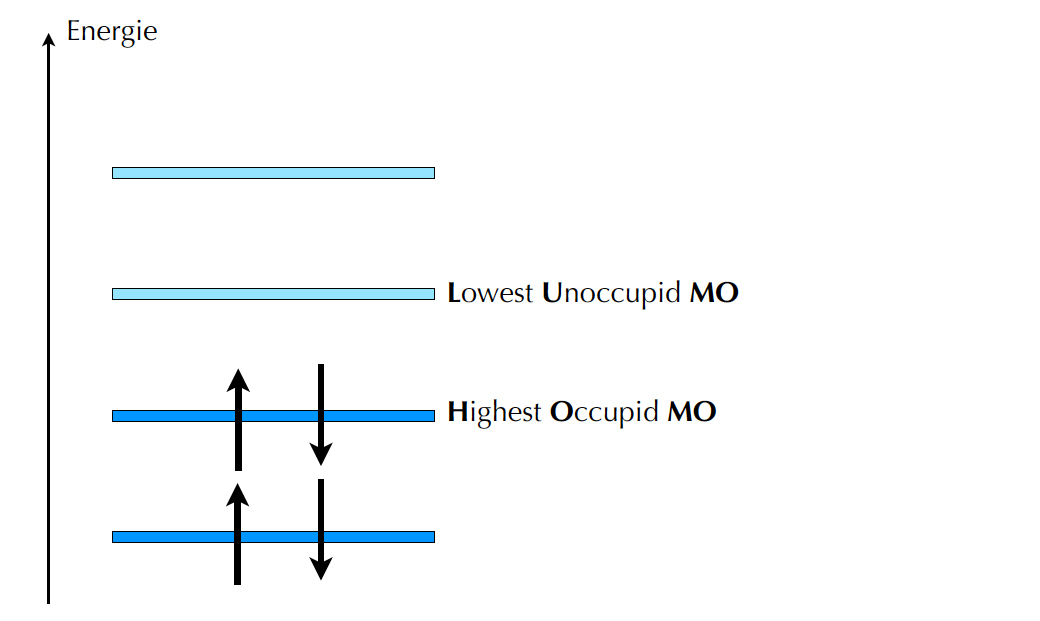
HOMOs und LUMOs beim Butadien
Beim Butadien haben wir insgesamt vier π-MOs. Die beiden untersten sind im Grundzustand mit insgesamt vier Elektronen besetzt. Für zwei dieser vier MOs haben sich jetzt bestimmte Fachbegriffe eingebürgert, weil sie eine wichtige Rolle in der Farbstoffchemie spielen.
Das höchste noch mit Elektronen besetzte MO wird als HOMO bezeichnet. Hiermit ist keine geschlechtliche Orientierung gemeint, sondern der Begriff kommt aus dem Englischen und ist die Abkürzung für "highest occupied Molecular Orbital".
Das niedrigste noch nicht mit Elektronen besetzte MO heißt daher auch nicht HETERO, sondern LUMO, vom englischen "lowest unoccupied Molecular Orbital".
Warum sind diese beiden Molekülorbitale nun von so besonderer Bedeutung für die Farbstoffchemie?
Ganz einfach: Die Elektronen des HOMOs können durch Licht ganz leicht angeregt werden, und in der Regel springen die angeregten Elektronen in das LUMO. Wichtig: Der Spin (also die Drehrichtung) des Elektrons ändert sich dabei nicht.
Beim Butadien ist für diesen "Quantensprung" UV-Licht der Wellenlänge 217 nm erforderlich[1]. Mit anderen Worten: Butadien absorbiert nicht-sichtbares Licht, und da die Komplementärfarbe von "nicht sichtbar" ebenfalls "nicht sichtbar" ist, hat das Butadien keine Farbe.
Seitenanfang -
Weiter mit dem Hexatrien-Molekül und längerkettigen Polyenen…