Polystyrol ist ein beliebter und preiswerter Thermoplast, der bereits seit 1930 produziert wird, also über 20 Jahre vor Polypropylen oder Polyethylen. Polystyrol hat einen globalen Marktanteil von ca. 8%.
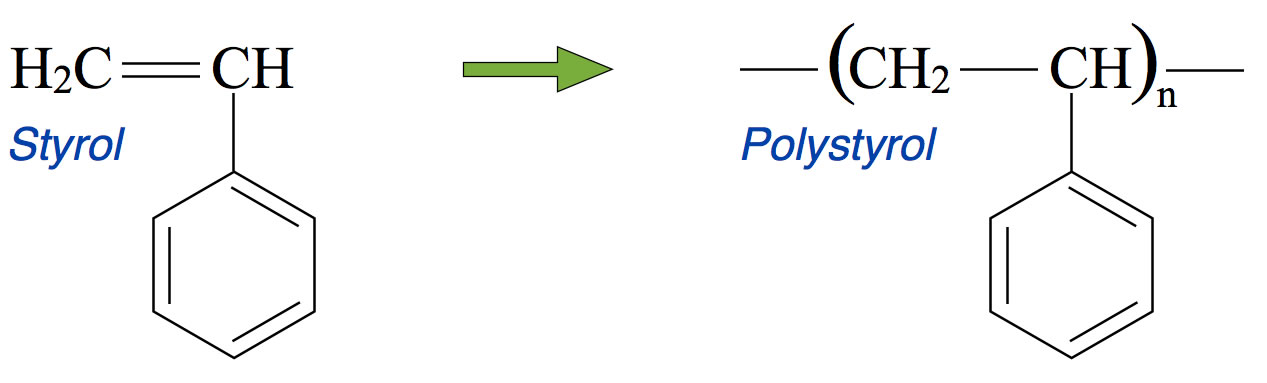
Bildung von Polystyrol aus dem Monomer Styrol
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Übrigens wurde Polystyrol schon 1839 zufällig "entdeckt", als der Berliner Apotheker Eduard Simon eine Flasche Styrol zu lange offen stehen ließ. Allerdings hielt er die gallertige Flüssigkeit, die sich in der Flasche gebildet hatte, für ein Oxid des Styrols. Dass es sich um ein Polymer handelte, konnte Simon nicht ahnen.
Eigenschaften
Polystyrol ist deutlich steifer und härter als Polypropylen oder Polyethylen, ist allerdings nicht so beständig gegen Chemikalien, vor allem organische Lösemittel können Polystyrol angreifen. Mit Klebstoffen wie Uhu oder Pattex kann man regelrechte "Löcher" in einer Styroporplatte hineinbrennen. Auch ist Polystyrol wenig hitzebeständig (maximal 55 bis 60 ºC), und es brennt recht gut.
Verwendung
Das wichtigste Anwendungsgebiet von Polystyrol ist die Verpackungsindustrie. Viele Joghurbecher bestehen zum Beispiel aus Polystyrol, und in aufgeschäumter Form wird Polystyrol als Styropor eingesetzt. Aber auch in der Elektrotechnik und bei der Herstellung von Spielzeug und Haushaltsgegenständen wird Polystyrol eingesetzt.
Herstellung
Polystyrol entsteht durch Polymerisation von Styrol, die schon bei Raumtemperatur erfolgt. Das Styrol stellt man aus Benzol und Ethen her. Zunächst entsteht Ethylbenzol, durch katalytische Dehydrierung erhält man dann Styrol.
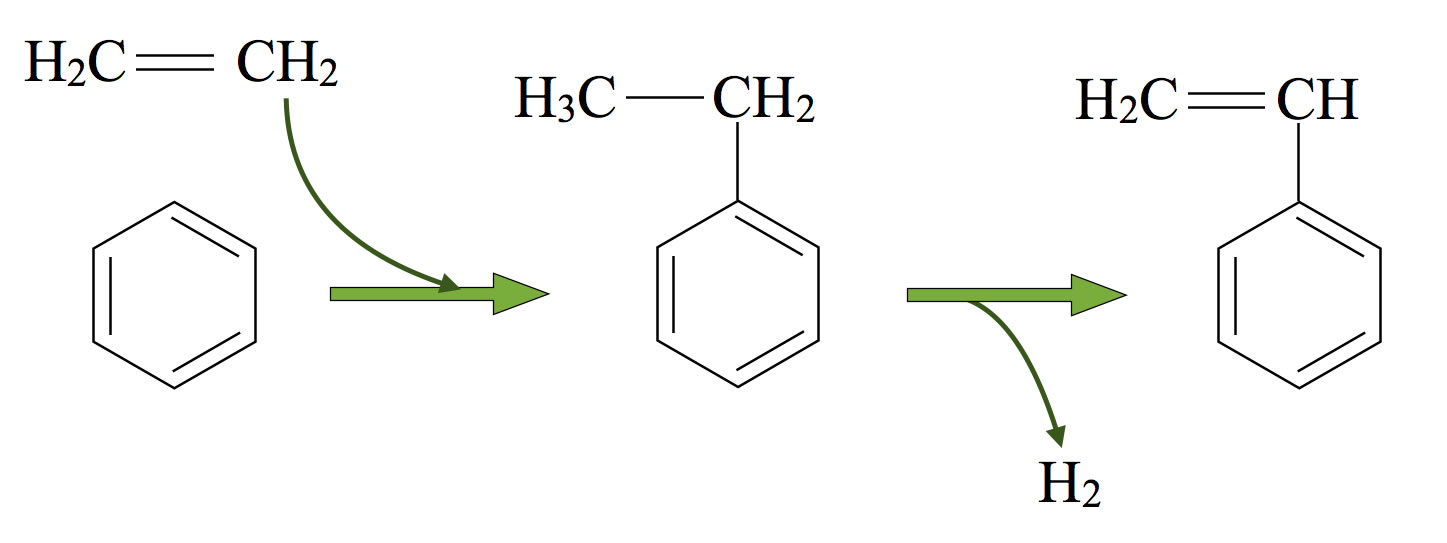
Sythese von Styrol aus Benzol und Ethen
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Die Polymerisation erfolgt nach dem radikalischen Verfahren, es wird ein Starter wie Dibenzoylperoxid eingesetzt.
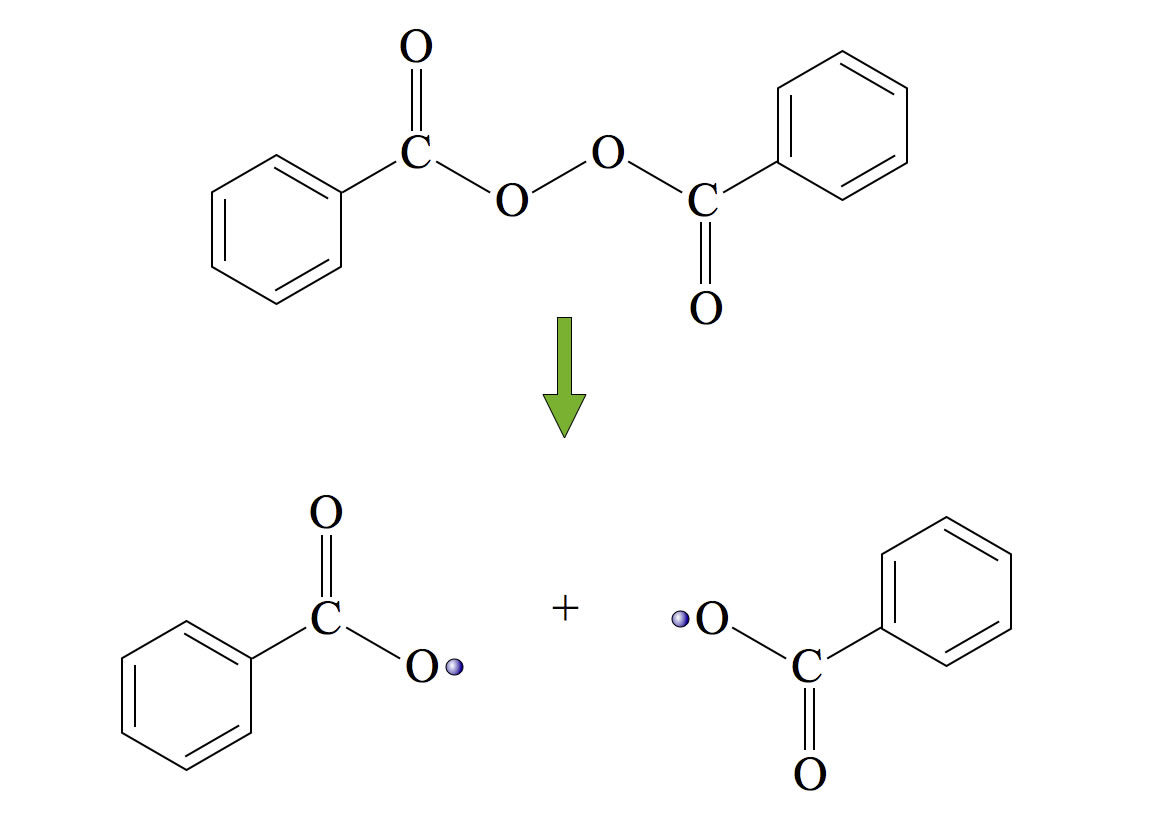
Zerfall von Dibenzoylperoxid in zwei Radikale
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Hier sieht man den Zerfall von Dibenzoylperoxid in zwei Radikale. Zum weiteren Verlauf der radikalischen Polymerisation (am Beispiel von Polyethylen) siehe "Polymerisation". Die Zersetzung des Startes erfolgt schon bei ca. 100 ºC. Man kann die Polymerisation von Styrol sogar als Schulversuch durchführen. Dazu gibt man zu ca. 20 ml Styrol etwa 0,2 bis 0,5 g (oder eine Spatelspitze) Dibenzoylperoxid und erhitzt das Gemisch im Wasserbad auf ca. 100 ºC oder im Ölbad auf 140 ºC. Nach einiger Zeit wird das Styrol zähflüssig, jetzt kann man mit einem Glasstab Fäden aus Polystyrol ziehen. Lässt man das Gemisch im Reagenzglas abkühlen und längere Zeit stehen, wird es hart.
Entsorgungsproblem
Styropor ist leicht brennbar und enthält deshalb Flammschutzmittel. Bisher wurde dazu die organische Verbindung Hexabromcyclododecan eingesetzt, die seit 2016 aber als extrem giftig eingestuft wurde. Die Entsorgung von Styropor ist seit dem sehr teuer geworden, für die Entsorgung von 1 Tonne Styropor muss inzwischen teilweise über 9.000 Euro bezahlt werden - und das alles wegen dem Brom in dem Hexabromcyclododecan.
Neues Verfahren zum Polystyrol-Recycling erfunden
Wissenschaftler haben im Jahre 2022 herausgefunden, wie man Polystyrol mit wenig Aufwand komplett recyclen kann. Dazu wird nur "Licht, Luft und einfaches Eisen(III)-chlorid" benötigt [2].
Versuch:
Auflösen von Styropor in Aceton

Grünes Verpackungsmaterial (Styropor) wird in Aceton gelöst
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Im rechten Becherglas sehen wir den Rückstand, eine feste grüne Masse (es wurde grün gefärbtes Styropor in Aceton aufgelöst). Im linken Becherglas befindet sich das in Aceton gelöste Styropor.
Bei diesem neuen Recycling-Verfahren löst man Polystyrol, den Hauptbestandteil von Styropor, in Aceton auf und gibt gleichzeitig Eisen(III)-chlorid dazu. Das Stoffgemisch wird dann 20 Stunden in Anwesenheit von Sauerstoff mit weißem Licht bestrahlt.
Unter diesen Bedingungen zerfällt das Polystyrol in seine Monomere und Derivate derselben (Benzoylverbindungen).
Man vermutet, dass das Licht das FeCl3 homolytisch spaltet, wobei Chlor-Radikale entstehen.
"Letztere entreißen den Molekülketten des Polystyrols die Wasserstoffatome an den Stellen, wo die Bausteine des Polymers miteinander verknüpft sind. Dadurch wiederum greift Sauerstoff dort an und zerlegt das Kettenmolekül in ebenjene Grundbausteine." [2].
Diese Grundbausteine (vor allem Benzoesäure) sind wichtige Ausgangsstoffe für die chemische Industrie und daher sehr begehrt, was das Verfahren auch unter ökonomischen Aspekten interessant macht.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- "Rohstoffe aus Kunststoffabfall" in Spektrum der Wissenschaft 06/2022.