Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- wie man die tetraedrische Struktur des Methan-Moleküls beweisen kann.
- wie man von der dreidimensionalen tetraedrischen Methan-Struktur zu der planaren Projektionsformel des Methans kommt.
Unter einem Strukturbeweis versteht man experimentellen Maßnahmen, die zur Ermittlung oder Bestätigung der exakten Strukturformel oder Konstitution erforderlich sind. Bevor man die Strukturformel einer organischen Verbindung ermittelt, muss man zunächst die Verhältnisformel in Erfahrung bringen. Dazu dient die sogenannte quantitative Analyse. Das Ergebnis dieser quantiativen Analyse ist, dass Methan die Verhältnisformel C : H = 1 : 4 hat. Ermittelt man dann die molare Masse von Methan mit 16 g/mol, kommt nur die Summenformel CH4 in Frage, andere Summenformeln mit dem Atomzahlverhältnis C : H = 1 : 4 wie beispielsweise C2H8 scheiden dann aus. C2H8 hätte eine molare Masse von 32 g/mol.
Abgesehen davon wäre es nicht möglich, ein Molekülmodell mit zwei C-Atomen und acht H-Atomen zu bauen. Das wäre dann ein weiterer Grund, wieso C2H8 als Summenformel für Methan ausscheidet.
Methan hat eine tetraederförmige Struktur
Der "klassische" Beweis für die Tetraederstruktur des Methans erfolgt oft mit Hilfe eines zweifach substituierten Methan-Moleküls, beispielsweise mit dem Chlor-Iod-Methan.
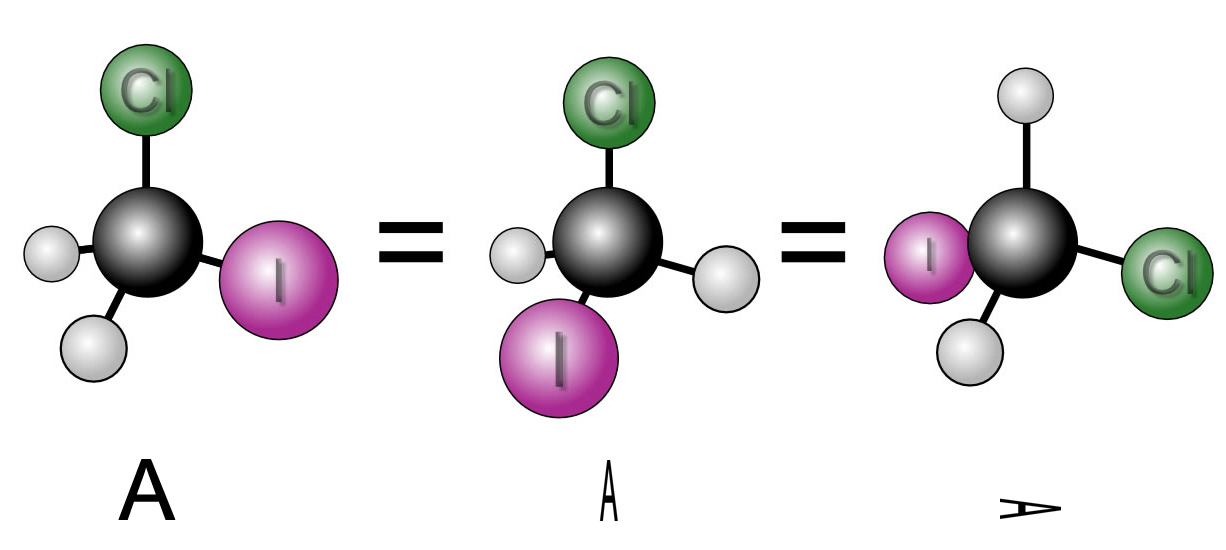
Drei verschiedene Ansichten für das gleiche Molekül
Autor: Ulrich Helmich
2017, Lizenz: siehe Seitenende.
In der Abbildung 1 sieht man drei verschiedene Ansichten des Chlor-Iod-Methans, die aber alle das gleiche Molekül darstellen. Davon kann man sich mit Hilfe von Molekülmodellen leicht überzeugen. Die Buchstaben deuten an, wie das Molekülmodell jeweils gedreht wurde.
Was wäre aber, wenn das Methan-Molekül nicht tetraedrisch aufgebaut wäre, sondern planar, wenn also alle fünf Atome innerhalb einer Ebene liegen würden?
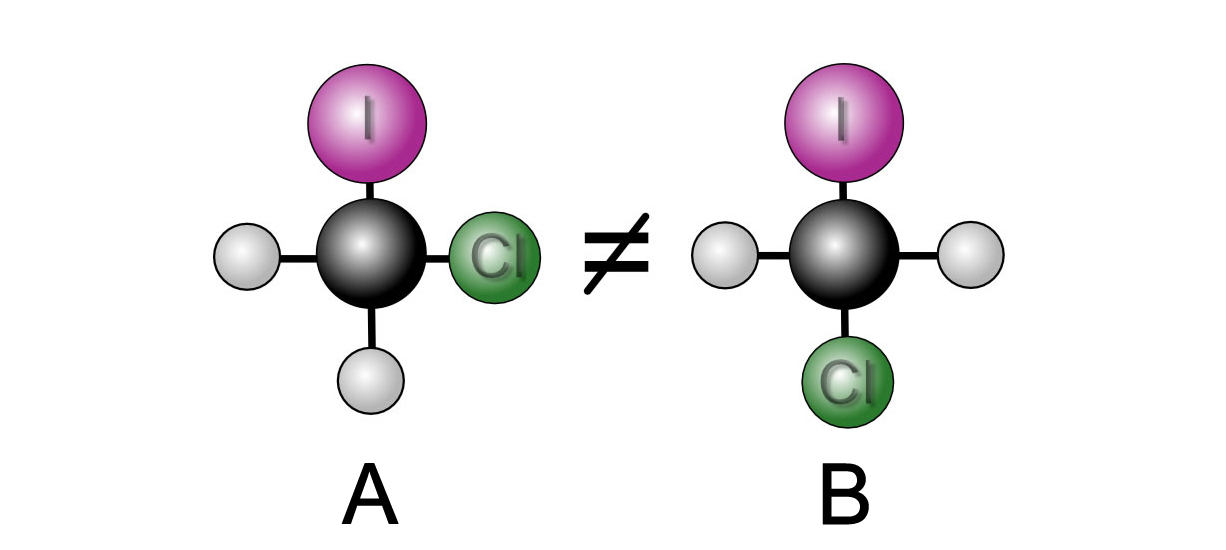
Zwei verschiedene Moleküle
Autor: Ulrich Helmich
2017, Lizenz: siehe Seitenende.
Wäre die Methan-Struktur planar, dann könnte man tatsächlich zwei verschiedene Chlor-Iod-Methan-Moleküle bauen, die zwei unterschiedliche Konstitutionen hätten:
A) Ein C-Atom ist mit einem I-, einem Cl- und zwei H-Atomen verbunden, alle Atome liegen in einer Ebene. Das I- und das Cl-Atom sind direkt benachbart bzw. bilden einen Bindungswinkel von 90 Grad.
B) Ein C-Atom ist mit einem I-, einem Cl- und zwei H-Atomen verbunden, alle Atome liegen in einer Ebene. Das I- und das Cl-Atom liegen gegenüber bzw. bilden einen Bindungswinkel von 180 Grad.
Für Experten:
Auch die physikalischen Eigenschaften der beiden Formen müssten sich unterscheiden. In der Struktur A müssten sich die beiden Dipolmomente addieren, das Molekül müsste also ein starker Dipol sein, was hohe Schmelz- und Siedetemperaturen zur Folge hat, während beim Molekül B sich die beiden Dipolmomente gegenseitig fast aufheben würden, die Folge wären geringere Schmelz- und Siedetemperaturen.
Die Tatsache, dass man bisher immer nur ein einziges Chlor-Iod-Methan gefunden hat, spricht eindeutig gegen das planare Modell. Die einzige vernünftige Alternative ist die tetraedrische Struktur.
Für Experten:
Die Tetraederstruktur wird durch das Kugelwolkenmodell erkärt. Die vier einfach besetzten Kugelwolken des C-Atoms sind tetraedrisch angeordnet. Das liegt daran, dass jede Kugelwolke negativ geladen ist und sich negative Ladungen gegenseitig abstoßen. Der Tetraeder ist nun diejenige geometrische Anordnung, in der die vier negativen Ladungen maximal weit voneinander entfernt sind. Jede dieser vier einfach besetzten Kugelwolken geht nun eine Bindung mit einem H-Atom ein, und das ist der Grund, warum auch das Methan-Molekül tetraederförmig aufgebaut ist.
Die Projektionsformel

Eine Schattenprojektion eines Methan-Modells
Autor: Ulrich Helmich
2018, Lizenz: siehe Seitenende.
Baut man sich mit dem Molekülbaukasten ein Methan-Molekül und hält das Modell dann gegen eine beleuchtete Wand, so erhält man eine Schattenprojektion. Aus dieser Schattenprojektion kann man dann leicht die übliche Strukturformel des Methans ableiten:
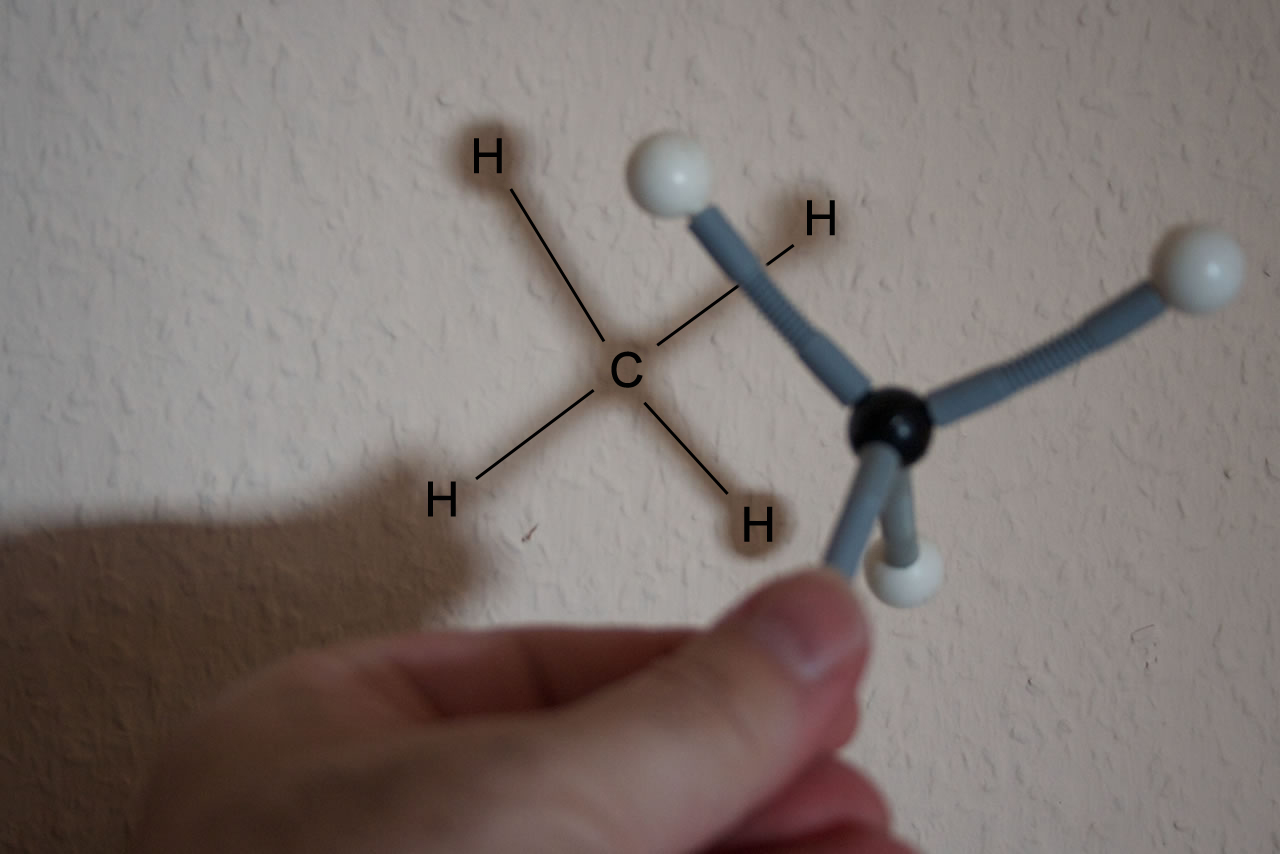
Die Herleitung der üblichen Strukturformel
Autor: Ulrich Helmich
2018, Lizenz: siehe Seitenende.