Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- wissen, wie das Methan-Molekül nach dem Kugelwolkenmodell aufgebaut ist,
- wissen, was Methan überhaupt ist und welche Eigenschaften es hat,
- die beiden wichtigsten Reaktionen des Methans kennen.
Struktur EF
Konstitution
Das einfachste Alkan ist das Methan CH4, seine Konstitution kann beschrieben werden als "ein C-Atom, das mit vier H-Atomen verbunden ist". Die vier H-Atome sind tetraedrisch um das C-Atom herum angeordnet, wie man auf dem folgenden Bild gut sehen kann:
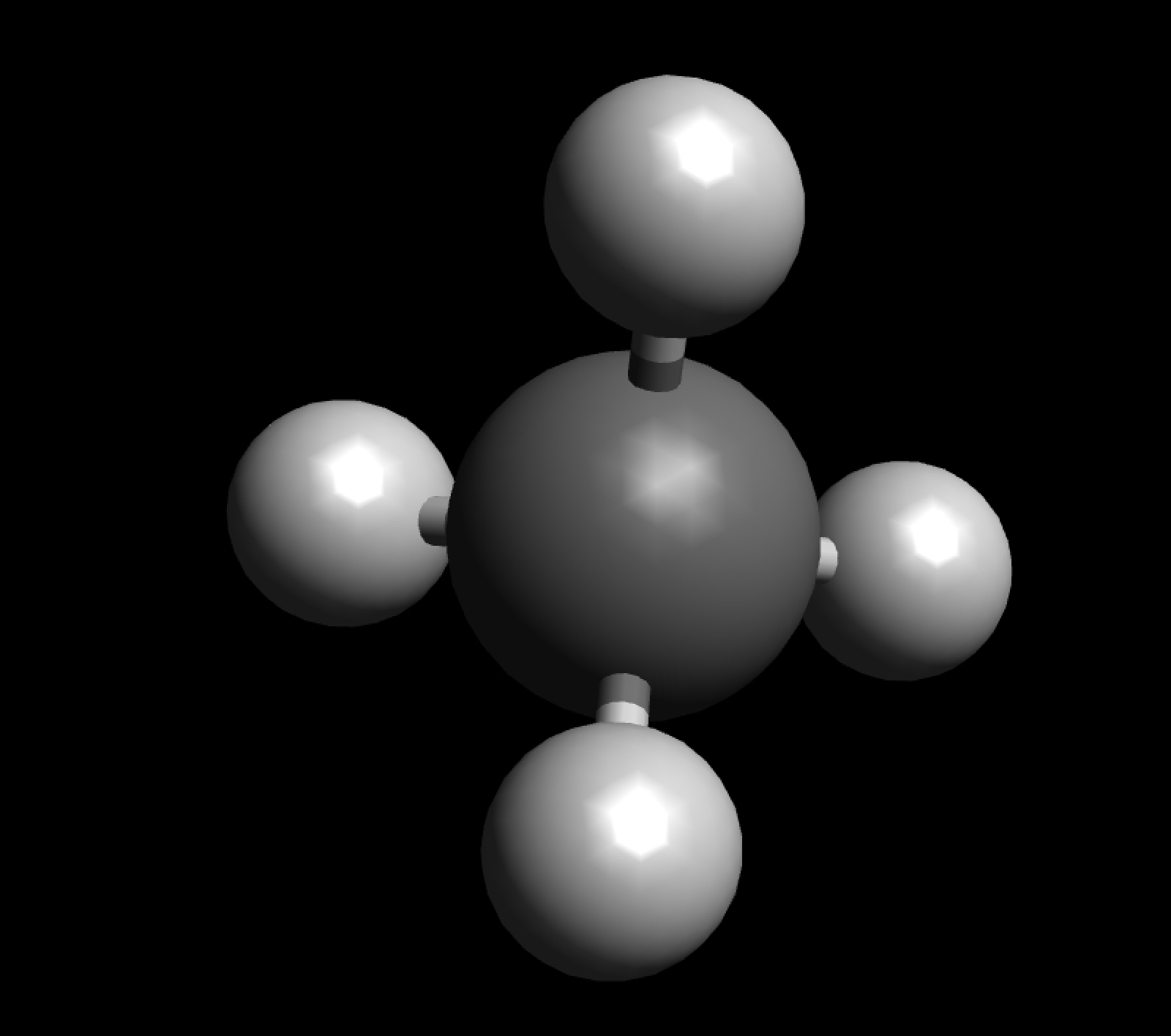
Das Methan-Molekül
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Für LK-Schüler(innen) und Studierende:
➥StrukturbeweisAuf dieser Seite wird ausführlich dargelegt, wie man die tetraederförmige Struktur von Methan bzw. Methanderivaten beweisen kann.
Das Methan-Molekül im Kugelwolkenmodell
Das Kohlenstoff-Atom
Nach dem Kugelwolkenmodell besitzt das Kohlenstoff-Atom vier kugelförmige Aufenthaltsräume für Elektronen, jede dieser Kugelwolken ist beim C-Atom mit einem Elektron besetzt.
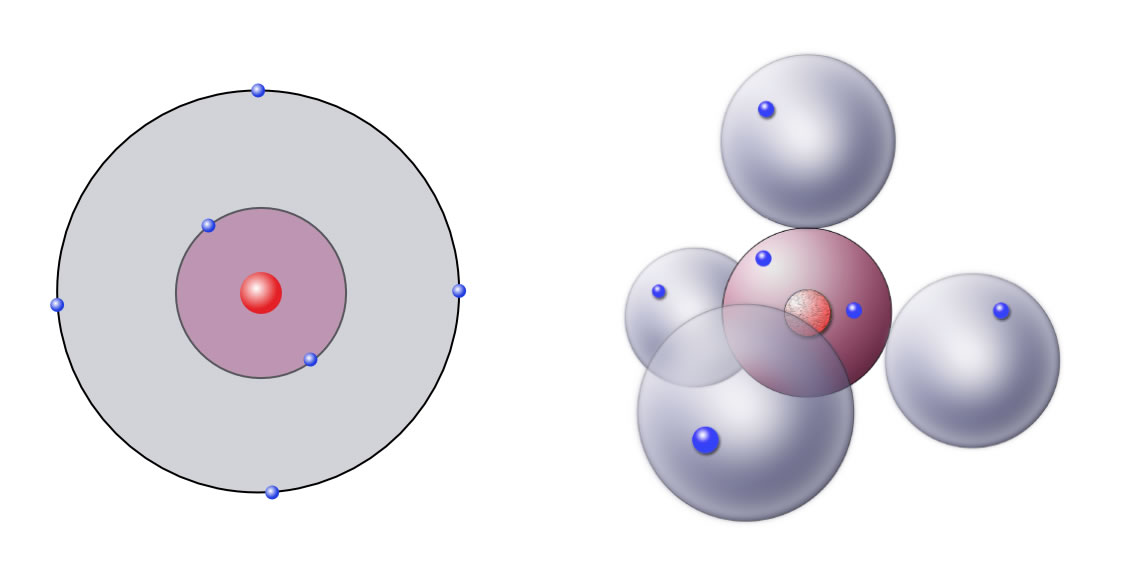
Das C-Atom im Schalenmodell (links) und im Kugelwolkenmodell (rechts)
Autor: Ulrich Helmich 2018, Lizenz: CC BY-NC-SA 4.0
Hier sehen wir das Kohlenstoff-Atom im Schalenmodell und im Kugelwolkenmodell.
Für Schüler(innen), die das Kugelwolkenmodell noch nicht kennen:
➥KugelwolkenmodellAuf dieser Seite für die Stufen 10 und EF wird das Kugelwolkenmodell ausführlich erläutert.
Der Grund für die tetraederförmige Anordnung der vier Aufenthaltsräume ist die gegenseitige Abstoßung der negativ geladenen Wolken. Die vier Kugelwolken stoßen sich gegenseitig ab (Elektronen sind negativ geladen, und gleiche Ladungen stoßen sich ab - das ist grundlegende Physik). Durch diese Abstoßung stellt sich eine Raumstruktur ein, bei der jede Kugelwolke möglichst weit von den anderen drei Kugelwolken entfernt ist - die Tetraederstruktur.
Das Methan-Molekül
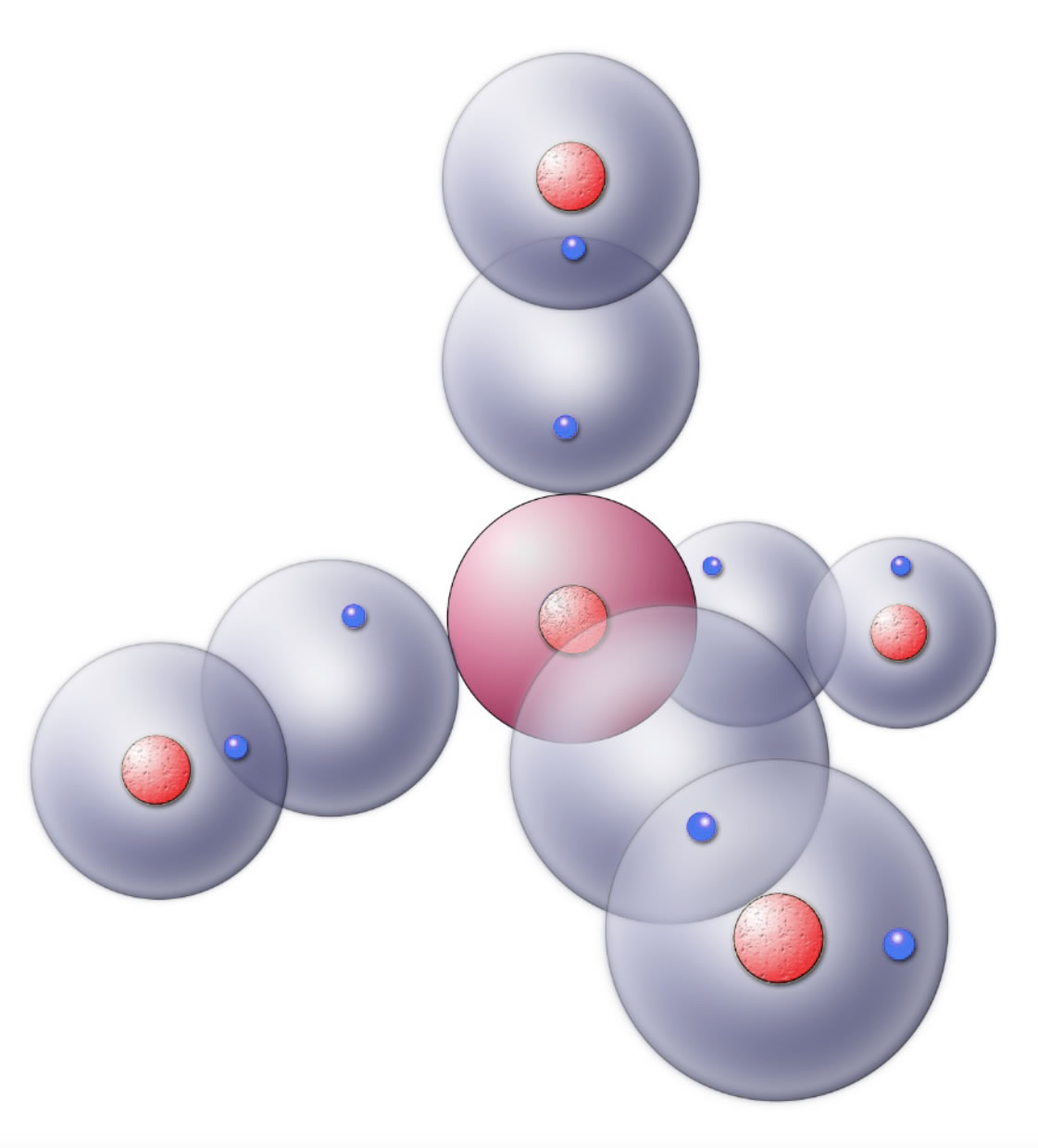
Das Methan-Molekül nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2018, Lizenz: siehe Seitenende
Eine Kugelwolke, die nur ein Elektron enthält, ist energetisch sehr ungünstig. Energetisch günstiger wäre es, wenn jede Kugelwolke mit zwei Elektronen besetzt wäre. Bei vier Kugelwolken hätten wir dann acht Elektronen, nach der Oktettregel ist das der energetisch günstigste Zustand eines Atoms.
Ein Wasserstoff-Atom hat nur eine Kugelwolke, die mit einem Elektron besetzt ist. Auch das ist ein energetisch ungünstiger Zustand.
Wenn nun jede der vier Kohlenstoff-Kugelwolken mit einer Wasserstoff-Kugelwolke überlappt, erhalten wir das Methan-Molekül. Das Kohlenstoff-Atom besitzt jetzt acht Außenelektronen, und jedes Wasserstoff-Atom hat zwei Außenelektronen. Alle fünf Atome befinden sich damit im energetisch günstigsten Zustand.
Für Q1/Q2-Schüler(innen) und Studierende:
➥Methan-StrukturAuf dieser Lexikonseite wird noch einmal detailliert auf die Struktur des Methan-Moleküls eingegangen. Es wird anschaulich gezeigt, wie das CH4-Molekül nach dem Schalenmodell, nach dem Kugelwolkenmodell und schließlich nach dem Orbitalmodell aussieht.
Vorkommen EF
Methan ist mit 75% bis 99% der Hauptbestandteil des Erdgases, und auch in Kohleflözen und Erdöllagerstätten kann Methan vorkommen. Methan wird auch von Mikroorganismen gebildet, wenn organische Stoffe unter Luftabschluss zersetzt werden. Am Meeresgrund ist viel Methan in Form von Methanhydrat ("Methaneis") gespeichert. Bestimmte Darmbakterien können Nahrungsmittelbestandteile enzymatisch spalten, dabei entsteht dann auch Methan, was zu unangenehmen Blähungen führen kann.
Für Wissensdurstige:
➥Methan-VorkommenHier verweise ich einmal auf die ausführliche Seite in der Wikipedia.
Physikalische Eigenschaften EF
Der Schmelzpunkt von Methan ist mit -182 ºC sehr niedrig, ebenso der Siedepunkt mit -161 ºC. Ursache hierfür sind die unpolaren C-H-Bindungen im Molekül. Die Methan-Moleküle können weder Dipol-Dipol-Bindungen noch H-Brücken untereinander bilden.
Auch die extrem geringe Wasserlöslichkeit des Methans wird dadurch erklärt, dass Methan keine H-Brücken (zu H2O-Molekülen) ausbilden kann.
Methan ist farb- und geruchlos; seine Dichte ist deutlich geringer als die der Luft, weshalb Methan, das auf der Erdoberfläche freigesetzt wurde, in die oberen Atmosphärenschichten aufsteigt und dort als Treibhausgas 20-30 mal aktiver ist als Kohlendioxid.
Chemische Eigenschaften / Reaktionen EF
Zwei typische Reaktionen des Methans, die man als Schüler(innen) kennen sollte, sind die Oxidation und die Chlorierung. Beide Reaktionen spielen eine wichtige Rolle im Alltag und in der chemischen Industrie.
Oxidation
Bei der Reaktion mit Sauerstoff nach der Gleichung
$CH_{4} + 2 \ O_{2} \to CO_{2} + 2 \ H_{2}O \ \ \ \Delta H = -802,4 kJ/mol$
wird eine große Menge an Wärmeenergie freigesetzt, was vor allem bei der Verbrennung von Erdgas eine wichtige Rolle spielt.
Chlorierung
Unter Lichteinfluss reagiert Methan mit dem Halogen Chlor (und Brom).
Bei der Chlorierung entsteht zunächst Chlormethan CH3Cl. Reagiert das Chlormethan weiter, bildet sich Dichlormethan CH2Cl2. Bei weiterer Reaktion mit Chlor entsteht Trichlormethan CHCl3 bzw. Chloroform, früher als Betäubungsmittel bei Operationen eingesetzt. Am Ende, bei noch weiterer Chlorierung, ergibt sich Tetrachlormethan CCl4 bzw. Tetrachlorkohlenstoff, ein wichtiges unpolares Lösemittel.
Für Schüler(innen) der Qualifikationsphase:
➥Radikalische SubstitutionDie Chlorierung von Methan (und anderen Alkanen) verläuft über einen radikalischen Mechanismus, der als Radikalische Substitution bezeichnet wird.
Auf dieser Seite für die Qualifikationsphase wird im Detail auf diesen Mechanismus eingegangen.
Für Studierende der Chemie:
➥MethanDiese Lexikon-Seite behandelt das Thema "Methan" noch ausführlicher als auf dieser Einführungsseite dargestellt.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW