1. Struktur
Das charakteristische Merkmal von Ethen und den höheren Alkenen ist die C=C-Doppelbindung.
1.1 Die C=C-Doppelbindung, näher betrachtet
Bereits auf der Einführungsseite zum Thema Alkene und in dem EF-Kurs über Alkene hatten wir kurz über die C=C-Doppelbindung gesprochen. Dabei hatten wir festgestellt, dass die C=C-Doppelbindung aus einer starken sigma-Bindung und einer schwächeren pi-Bindung besteht, und dass diese pi-Bindung, weil sie so schwach ist, auch leicht aufgebrochen werden kann. Dies ist der Grund für die relativ hohe Reaktionsfreudigkeit der Alkene (im Vergleich zu den weniger reaktiven Alkanen).
Auf dieser Seite wollen wir uns die C=C-Doppelbindung nun etwas näher anschauen. Betrachten wir dazu die folgende Zeichnung:
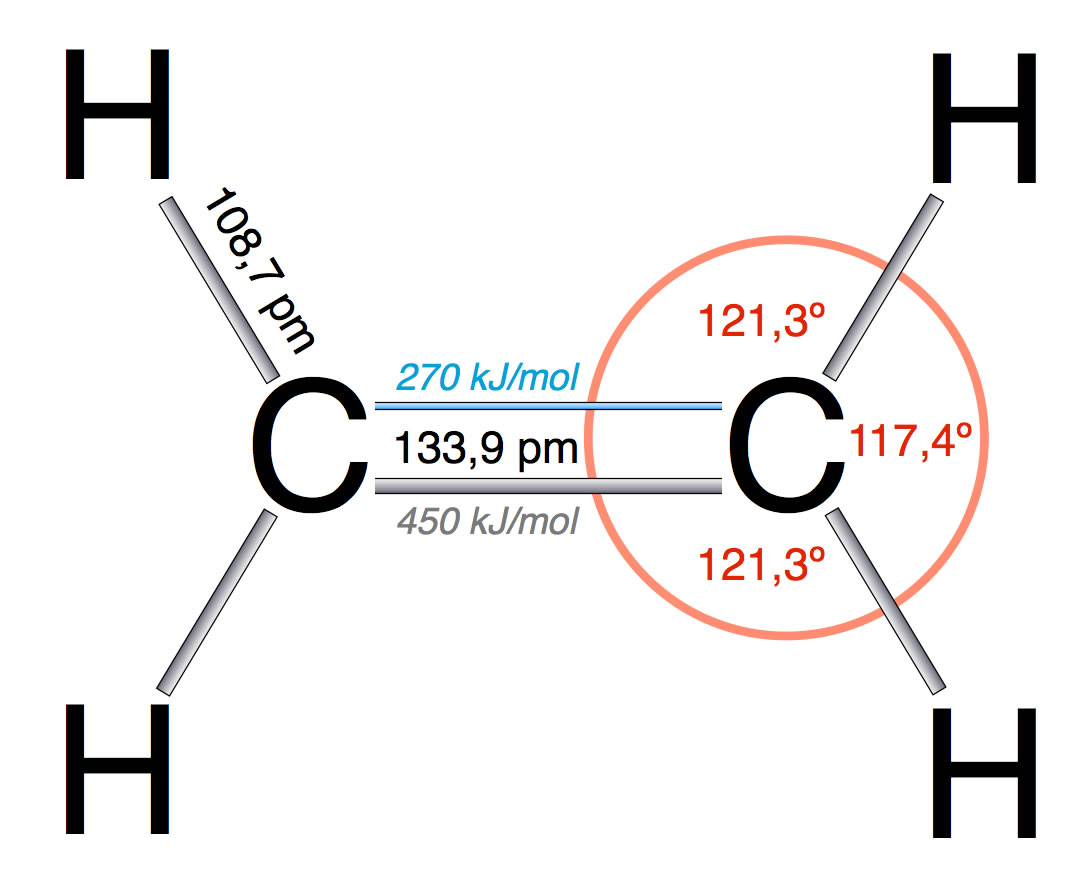
Strukturdaten des Ethen-Moleküls
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Auf der Zeichnung kann man die Bindungslängen, die Bindungswinkel und die Bindungsdissoziationsenergien der einzelnen Bindungen im Ethen-Molekül erkennen.
1.1.1 Bindungslängen
Die Länge einer normalen C-C-Einfachbindung beträgt um die 155 pm. Die C=C-Doppelbindung ist mit ca. 134 pm deutlich kürzer.
Frage:
Warum ist die C=C-Doppelbindung kürzer als die C-C-Einfachbindung?
Antwort:
Die beiden C-Atome werden im Ethen durch insgesamt vier Elektronen zusammengehalten, während sie im Ethan nur durch zwei Elektronen zusammengehalten werden. Durch die stärkere Anziehungskraft der vier Bindungselektronen rücken die Atomkerne der beiden C-Atome näher zusammen.
1.1.2 Bindungsdissoziationsenergie
Die Bindungsdissoziationsenergie, also die Energie, die man benötigt, um eine kovalente Bindung zu spalten, ist für die sigma-Bindung mit 450 kJ/mol recht hoch. Die pi-Bindung lässt sich wesentlich leichter spalten, hierfür sind nur 270 kJ/mol notwendig.
Bei den Additions-Reaktionen, über wir auf der Einführungsseite gesprochen haben, wird immer die pi-Bindung gespalten, niemals die sigma-Bindung. Lediglich bei der Addition von Fluor F2 kann es auch mal vorkommen, dass beide Bindungen gespalten werden, weil Fluor ein extrem reaktiver Stoff ist, für den selbst die 450 kJ/mol der sigma-Bindung kein Problem sind.
1.1.3 Bindungswinkel
Interessant sind auch die Bindungswinkel im Ethen-Molekül. Während die H-C-H-Winkel beim Ethan-Molekül einen Wert von 109º haben, also dem Tetraederwinkel entsprechen, beträgt der H-C-H-Bindungswinkel im Ethen 120º. Außerdem ist wegen der Doppelbindung die freie Drehbarkeit um die C-C-Achse eingeschränkt, so dass das gesamte Molekül planar ist, also in einer Ebene liegt.
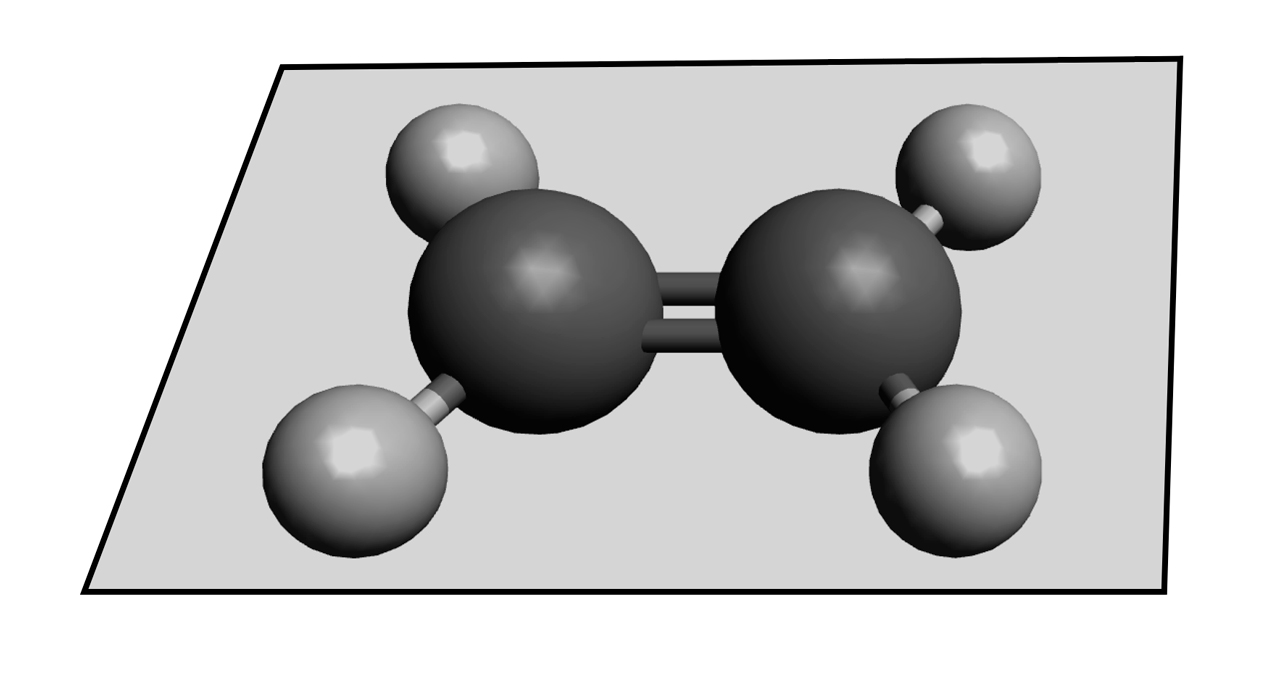
Ethen ist ein planares Molekül
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
2. Physikalische Eigenschaften
Ethen ist ein farbloses, geruchloses und leicht betäubend wirkendes brennbares Gas. Der Schmelzpunkt liegt bei -169,1 ºC, der Siedepunkt bei -103,7 ºC. Die Wasserlöslichkeit kann vernachlässigt werden, in unpolaren Lösemitteln ist Ethen dagegen sehr gut löslich ("Gleiches löst Gleiches").
Ethen hat ähnliche physikalische Eigenschaften wie Ethan, weil beide Moleküle nur aus Kohlenstoff- und Wasserstoff-Atomen bestehen. Die einzigen Kräfte, die zwischen den Ethen-Molekülen herrschen, sind die schwachen London-Kräfte, die in der Schule auch manchmal als van-der-Waals-Kräfte bezeichnet werden.
London-Kräfte und van-der-Waals-Kräfte
Die London-Kräfte gehören zu den van-der-Waals-Kräften, von denen es insgesamt drei verschiedene Typen gibt (London-, Debye- und Keesom-Kräfte). London-Kräfte sind typisch für Kohlenwasserstoffe wie Alkane, Alkene oder Alkine.
Wer sich näher für die drei van-der-Waals-Kräfte interessiert, kann in meinem Chemie-Lexikon die Einzelheiten nachlesen.
3. Chemische Eigenschaften
3.1 Elektrophile Addition
Die C=C-Doppelbindung bestimmt die chemischen Eigenschaften des Ethens. Die Doppelbindung ist wegen der hohen Elektronendichte Angriffsziel von elektrophilen Teilchen. Darunter versteht man Atome, Ionen oder Moleküle, die positiv geladen sind oder wenigstens eine positive Teilladung tragen und daher leicht von elektronenreichen Reaktionspartnern angezogen werden. Ein Beispiel für eine solche elektrophile Addition haben wir bereits auf der Einführungsseite kennen gelernt.
Diese Seite aus der Reihe "Studienvorbereitung Organische Chemie" behandelt die C=C-Doppelbindung auf einem recht anspruchsvollen Niveau, sie ist eher für engagierte Schüler(innen) eines Leistungskurses Chemie und für Studienanfänger(innen) geeignet. Kenntnisse des Orbitalmodells werden vorausgesetzt.
Diese Seite aus der Abteilung "Reaktionsmechanismen" behandelt die typische Reaktion der Alkene sehr ausführlich.
3.2 Oxidation / Verbrennung
Andere wichtige Reaktionen des Ethens sind die Oxidation; unter Sauerstoffzufuhr verbrennt Ethen zu Wasser und Kohlendioxid und liefert dabei recht viel Wärmeenergie:
$H_{2}C=CH_{2} + 3 \ O_{2} \to 2 \ CO_{2} + 2 \ H_{2}O \ \ \ \Delta H = -1411 \ kJ/mol$
Da hier eine C=C-Doppelbindung gespalten werden muss, ist die Energiebilanz nicht ganz so günstig wie bei der Verbrennung von Ethan ($\Delta H = -1560 kJ/mol$).
3.3 Polymerisation
Viele einfache Alkene sind Bausteine für wichtige Kunststoffe. Der weltweit am meisten produzierte Kunststoff, das Polyethylen, wird aus dem Ethen hergestellt.
Einzelheiten zum Polyethen bzw. Polyethylen finden Sie auf dieser Seite.
4. Ethen als Pflanzenhormon
Schon seit vielen Jahrzehnten weiß man, dass man unreife grüne Tomaten zum schnelleren Reifen bringen kann, wenn man reife rote Tomaten dazulegt. Heute weiß man, dass reife Tomaten Ethen produzieren, das dann die unreifen Tomaten zum Reifen bringt. Ethen ist also ein Phytohormon, also ein Pflanzenhormon.
In diesem Abschnitt des Wikipedia-Artikels "Ethen" wird recht ausführlich auf Ethen als Phytohormon eingegangen. Wer sich dafür interessiert, sollte also diesen Abschnitt lesen. Dieses Thema eignet sich auch gut für ein Chemie-Referat, um die Chemie-Note zu verbessern.
Seitenanfang -
Allgemeines -
Ethen -
höhere Alkene -
cis/trans-Isomerie -
Darstellung -
Dimere -
Polymere -
Abitur