Was ist das Besondere an Phenol?
Phenol (siehe auch Lexikon-Artikel) ist eine der gefährlichsten Stoffe der Chemie-Sammlung, neben Brom und konz. Schwefelsäure, aber das ist nicht das Besondere an Phenol. Das Besondere an Phenol ist, dass in jedem Schulbuchkapitel zur Chemie der Aromaten das Phenol-Molekül in den Vordergrund gerückt wird. Dabei ist Phenol eigentlich nichts anderes als ein Benzol mit einer OH-Gruppe. Diese OH-Gruppe verleiht dem Phenol aber neue Eigenschaften im Vergleich zu Benzol.
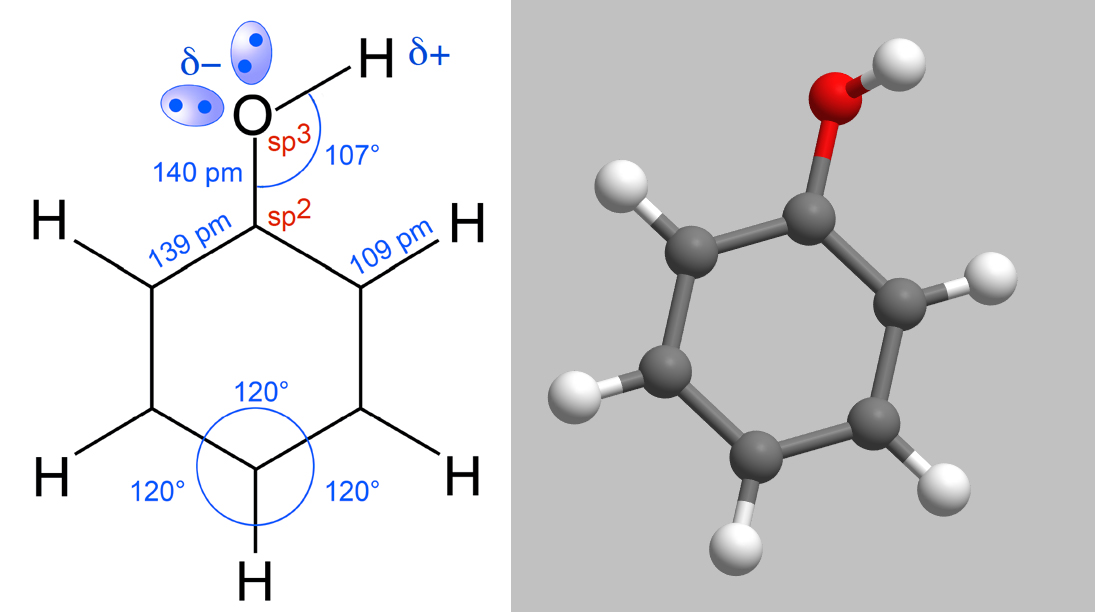
Das Phenol-Molekül mit Bindungslängen und Bindungswinkeln sowie in einer 3D-Darstellung
Diese Abbildung zeigt das Phenol-Molekül in allen Einzelheiten, vor allem die Bindungslängen und die Bindungswinkel sind hervorgehoben. Rechts sieht man eine räumliche Darstellung des Phenol-Moleküls.
Phenol ist wasserlöslich
Löst man ein paar Phenol-Kristalle in wenig Wasser, erhält man eine mehr oder weniger klare Lösung. Löst man die gleiche Menge Phenol in etwas mehr Wasser, so geht das nicht - eigenartig, nicht wahr? Gibt man dann noch mehr Wasser dazu, löst sich das Phenol wieder und es entsteht eine klare Lösung. Weitere Einzelheiten siehe Vertiefungsseite "Mischungslücke beim Phenol".
Bromierung von Phenol
In den meisten Schulbüchern der Oberstufen-Chemie wird die Bromierung von Phenol mit der Bromierung von Benzol und Toluol verglichen.
- Benzol lässt sich nur mit Hilfe eines Katalysators wie Eisenbromid oder Alumiumbromid bromieren. Siehe dazu auch die Seite "Bromierung von Benzol" in der Abteilung Reaktionstypen / Elektrophile Substitution.
- Toluol lässt sich leichter bromieren als Benzol, aber ein Katalysator wird trotzdem noch benötigt. Die Methylgruppe übt einen leichten +I-Effekt auf den Benzolring aus, dadurch wird die Elektronendichte im Benzolring erhöht, was die Attraktivität des Benzolringes für elektrophile Substituenten deutlich erhöht.
- Phenol lässt sich noch leichter bromieren als Toluol, ein Katalysator ist hier nicht mehr notwendig. Sobald man Bromwasser in ein Reagenzglas mit alkalischer Phenol-Lösung gibt, entfärbt sich das Bromwasser relativ schnell.
An sich sollte man erwarten, dass die Phenol-Bromierung deutlich langsamer verläuft als die Toluol-Bromierung. Die OH-Gruppe des Phenols übt nämlich einen -I-Effekt auf den Benzolring aus und erniedrigt dadurch die Elektronendichte und die Attraktivität/Reaktivität des Moleküls. Das Gegenteil ist aber der Fall. Einzelheiten dazu finden Sie auf den Seiten "+M-Effekt vs. -I-Effekt beim Phenol" sowie "Die Zweitsubstitution" im Bereich "Elektrophile Substitution".