"Normale" konzentrierte Schwefelsäure reagiert bei Raumtemperatur nicht mit Benzol, mit rauchender Schwefelsäure schafft man das aber.
Die rauchende Schwefelsäure ist eine konzentrierte Schwefelsäure, die mit dem Gas Schwefeltrioxid SO3 angereichert wurde. Warum ist nun rauchende Schwefelsäure reaktiver als "einfache" konzentrierte Schwefelsäure?
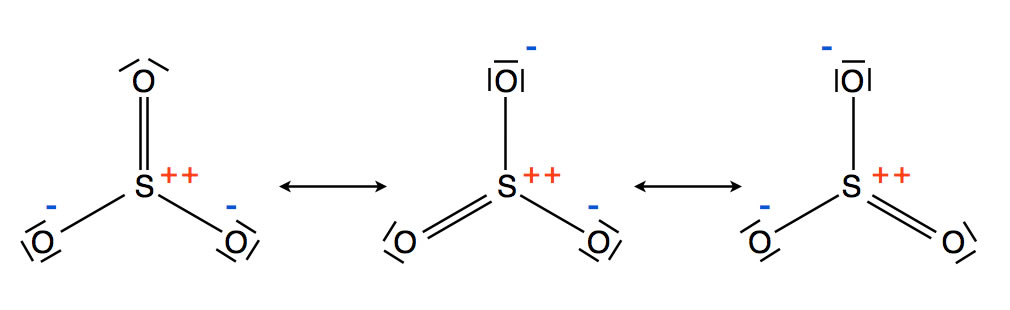
Das SO3-Molekül mit seinen drei Grenzstrukturen
Wie man auf dieser Abbildung gut sehen kann, liegt das SO3-Molekül in drei Grenzstrukturen vor. In jeder Grenzstruktur ist das S-Atom zweifach positiv geladen, während sich zwei negative Ladungen auf die drei O-Atome verteilen. Insgesamt gesehen ist das SO3-Molekül also elektrisch neutral, besitzt aber ein äußerst positives S-Atom. Mit diesem positiven S-Atom kann nun ein Benzol-Molekül angegriffen werden:
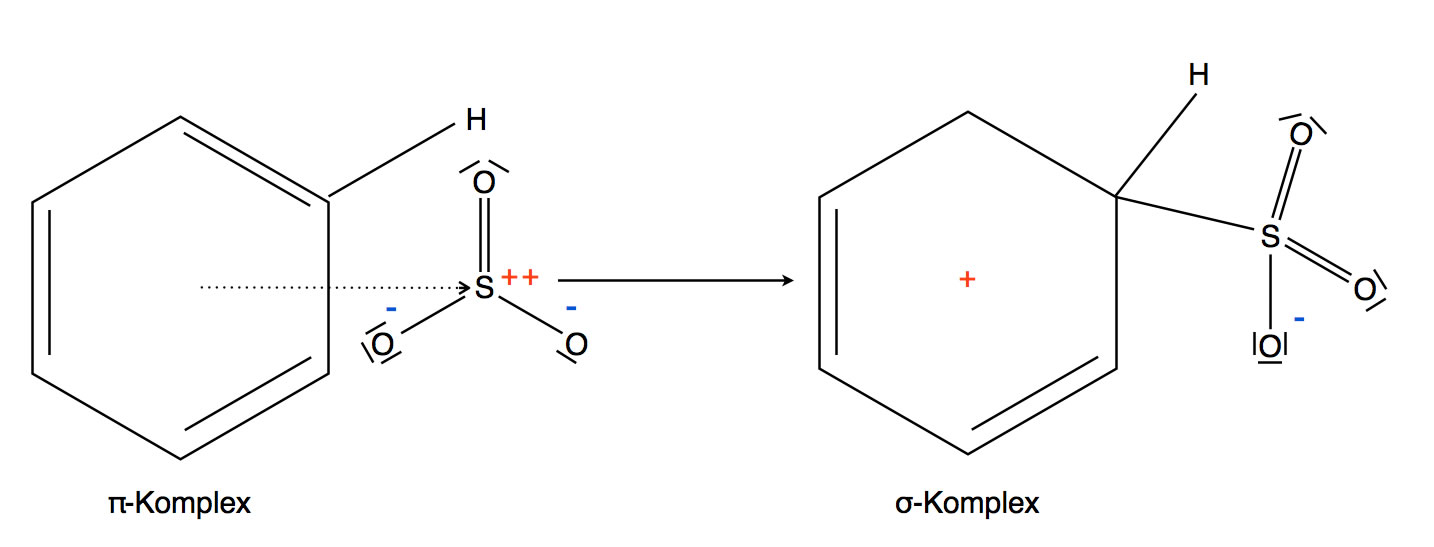
Das Ergebnis dieses elektrophilen Angriffs ist der abgebildete sigma-Komplex. Um den aromatischen Zustand wieder herzustellen, wird nun ein Proton abgegeben. Gleichzeitig lagert sich ein Proton an das negativ geladene O-Atom der SO3-Gruppe an. So entsteht das Endprodukt dieser elektrophilen Substitution, die Benzolsulfonsäure C6H5-SO3H.
Die Sulfonierung kann auch mit normaler konz. Schwefelsäure durchgeführt werden, wenn man diese erhitzt. Dabei findet zunächst eine Autoprotolyse statt: Ein Proton wird von einem H2SO4-Molekül auf ein anderes übertragen. Das H3SO4+-Ion gibt dann ein Wasser-Molekül ab, und übrig bleibt ein HSO3+-Ion, das als Sulfonium-Ion bezeichnet wird. Das Sulfonium-Ion ist stark elektrophil und kann sich direkt an ein Benzol-Molekül anlagern.
Bedeutung der Sulfonierung
Sulfonsäuren sind wichtige Zwischenprodukte der organischen Chemie; sie spielen zum Beispiel in der Farbstoffchemie, in der Arzneimittelchemie und bei der Herstellung von Waschmitteln eine wichtige Rolle. Durch Reaktion mit Natronlauge bei 300 ºC und anschließender Neutralisation mit einer Säure kann man die Sulfongruppe durch eine Hydroxidgruppe ersetzen. So kann man aus Benzolsulfonsäure beispielsweise Phenol C6H5-OH herstellen.
Benzoesäure C6H5-COOH kann durch Umsetzung von Benzolsulfonsäure mit Natriumacetat HCOONa hergestellt werden.
Sulfongruppen als Schutz- bzw. Maskierungsgruppen
Sulfongruppen werden auch zum Schutz bzw. zur Maskierung bestimmter Bereiche in einem Aromaten eingesetzt. Bevor man die eigentliche Reaktion durchführt, beispielsweise eine Nitrierung oder eine Bromierung, lässt man den Aromaten unter bestimmten Bedingungen mit rauchender Schwefelsäure reagieren. Bestimmte C-Atome des Aromaten werden dann sulfoniert. Nun wird die eigentliche Reaktion durchgeführt. Dabei sind die sulfonierten C-Atome gegen den elektrophilen Angriff geschützt, während die nicht sulfonierten C-Atome bevorzugt angegriffen werden.
Nach der eigentlichen Reaktion werden die Sulfongruppen durch durch bestimmte andere Reaktionen wieder entfernt.
Beispiel: Synthese von 2-Nitroresorcin
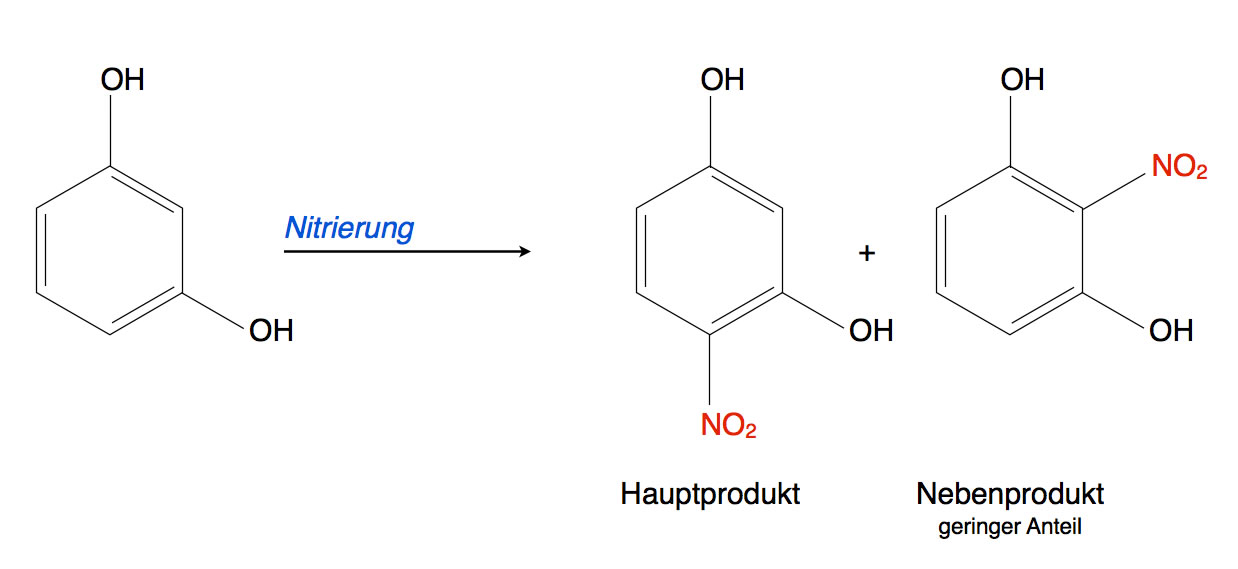
Direkte Nitrierung von Resorcin
Die Verbindung 2-Nitroresorcin soll aus Resorcin hergestellt werden. Würde man Resorcin direkt nitrieren, so wie im Bild oben dargestellt, erhielte man hauptsächlich 4-Nitroresorcin, aber so gut wie kein 2-Nitroresorcin. Der Grund hierfür ist die sterische Hinderung der beiden OH-Gruppen.
Die sterische Hinderung wirkt auf zwei Weisen, nämlich räumlich, weil die OH-Gruppen Platz einnehmen und zwischen den OH-Gruppen sozusagen Platzmangel besteht, und einmal über elektrostatische Abstoßung. Die OH-Gruppen sind nämlich wegen der hohen EN von Sauerstoff leicht negativ geladen, und die Nitrogruppe wegen der zwei O-Atome ebenfalls. Die OH-Gruppen stoßen die Nitrogruppe also elektrisch ab.
Wenn man das Resorcin dagegen zunächst sulfoniert, entsteht Resorcin-4,6-disulfonsäure, also ein Molekül mit zwei OH-Gruppen und zwei Sulfongruppen:
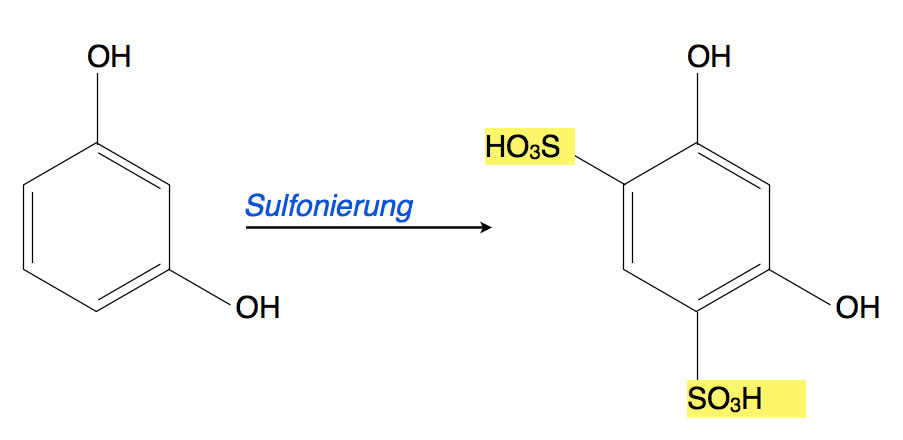
Zweifache Sulfonierung von Resorcin
Die beiden OH-Gruppen dirigieren die Substitution in die ortho- und para-Position. Als Hauptprodukt der zweifachen Sulfonierung von Resorcin entsteht daher Resorcin-4,6-disulfonsäure. Die ortho-Position 2 könnte zwar ebenfalls sulfoniert werden, dies ist aber aus sterischen Gründen eher unwahrscheinlich - die SO3H-Gruppe ist noch größer als die NO2-Gruppe, somit ist es unwahrscheinlich, dass die SO3H-Gruppe zwischen den beiden OH-Gruppen Platz findet.
Wird nun anschließend eine Nitrierung durchgeführt, kann sich das Nitronium-Ion nur an die noch freien Positionen 2 und 5 setzen.
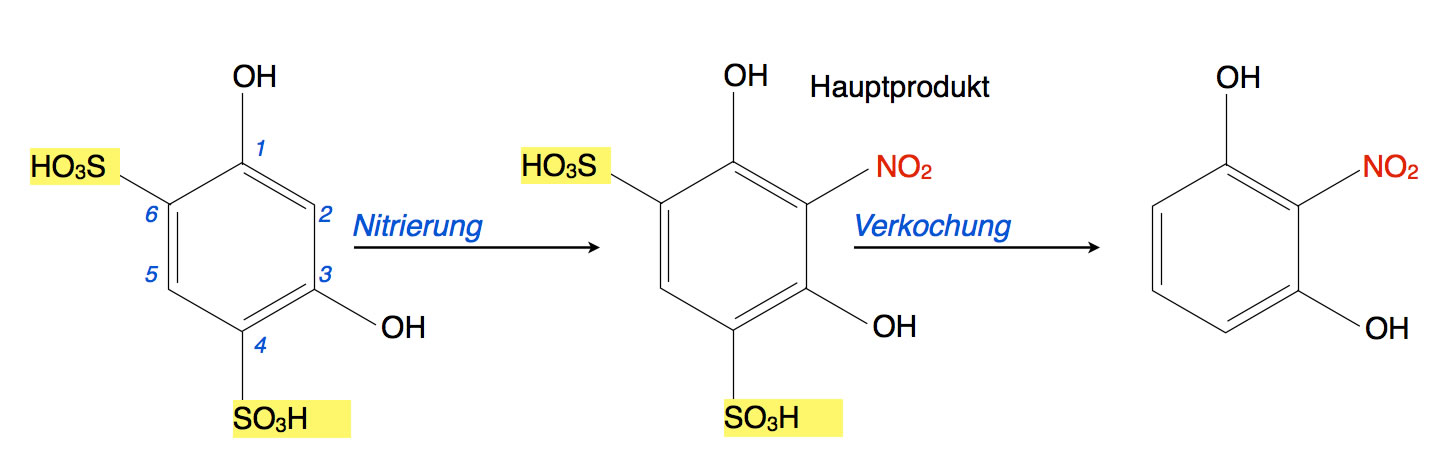
Nitrierung, anschließend Entfernung der Sulfongruppen durch Verkochung
Die beiden OH-Gruppen sind schon recht groß, daher ist es für das Nitronium-Ion nicht so einfach, sich zwischen diese beiden Gruppen zu setzen. Die beiden SO3H-Gruppen sind allerdings noch viel größer, die Wahrscheinlichkeit, dass sich ein Nitronium-Ion zwischen diese beiden großen Gruppen zwängt, ist also sehr klein. Im Endeffekt kann die Nitrierung also fast nur noch an Position 2 erfolgen.
Anschließend reicht eine einfache Behandlung mit Wasserdampf (Verkochung), um die beiden Sulfongruppen wieder abzuspalten. Und schon hat man eine Verbindung erhalten, die man auf direktem Wege nur mit sehr geringer Ausbeute bekommen hätte.
