Grundlegender Mechanismus
Die Friedel-Crafts-Acylierung ist eigentlich nicht verwandt mit der Friedel-Crafts-Alkylierung, die Reaktion wurde aber von den gleichen Forschern entwickelt, daher die Namensähnlichkeit.
Bei der Friedel-Crafts-Acylierung reagiert ein Carbonsäure-Chlorid mit einem Aromaten. Dazu muss das Säurechlorid mit einer Lewis-Säure wie zum Beispiel Aluminiumchlorid zunächst aktiviert werden. Hier ein Beispiel:
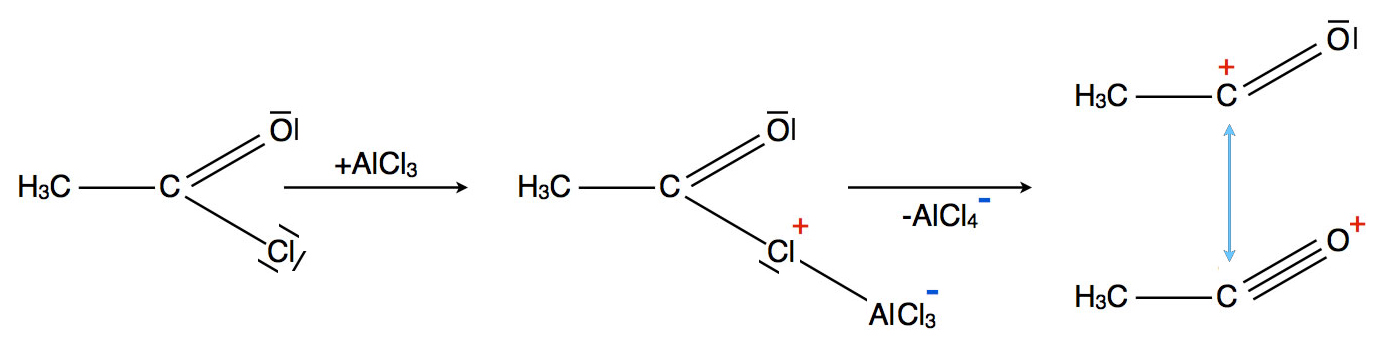
Bildung eines Acylium-Ions aus einem Säurechlorid
Zunächst setzt sich das Chlor-Atom mit einem freien Elektronenpaar als Lewis-Base an das Metall-Atom des Katalysators. Das Chlor-Atom gibt formal ein Elektron an das Metall-Atom ab und lädt sich daher positiv auf. Im zweiten Reaktionsschritt wird das Chlor-Atom heterolytisch abgespalten und geht vollständig zum Katalysator über. Zurück bleibt das Acylium-Ion, welches in zwei Grenzstrukturen vorliegt und daher relativ stabil ist[1, p.554].
Die Grenzstruktur mit der positiven Ladung am C-Atom setzt sich dann als Elektrophil an den Benzolring; es findet dann eine ganz "normale" elektrophile Substitution statt:
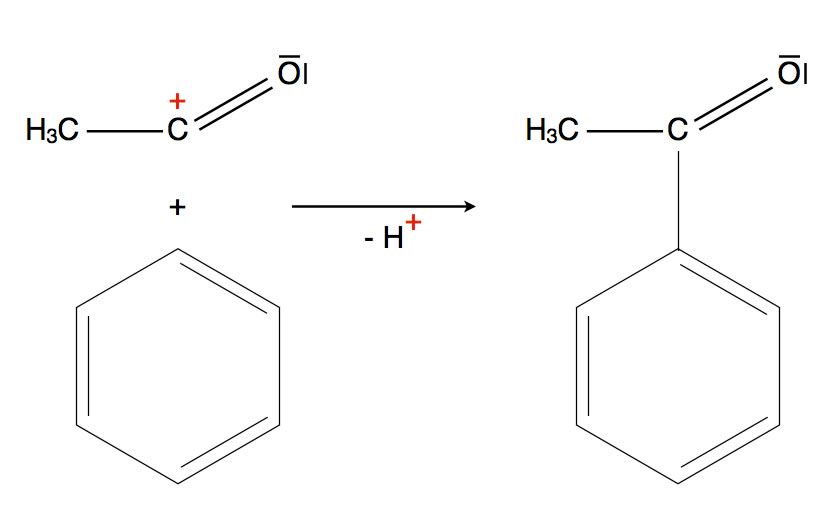
Addition des Acylium-Ions und Abspaltung eines Protons = Substitution
Wie man auf dieser Abbildung gut sehen kann, eignet sich auch die Acylierung zur Einbringung einer neuen C-C-Bindung in den Aromaten. Die Acyl-Gruppe kann dann reduziert werden, und so erhält man einen Alkohol oder gar einen Alkylrest.
Die Acylierung hat eine großen Vorteil gegenüber der Alkylierung: Die Einführung der Acyl-Gruppe erniedrigt die Elektronendichte des Aromaten und somit seine Reaktivität. Daher ist es recht unwahrscheinlich, dass "aus Versehen" eine zweite Acyl-Gruppe in das Molekül eingebaut wird. Der Nachteil der Acylierung soll allerdings auch nicht verschwiegen werden: Die Reduktion der Acyl-Gruppe ist manchmal ganz schön kompliziert und erfordert einen hohen experimentellen Aufwand.
Ringbildungen
Interessant für die Syntheseplanung ist die Möglichkeit der intramolekularen Friedel-Crafts-Alkylierung bzw. -Acylierung. Schauen wir uns mal ein Beispiel dafür an:
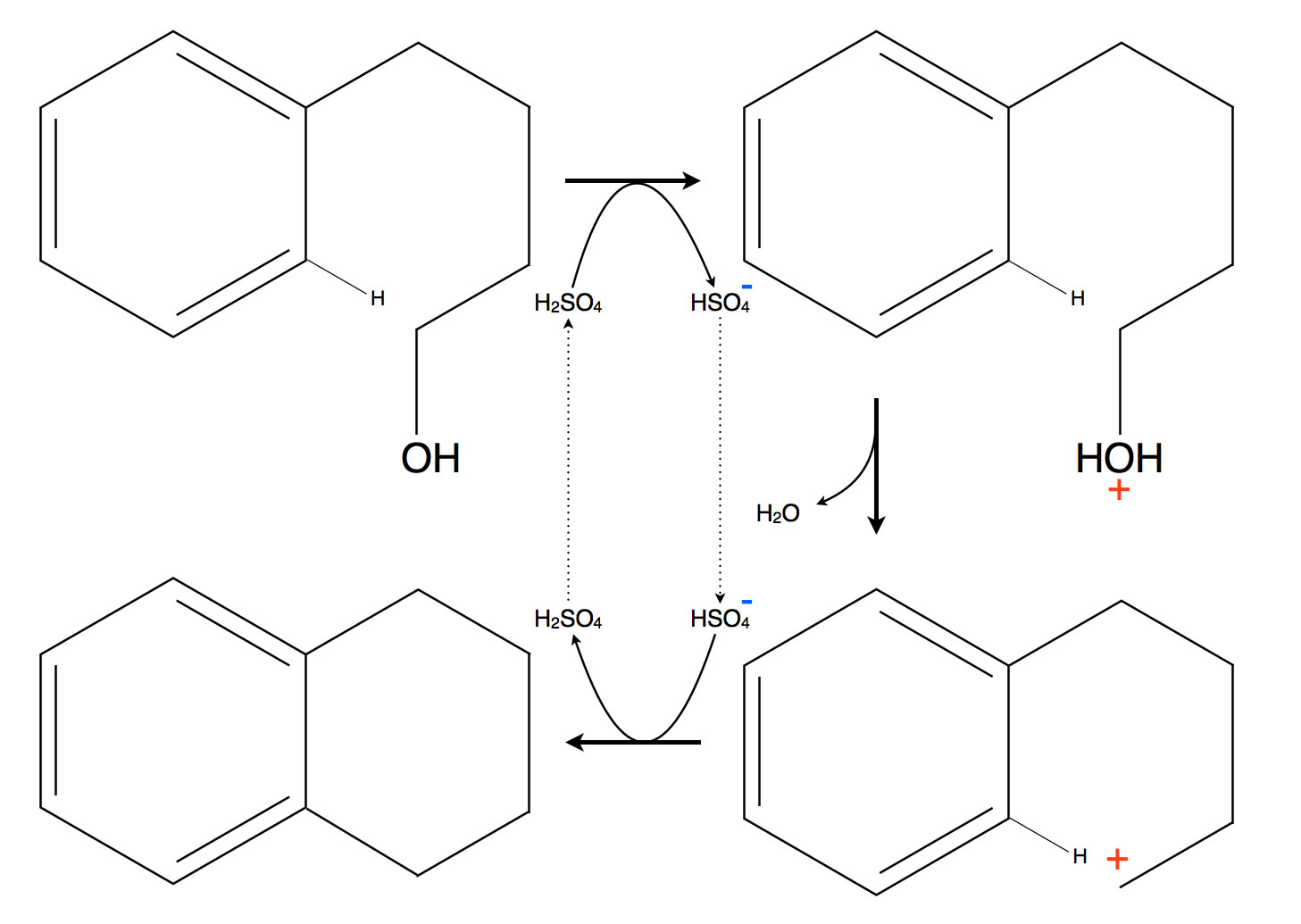
Ringbildung bei der Friedel-Crafts-Alkylierung
Im Bild sehen wir oben links ein Molekül 4-Phenyl-butan-1-ol, und zwar so dargestellt, dass die Ringbildung leicht zu verstehen ist. Im ersten Reaktionsschritt findet eine Umsetzung mit einer Säure statt, im zweiten Schritt wird Wasser abgespalten und es entsteht ein intramolekulares Carbenium-Ion. Der vierte Schritt ist dann die eigentliche elektrophile Substitution, der sigma-Komplex als Zwischenprodukt wurde hier nicht mit eingezeichnet. Würde man das Endprodukt zweimal dehydrieren, erhielt man einen neuen Aromaten, das Naphthalin.
Fluorescein und Phenolphthalein
Die Synthese des bekannten Indikators Phenolphthalein aus Phthalsäureanhydrid (oder Phthalsäure) und Phenol ist ebenfalls eine Friedel-Crafts-Acylierung. In Einzelheiten wird diese Synthese auf der Farbstoffchemieseite zum Phenolphthalein besprochen. Auch die Synthese des Farbstoffs Fluorescein beruht auf einer Friedel-Crafts-Acylierung. Einzelheiten siehe "Fluorescein" auf den Farbstoffchemieseiten.
Quellen:
- Carey, Sundberg, Organische Chemie - ein weiterführendes Lehrbuch. Weinheim 1995.
- Römpp Chemie-Lexikon, 9. Auflage 1992
