Grundlegendes
Wenn ein Nucleophil Y mit einer organischen Verbindung R-X reagiert, dann stellt sich die Frage, ob die Reaktion nach dem SN1-Mechanismus oder nach dem SN2-Mechanismus abläuft. Beide Mechanismen sind theoretisch denkbar. Es ist sogar ein völlig anderer Reaktionstyp denkbar, nämlich die Eliminierung, wie wir später noch sehen werden.
Welcher Mechanismus tatsächlich stattfindet, hängt von mehreren Faktoren ab.
Art des Substrats R-X
Primäre Substrate wie 1-Brombutan reagieren bevorzugt nach dem SN2-Mechanismus, tertiäre Substrate wie 2-Methyl-2-brompropan dagegen bevorzugt nach dem SN1-Mechanismus.
Verbindungen, bei denen die Austrittsgruppe an einem primären C-Atom sitzt, lassen sich von einem Nucleophil relativ leicht von der Rückseite angreifen. Das positiv polarisierte C-Atom ist frei zugänglich. Je mehr Alkylgruppen oder andere Substituenten an diesem C-Atom sitzen, desto schwieriger wird ein erfolgreicher SN1-Angriff des Nucleophils (sterische Hinderung).
Verbindungen, bei denen die Austrittsgruppe an einem tertiären C-Atom sitzt, können relativ leicht stabile Carbenium-Ionen bilden. Die positive Ladung des Carbenium-Ions kann dann von drei anderen Substituenten etwas kompensiert werden. Tertiäre Halogenalkane und Alkohole gehen daher bevorzug eine SN1-Reaktion mit dem Nucleophil ein.
Bei sekundären Substraten kann sowohl eine SN1- wie auch eine SN2-Reaktion stattfinden. Hier kommen dann die anderen Faktoren zum Ausschlag, die den Verlauf der Reaktion beeinflussen.
- Primäre Substrate: SN2-Verlauf
- Sekundäre Substrate: SN2- oder SN1-Verlauf
- Tertiäre Substrate: SN1-Verlauf
Art des Lösemittels
Polare Lösemittel wie Wasser, Ethanol etc. umhüllen das Nucleophil, Wasser bildet beispielsweise Hydrathüllen um Bromid-, Chlorid- oder Hydroxid-Ionen. Allgemein spricht man von einer Solvatisierung bzw. einer Solvathülle.
Ein Nucleophil, das von einer solchen Solvathülle umgegeben ist, ist ein sehr schwaches Nucleophil. Die Hydrathülle behindert das Nucleophil beim Angreifen des Substrats. Das macht sich besonders bei SN2-Reaktionen negativ bemerkbar. Hier muss das Nucleophil die Abgangsgruppe ja aus dem Substrat verdrängen, und mit einer Solvathülle ist das nur sehr schwer möglich. Daher steigt in polaren Lösemitteln automatisch die Wahrscheinlichkeit für einen SN1-Verlauf der Reaktion.
Unpolare Lösemittel wie Hexan dagegen können keine Solvathüllen um das Nucleophil bilden. Das Nucleophil liegt hier "nackt" vor und kann das Substrat ungehindert angreifen. Hier wird dann der SN2-Mechanismus begünstigt.
Bei einer SN1-Reaktion wird zunächst die Abgangsgruppe abgespalten, ein Brom-Atom beispielsweise als Bromid-Ion. Ein polares Lösemittel kann ein abgespaltenes Ion sofort stabilisieren, indem es eine Solvathülle um das Ion bildet. Dadurch wird die SN1-Reaktion begünstigt. Unpolare Lösemittel können eine abgegebene Abgangsgruppe nicht auf diese Weise stabilisieren, und das erhöht wiederum die Wahrscheinlichkeit für einen SN2-Verlauf.
- Polare Lösemittel: SN1-Verlauf
- Unpolare Lösemittel: SN2-Verlauf
Art des Nucleophils
Ein weiterer Einflussfaktor für den Verlauf der Reaktion ist die Stärke und die Struktur des Nucleophils.
Starke Nucleophile können die Abgangsgruppe leicht aus dem Substrat verdrängen, sofern diese leicht zugänglich ist (primäre Substrate). Ein schwaches Nucleophil hat da schon große Probleme.
Große Nucleophile, auch wenn sie stark sind, kommen nicht an das positiv polarisierte C-Atom des Substrats heran, sie behindern sich quasi selbst sterisch. Kleine Nucleophile, auch wenn sie schwach sind, haben dagegen eine größere Chance für einen SN2-Angriff.
- Große oder schwache Nucleophile: SN1-Verlauf
- Kleine oder starke Nucleophile: SN2-Verlauf
Art der Abgangsgruppe
Die Art der Abgangsgruppe wirkt sich zunächst sowohl auf die SN1- wie auch auf die SN2-Reaktion aus. Ist die Abgangsgruppe schlecht, kann weder der eine noch der andere Mechanismus gut ablaufen, ist die Abgangsgruppe gut, so profitieren beide Mechanismen davon, vor allem aber der SN1-Mechanismus.
Wieso wirkt sich die Qualität der Abgangsgruppe besonders stark auf die SN1-Reaktion aus?
Bei der SN1-Reaktion ist der geschwindigkeitsbestimmende (langsamste) Schritt die Abspaltung der Abgangsgruppe.
Es gibt gute und schlechte Abgangsgruppen. Allgemein sind schwache Basen wie das Iodid-Ion sehr gute Abgangsgruppen. Auch das Bromid-Ion ist eine gute Abgangsgruppe, aber nicht so gut wie Iodid.
Große Abgangsgruppen aus mehreren Atomen können leichter abgespalten werden, wenn das entstehende Ion durch zwei oder mehr Grenzstrukturen stabilisiert wird.
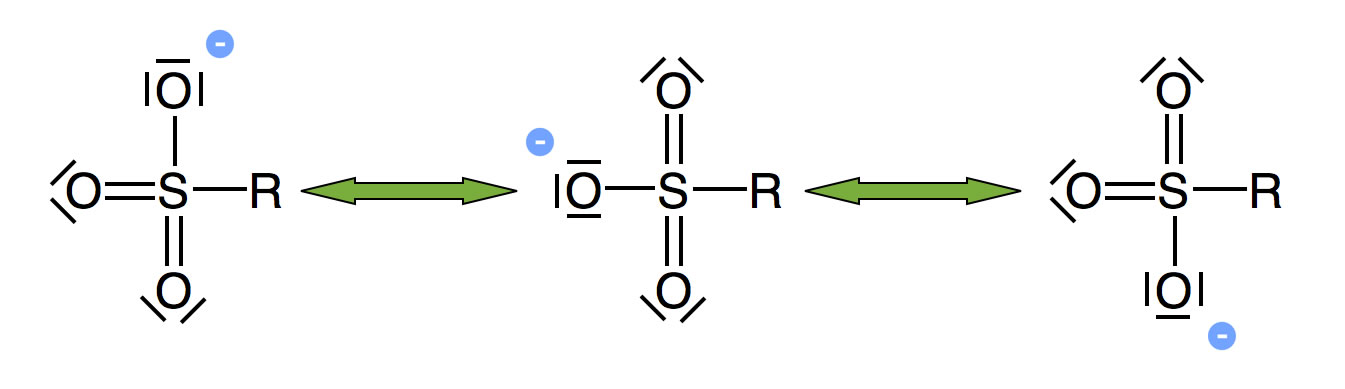
Mesomeriestabilisierung beim R-SO3--Ion
Autor: Ulrich Helmich 2018, Lizenz: ---
Ein gutes Beispiel für eine solches mesomeriestabilisiertes Anion ist das SO3H - Anion.
Die Hydroxid-Gruppe ist eine sehr schlechte Abgangsgruppe, weil es eine sehr starke Base ist. Protoniert man die OH-Gruppe allerdings durch Zusatz einer Säure, bildet sich ein eine OH2+-Gruppe. Diese kann sehr leicht als Wasser-Molekül abgespalten werden.
- Gute Abgangsgruppen: I-, Br-, Cl-
- Schlechte Abgangsgruppen: OH-, C2H5O-, H2N-
Experimente geben Aufschluss
Aber auch dann, wenn man alle Einflussfaktoren kennt, kann letzten Endes nur das Experiment darüber Aufschluss geben, welcher Mechanismus tatsächlich abläuft. Im Idealfall reichen hier reaktionskinetische Untersuchungen aus: Hängt die Geschwindigkeit der Reaktion NUR von dem organischen Substrat ab oder von dem Substrat UND dem Nucleophil? Außerdem kann man stereochemische Untersuchungen durchführen: Kommt es bei chiralen Molekülen durch die Substitution zu einer Walden-Umkehr oder nicht? Thermodynamische Untersuchungen dagegen sind bei der Entscheidung SN1 oder SN2 nicht sinnvoll, denn allein kinetische Faktoren entscheiden hierüber. Ist die Aktivierungsenergie der SN2-Variante höher als die des ersten SN1-Schrittes, wird die SN1-Variante durchgeführt.