Spiegelbild-Isomerie
Enantiomerie ist eine Form der Stereoisomerie, bei der sich die beiden Stereoisomere wie Bild und Spiegelbild zueinander verhalten. Daher ist auch die Bezeichnung Spiegelbild-Isomerie für die Enantiomerie üblich.
Das Gegenteil der Enantiomerie ist die Diastereomerie. Bei dieser Art der Stereoisomerie verhalten sich die Isomere nicht wie Bild und Spiegelbild. Ein Beispiel für Diastereomerie ist die cis-trans-Isomerie der Alkene oder Cycloalkane.
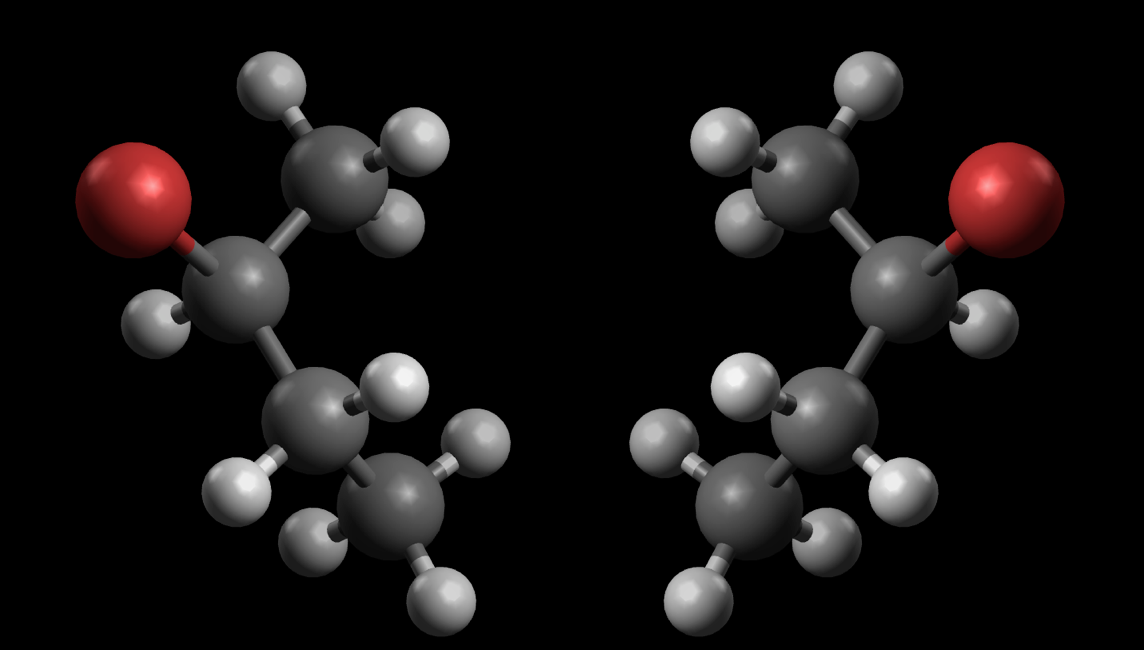
Bild und Spiegelbild des 2-Brom-butan
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen Sie Modelle von zwei Enantiomeren(= Spiegelbild-Isomeren) der Verbindung 2-Brombutan. Die beiden Strukturen verhalten sich wie Bild und Spiegelbild.
Wir können jetzt versuchen, verschiedene Bindungen zu drehen und zu wenden:
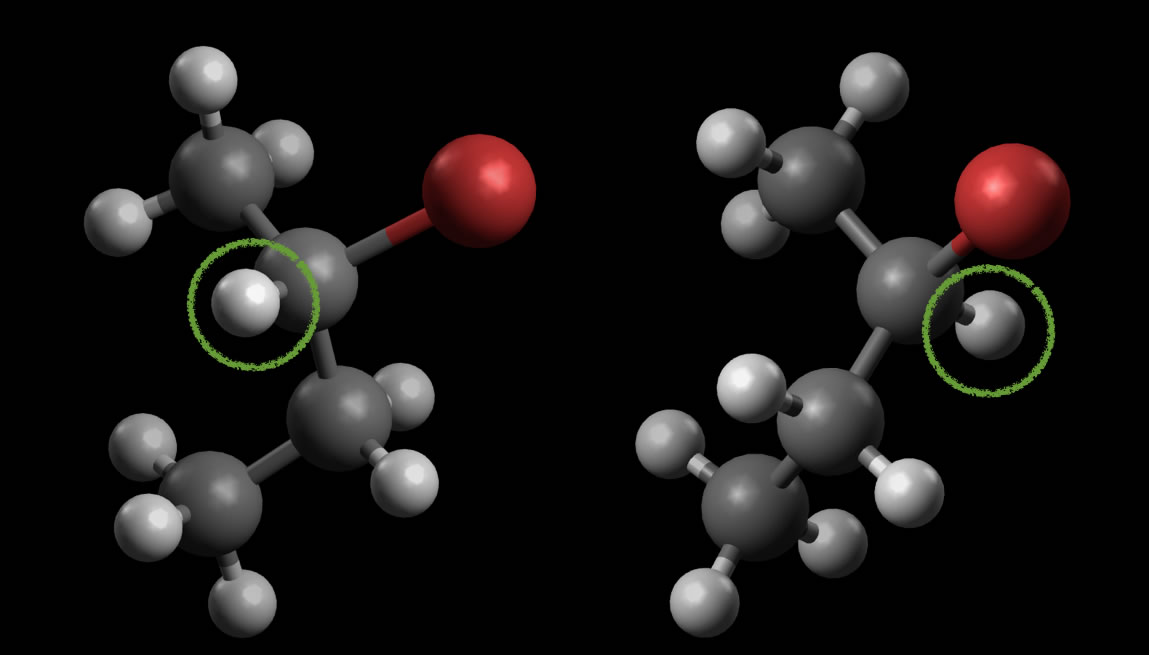
Das linke Molekül wird so gedreht, dass das Br-Atom nach rechts zeigt
Autor: Ulrich Helmich 2022, Lizenz: Public domain
In der Abbildung 2 wurde das linke Brom-Atom so gedreht, dass es ähnlich wie im rechten Molekül nach rechts zeigt. Achten Sie jetzt einmal auf das grün umkringelte H-Atom. Im linken Molekül zeigt es nach vorne, im rechten Molekül aber nach hinten. Die beiden Moleküle sind also nicht identisch.
Durch keine noch so geschickte Drehung schaffen wir es, das eine Enantiomer in das andere zu überführen. Es handelt sich also tatsächlich um zwei verschiedene Strukturen, die sich wie Bild und Spiegelbild verhalten. Da hier stets die gleichen Atome auf die gleiche Weise miteinander verknüpft sind (gleiche Konstitution), sind die physikalischen und chemischen Eigenschaften dieser beiden Spiegelbildisomere absolut identisch.
Enantiomere können sich in ihren Eigenschaften unterscheiden
In der Biologie ist es allerdings so, dass sich zwei Enantiomere durchaus in ihren Eigenschaften unterscheiden können. Die meisten Verbindungen werden in der Zelle von Enzymen umgesetzt, und Enzyme arbeiten streng nach dem Schlüssel-Schloss-Prinzip. Das jeweilige Substrat setzt sich passgenau in das aktive Zentrum des Enzyms hinein und wird dann verändert.

Die linke Hand passt nicht in den rechten Handschuh
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Genau so wenig, wie die linke Hand eines Menschen in einen rechten Handschuh hineinpasst, passt das Spiegelbild-Isomer eines Substrats in das aktive Zentrum eines Enzyms. Enzyme sind also nicht nur einfach substratspezifisch, sondern auch stereospezifisch.
R-S-Nomenklatur der Enantiomere Q1, Q2
Betrachten wir ein chirales Molekül, und zwar das 2-Brom-butan:
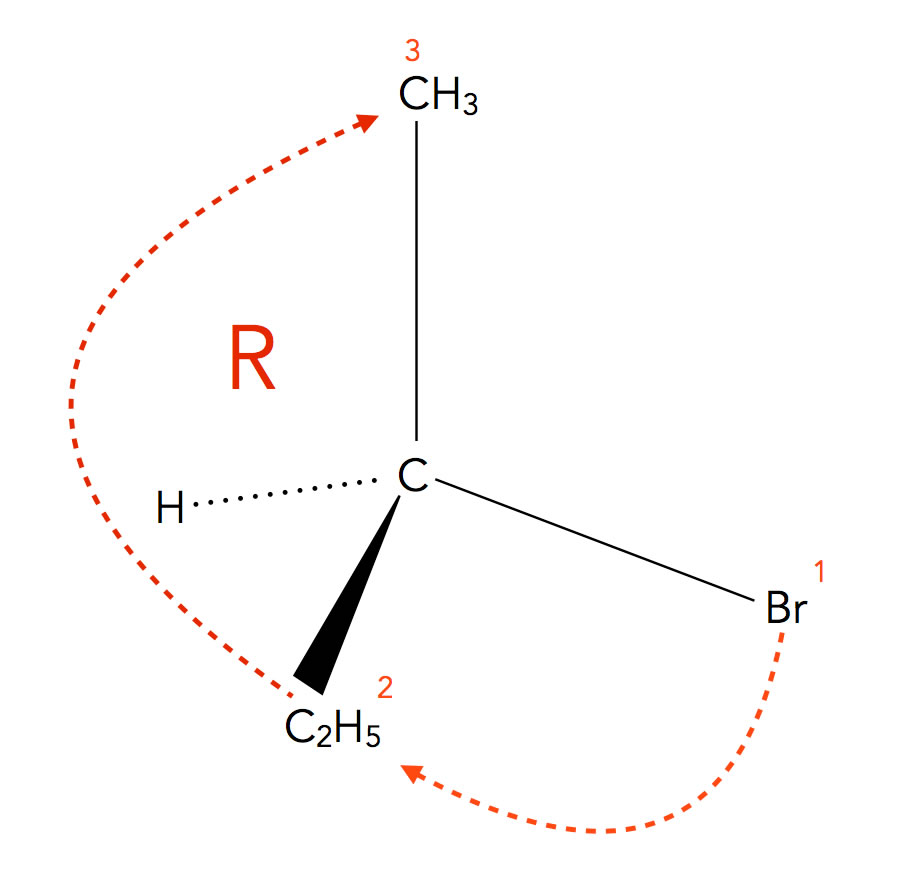
Die R-Konfiguration des 2-Brom-butans
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Warum wird diese Konfiguration des 2-Brom-butans als R-Konfiguration bezeichnet? Das R steht übrigens für "rectus" (rechts).
Verfahren:
Man dreht das chirale Molekül so, dass das Atom oder die Atomgruppe mit der niedrigsten Priorität nach hinten zeigt. Meistens ist das ein H-Atom. Dann verbindet man die drei anderen Substituenten nach abnehmender Priorität (siehe weiter unten).
In unserem Beispiel hat das Brom-Atom die höchste Priorität, dann folgt die Ethyl-Gruppe und schließlich die Methyl-Gruppe. Erfolgt die "Bewegung durch die Substituenten" im Uhrzeigersinn, spricht man von einer R-Konfiguration. Bei einer Bewegung entgegen dem Uhrzeigersinn würde man entsprechend von einer S-Konfiguration sprechen. Das S steht für "sinister" (links).
Bestimmung der Prioritäten:
Die Bestimmung der Prioritäten der Substituenten geht recht einfach: Der Substituent mit der höchsten Ordnungszahl hat die höchste Priorität. In unserem Beispiel hat das Brom-Atom mit der Ordnungszahl 35 die höchste Priorität.
Die Ethyl-Gruppe und die Methyl-Gruppe sind beide über ein C-Atom an das chirale C-Atom gebunden, beide C-Atome haben somit die gleiche Priorität. Aber auch für diesen Fall gibt es eine nachvollziehbare Lösung: Man muss jetzt darauf schauen, welche anderen Atome mit diesen C-Atomen verbunden sind.
Bei der Methyl-Gruppe ist das C-Atom nur mit drei H-Atomen der Ordnungszahl 1 verbunden.
Bei der Ethyl-Gruppe dagegen ist das C-Atom mit einem weiteren C-Atom (Ordnungszahl 12) verbunden. Daher hat die Ethyl-Gruppe eine höhere Priorität als die Methyl-Gruppe.
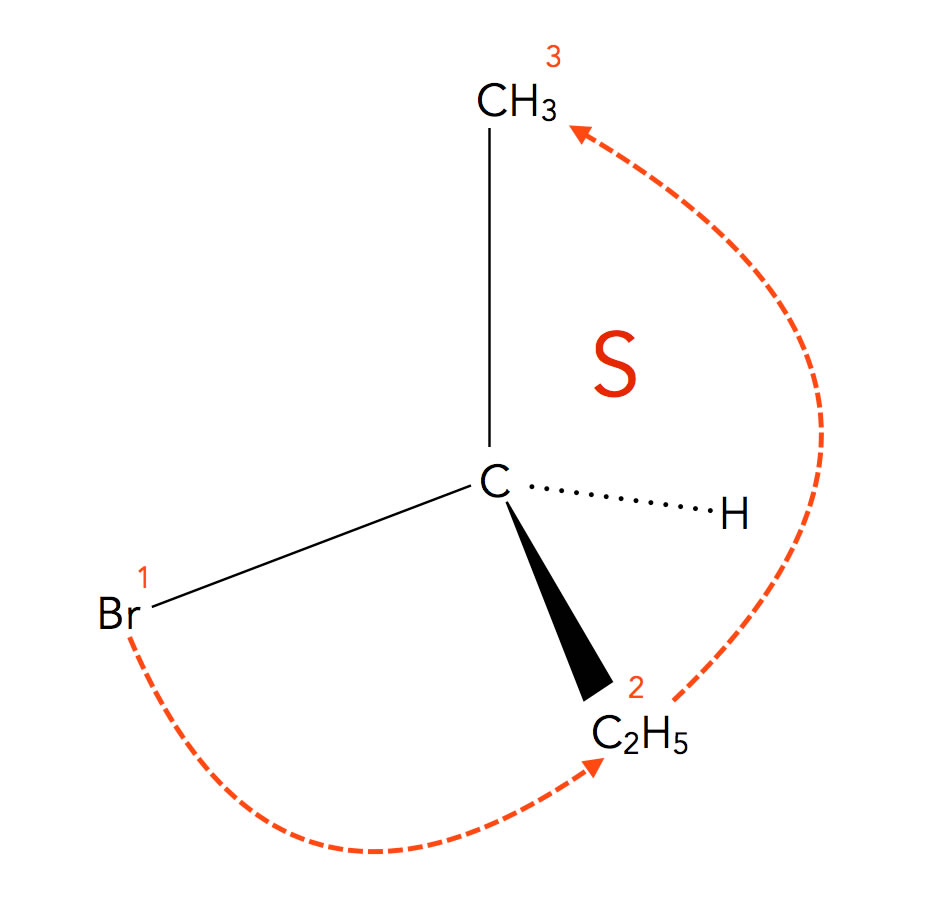
Die S-Konfiguration des 2-Brom-butans
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir das Spiegelbild, das Enantiomer des (R)-2-Brom-butans. Die Substituenten sind nun entgegen dem Uhrzeigersinn angeordnet.
Beispiel: Nucleophile Substitution SN2
Bei der nach dem SN2-Mechanismus ablaufenden nucleophilen Substitution kann es zu einer sogenannten Inversion kommen, bei der das organische Substrat in sein Spiegelbildisomer umgewandelt wird. Hier ein Beispiel:
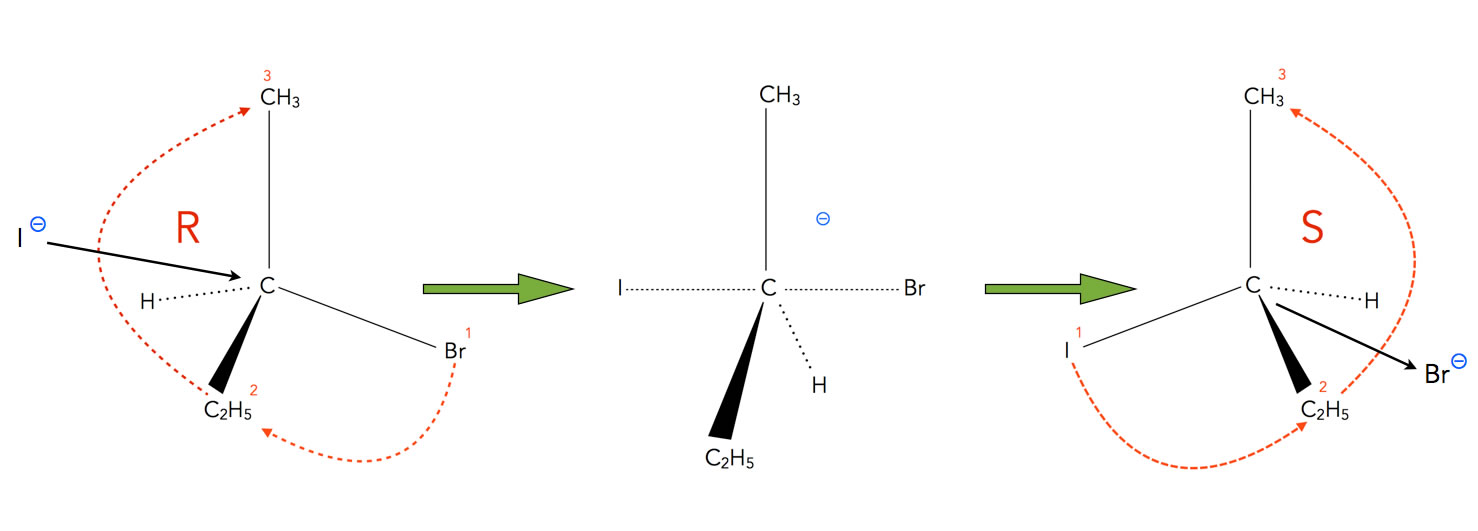
Die Inversion bei einer nucleophilen Substitution
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Nucleophil (hier ein Iod-Anion) nähert sich dem Substrat von der Rückseite (wenn wir das Br-Atom als Vorderseite betrachten). Es bildet sich ein pentavalenter Übergangszustand (den man nur mit dem Orbitalmodell und einer vorübergehenden sp2-Hybridisierung gut erklären kann). Wenn das das Nucleofug (also das Brom-Atom) nun aus dem Substrat herauslöst, nimmt das Substrat wieder eine tetraedrische (sp3-hybridisierte) Form an, die sich zum Ausgangsstoff aber wie ein Spiegelbild verhält. Diese Art der Inversion wird übrigens als Walden-Umkehr bezeichnet.
Auf dieser Seite finden Sie weitere Einzelheiten zur Nucleophilen Substitution.