Halogenalkane sind Alkane, bei denen ein oder mehrere Wasserstoff-Atome durch Halogen-Atome ersetzt worden sind. Die Halogenalkane werden oft auch als Alkylhalogenide bezeichnet, so zum Beispiel im Römpp Chemie-Lexikon[1].
Neben monosubstituierten Halogenalkanen wie zum Beispiel Chorethan gibt es auch mehrfach-substituierte Halogenalkane wie Trichlormethan (Chloroform). Halogenalkane können auch verschiedene Halogene enthalten, beispielsweise Fluor und Chlor gleichzeitig (FCKWs = Fluor-Chlor-Kohlenwasserstoffe).
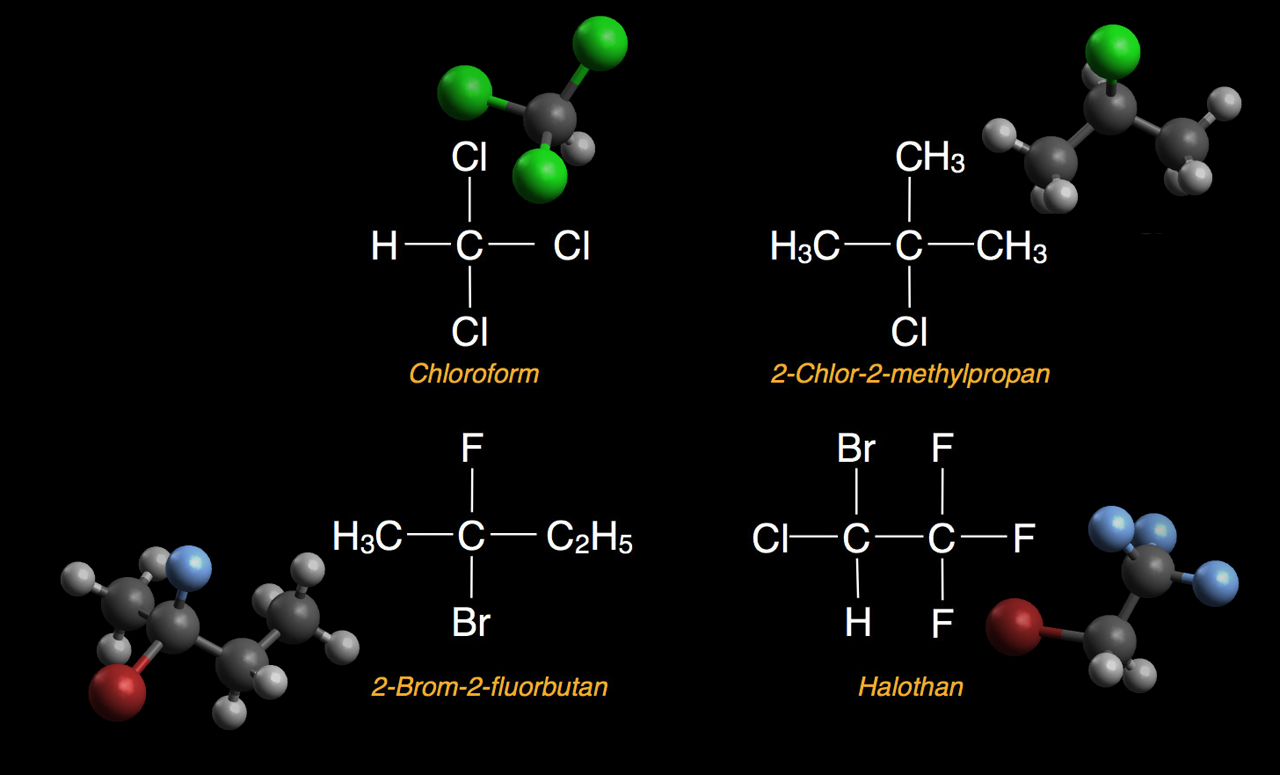
Einige Halogenalkane: Chloroform, 2-Chlor-2-methylpropan, 2-Brom-2-fluorbutan, Halothan
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Das Bild oben zeigt vier typische Halogenalkane als Strukturformel und als Molekülmodell.
Die C-X-Bindung
Halogenalkane unterscheiden sich von den Alkanen durch den Besitz von Halogen-Atomen (Fluor, Chlor, Brom oder Iod). Halogene sind elektronegativer als Kohlenstoff-Atome, daher ist die C-X-Bindung grundsätzlich polarisiert mit einem negativen Ladungsschwerpunkt am Halogen-Atom und einem positiven Ladungsschwerpunkt am Kohlenstoff-Atom der C-X-Bindung. Die Stärke der Polarisierung hängt von dem Elektronegativitäts-Unterschied zwischen dem C-Atom und dem Halogen-Atom ab. Bei der C-F-Bindung ist dieser EN-Unterschied am größten, bei der C-I-Bindung am geringsten. Die C-F-Bindung ist daher sehr stark polarisiert, die C-I-Bindung nur noch sehr schwach.
Streng genommen, ist die C-I-Bindung unpolar, denn sowohl Kohlenstoff wie auch Iod haben eine Elektronegativität von 2,5 - der EN-Unterschied ist also gleich Null.
EN-Unterschiede der C-X-Bindung
- C-F: 2,5-4,0 = -1,5
- C-Cl: 2,5-3,0 = -0,5
- C-Br: 2,5-2,8 = -0,3
- C-I: 2,5-2,5 = 0
Die Polarität der C-X-Bindung hat Auswirkungen sowohl auf die physikalischen wie auch auf die chemischen Eigenschaften der Halogenalkane.
Physikalische Eigenschaften
Siedepunkt, Schmelzpunkt und Dichte
Wegen der polaren C-X-Bindung, die den Halogenalkan-Molekülen einen mehr oder weniger starken permanenten Dipol-Charakter verleiht, sind die Siedepunkte, Schmelzpunkte und Dichten grundsätzlich höher als bei den entsprechenden Alkanen. So hat Butan einen Siedepunkt von 0,5 ºC, 1-Chlorbutan dagegen siedet bei 78 ºC. Allerdings ist dieser Siedepunkt niedriger als der von Butan-1-ol mit 117,7 ºC. Das wiederum liegt daran, dass die Halogenalkane keine Wasserstoffbrücken-Bindungen untereinander eingehen können, während die Alkohole das ja können.
Das Chlor- oder Brom-Atom könnte zwar theoretisch als H-Brücken-Akzeptor fungieren, allerdings besitzen die Halogenalkane keine H-Brücken-Donatoren, also keine H-Atome, die an elektronegativen Atomen wie O oder N gebunden sind.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane sind wegen des Dipol-Charakters höher als die der entsprechenden Alkane und wegen fehlender H-Brücken niedriger als die der entsprechenden Alkohole.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane steigen mit wachsender Kettenlänge, wie bei jeder homologen Reihe der organischen Verbindungen.
Einen erheblichen Einfluss auf die drei genannten Eigenschaften hat auch die Art des Halogens, das mit dem Alkan verbunden ist. So hat Fluorethan einen Siedepunkt von -37,1 ºC, während Iodethan bei +71 ºC siedet. Ursache hierfür ist erstens die höhere molare Masse des Iodethans (156 gegenüber 48 beim Fluorethan), und zweitens die leichte Polarisierbarkeit des Iod-Atom.
Wasserlöslichkeit
Die Wasserlöslichkeit der Halogenalkane ist sehr gering, aber immer noch deutlich höher als bei den entsprechenden Alkanen:
- Pentan: Wasserlöslichkeit = 39 mg / l Wasser
- 1-Chlorpentan: Wasserlöslichkeit = 200 mg / l Wasser
- 1-Pentanol: Wasserlöslichkeit = 22.000 mg / l Wasser
Das Chlorpentan ist also fast fünfmal besser wasserlöslich als das bei Zimmertemperatur ebenfalls flüssige Pentan. Allerdings ist der entsprechende Alkohol 1-Pentanol über 100 mal besser wasserlöslich als 1-Chlorpentan.
Offensichtlich hat die polare C-X-Bindung einen Einfluss auf die Wasserlöslichkeit. Dies ist zunächst etwas verwunderlich, da die Halogenalkane ja keine Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen können. Allerdings sind Halogenalkan-Moleküle permanente Dipole, genau wie Wasser-Moleküle. Daher können sich Keesom-Kräfte zwischen den Molekülen des Halogenalkans und den Wasser-Molekülen ausbilden.
Keesom-Kräfte sind van-der-Waals-Kräfte, die zwischen permanenten Dipolen bestehen. Neben diesen Keesom-Kräften gehören auch die Debye-Kräfte zwischen permanenten Dipolen und unpolaren Molekülen zu den van-der-Waals-Kräften, genauso wie die London-Kräfte zwischen zwei unpolaren Molekülen. In vielen Schulbüchern werden die London-Kräfte fälschlicherweise (oder stark vereinfachend) als van-der-Waals-Kräfte bezeichnet. Aber jetzt wissen Sie es ja besser!
Wie man beim Vergleich mit den entsprechenden Alkoholen sieht, sind diese Keesom-Kräfte aber sehr schwach im Gegensatz zu den Wasserstoffbrücken-Bindungen, die sich zwischen den OH-Gruppen der Alkohole und den Wasser-Molekülen bilden können.
Chemische Eigenschaften, Reaktionen
Halogenalkane können eine Vielzahl chemischer Reaktionen eingehen, vor allem zu nennen sind hier die radikalische Substitution, die nucleophile Substitution und die Eliminierung.
Ähnlich wie Alkane können auch Halogenalkane eine radikalische Substitution eingehen, dabei werden H-Atome des Halogenalkans durch weitere Halogen-Atome ersetzt. Aus einem Chloralkan kann so zum Beispiel ein polychloriertes Alkan oder ein Fluorchloralkan werden.
Bei der nucleophilen Substitution wird kein H-Atom ersetzt, sondern ein Halogen-Atom. Es kann beispielsweise durch ein anderes Halogen-Atom ausgetauscht werden. Auf diese Weise werden zum Beispiel die Iodalkane hergestellt. An sich reagiert Iod nicht mit Alkanen, weil es zu reaktionsträge ist. Aber versetzt man Chloralkane mit Natriumiodid, so kann das zu einer Substitution der Chlor-Atome durch Iod-Atome führen.
Bei der Eliminierung wird in der Regel Halogenwasserstoff freigesetzt, es bildet sich dann ein Alken. Aus 2-Chlorpropan könnte dann beispielsweise Propen entstehen.
Darstellung
Halogenalkane werden durch radikalische Substitution aus Alkanen, durch elektrophile Addition aus Alkenen oder durch nucleophile Substitution aus Alkoholen oder anderen Verbindungen hergestellt.